基因沉默肽基精氨酸脫亞胺酶4的表達對膠原誘導關節炎小鼠肺間質病變的影響
趙 凱,常志芳,王志華,龐春艷,王永福
(內蒙古科技大學包頭醫學院第一附屬醫院風濕免疫科,內蒙古自治區自體免疫學重點實驗室, 內蒙古包頭 014010)
類風濕關節炎(rheumatoid anhritis,RA)是一種累及免疫系統的疾病,通常以滑膜炎為主要病理改變,以慢性關節炎為主要臨床特點[1]。RA患者的血清中包含多種自身抗體,瓜氨酸存在與這些抗體識別的表位[2]。肽基精氨酸脫亞胺酶4(peptidyl arginine deaminase 4,PAD4)可以在鈣離子存在的環境中使精氨酸殘基脫去亞氨基,從而生成瓜氨酸化蛋白[3],該蛋白與RA發病機制有關。研究顯示,PAD4的活性失調與 RA 疾病的發生與發展存在一定的聯系[4]。人體的免疫系統又將瓜氨酸化蛋白定義為外來物質,最終發生自身免疫反應,引起 RA 的發生與發展。RA 患者體內的自身抗體可以識別瓜氨酸化蛋白,人體內瓜氨酸化蛋白的程度與RA 的疾病進展直接相關,而PAD4則被認為是RA治療藥物研究的一個新靶酶。
RA患者體內免疫調節功能紊亂,可導致多種并發癥的出現,而肺最容易受累。間質性肺病(interstitial lung disease,ILD)是RA關節外并發癥中最常見的疾病,可有肺實質的彌漫性改變、肺泡炎癥,以及間質纖維化的病理改變,經常導致較高的發病率和病死率。當RA患者肺部出現并發癥時常會產生瓜氨酸化蛋白,從而引起免疫反應生成相應的抗瓜氨酸化蛋白抗體。而PAD4可催化瓜氨酸化,導致RA的進展,可能與ILD的發病有一定的相關性。瓜氨酸化,在RA細胞內和細胞外均呈現的是失調狀態,在嗜中性粒細胞中,穿孔素、膜攻擊復合物、細菌產生的毒素可誘導PAD的鈣離子內流、細胞溶解和過度活化。這些因素可能分別驅動RA關節外臟器的過度纖維化[5]。因此,本研究旨在針對基因PAD4設計3段 siRNA序列,同時建立CIA小鼠模型,將3段siRNA尾靜脈注射入小鼠體內,觀察其對CIA小鼠肺間質病變的治療作用及其機制,為PAD4-siRNA對RA的治療提供實驗基礎數據。
1 材料與方法
1.1 實驗研究對象
6~8周齡的DBA/1小鼠,雄性,購于南京大學動物模式研究所,動物批號為N000219。
1.2 試劑及儀器
反轉錄試劑盒購自ThermoFisher(中國)公司,磷酸緩沖液購自美國Gibco公司,紅細胞裂解液購自日本Takara公司,澳洲源優級胎牛血清購自美國Gibco公司,RPMI-1640培養基購自生工生物工程(上海)股份有限公司,完全弗氏佐劑、牛 Ⅱ 型膠原購自美國Chondrex公司,APC-Foxp3、PE-CXCR5、FITC-CD4購自美國Abcam公司,熒光定量PCR儀購自中國BIOER公司,流式細胞儀購自美國BD公司。
1.3 實驗方法
1.3.1針對基因PAD4設計3段 siRNA序列并構建腺病毒載體 使用siRNA在線設計軟件根據其設計原則,依據小鼠基因 PAD4 cDNA序列設計3段 siRNA序列,送上海吉凱公司合成并構建腺病毒載體,經基因測序鑒定,轉染293細胞制備病毒,流式細胞儀鑒定病毒滴度。
1.3.2建立膠原誘導的關節炎小鼠模型 6~8周齡的DBA/1小鼠,雄性,40只,將牛Ⅱ型膠原與完全弗氏佐劑混和并充分乳化,牛Ⅱ型膠原(質量)濃度為2 g/L(mg/mL),完全弗氏佐劑的(質量)濃度為5 g/L,于DBA/l小鼠尾根部皮內注射上述乳化好的膠原進行初次免疫。21 d后使用同樣方法進行再次免疫。35 d后DBA/1小鼠的爪出現紅腫,即CIA小鼠的模型已經建立。
1.3.3腺病毒尾靜脈注射 實驗分6組,每組4只。(1)空白組:沒有進行任何處理的小鼠;(2)模型組:CIA造模成功后沒有進行任何治療;(3)陰性對照組:CIA造模成功后注射感染陰性病毒液;(4)PAD4-siRNA1組:CIA造模成功后注射PAD4-siRNA1病毒液;(5)PAD4-siRNA2組:CIA造模成功后,注射PADA4-siRNA2病毒液;(6)PAD4-siRNA3組:CIA造模成功后,注射PAD4-siRNA3病毒液。(3)~(6)組小鼠注射100 μL/只,每周1次,共8次。實驗結束后處死小鼠。
1.3.4小鼠肺PAD4 mRNA和蛋白表達水平檢測 取肺,使用Trizol提取肺中RNA,用反轉錄試劑盒將RNA逆轉錄合成cDNA,采用實時熒光定量RT-PCR(qRT-PCR)檢測PAD4 mRNA的表達水平,對切片進行免疫組織化學檢測PAD4 蛋白的表達位置和表達水平。
1.3.5小鼠脾細胞中Tfh細胞和Tfr細胞的檢測 實驗結束,處死小鼠,無菌條件下取脾,PBS洗滌,研磨,細胞篩過濾,1 000 r/min 離心5 min,將細胞懸液移至細胞培養皿中,加5 mL含10%(體積分數)胎牛血清(fetal calf serum,FCS)的完全培養基RPMI-1640,加PMA/Ionomycin混合物和BFA/ Monensin混合物,放入細胞培養箱,5% (體積分數)CO2,37 ℃培養,流式細胞術檢測。
1.3.6小鼠肺PAD4病理學觀察 小鼠肺組織切片進行HE染色后,光學顯微鏡下觀察肺組織的病理學變化。
1.4 統計學分析
采用SPSS20.0統計軟件,計量資料數據采用均數±標準差表示,多組間比較采用單因素方差分析,Levene法檢驗,方差齊的數據采用LSD法,方差不齊的數據采用Tamhane’s法;兩組間比較采用t檢驗。所有數據采用雙側檢驗,P<0.05認為差異有統計學意義。
2 結果
2.1 PAD4-siRNA治療后小鼠肺中PAD4 mRNA的表達
模型組與空白對照組小鼠比較,PAD4 mRNA的表達增加,差異有統計學意義(3.97±1.47vs. 1.00±0.00,P<0.05);PAD4-siRNA治療后CIA小鼠肺PAD4 mRNA的表達水平較模型組和陰性對照組明顯減少,差異有統計學意義(P<0.05)。
2.2 PAD4-siRNA治療后小鼠肺PAD4蛋白的表達
空白組小鼠肺組織中紅色熒光較少,而模型組和陰性對照組小鼠肺組織的炎細胞浸潤區和氣管周圍可見較多的紅色熒光,PAD4-siRNA治療后3組的紅色熒光明顯減少,即CIA小鼠的肺組織可見PAD4的高表達,并且PAD4蛋白多表達于炎性細胞浸潤區和氣管周圍,而采用PAD4-siRNA治療后小鼠肺中PAD4的表達水平降低(圖1)。

A, blank group; B, model group; C, negative control group; D, PAD4-siRNA1 group; E, PAD4-siRNA2 group; F, PAD4-siRNA3 group.圖1 小鼠肺中PAD4蛋白的表達Figure 1 The PAD4 protein expression in the lungs of CIA mouse
2.3 PAD4-siRNA治療后小鼠脾細胞中Tfh細胞的比例
模型組小鼠脾細胞中的Tfh細胞比例明顯增加,與空白組比較差異有統計學意義 (P<0.05);而治療后的小鼠脾細胞中的Tfh細胞比例較模型組和陰性對照組明顯降低(P<0.05,圖2)。
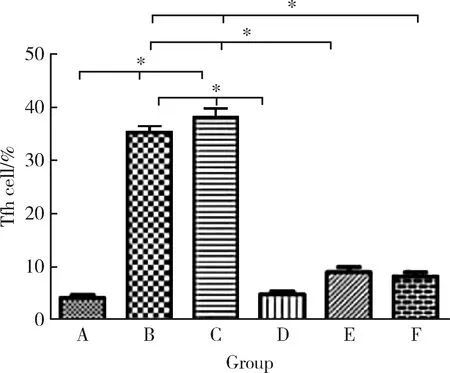
A, blank group; B, model group; C, negative control group; D, PAD4-siRNA1 group; E, PAD4-siRNA2 group; F, PAD4-siRNA3 group.*P<0.05.圖2 小鼠脾細胞中Tfh細胞的比例Figure 2 The proportion of Tfh cells in splenocytes of CIA mouse
2.4 PAD4-siRNA治療后小鼠脾細胞中Tfr細胞的比例
模型組小鼠脾細胞中的Tfr細胞比例明顯降低,與對照組比較差異有統計學意義 (P<0.05);治療后小鼠脾細胞中的Tfr細胞比例較模型組和陰性對照組明顯增加,但只有PAD4-siRNA2組差異有統計學意義(P<0.05,圖3)。
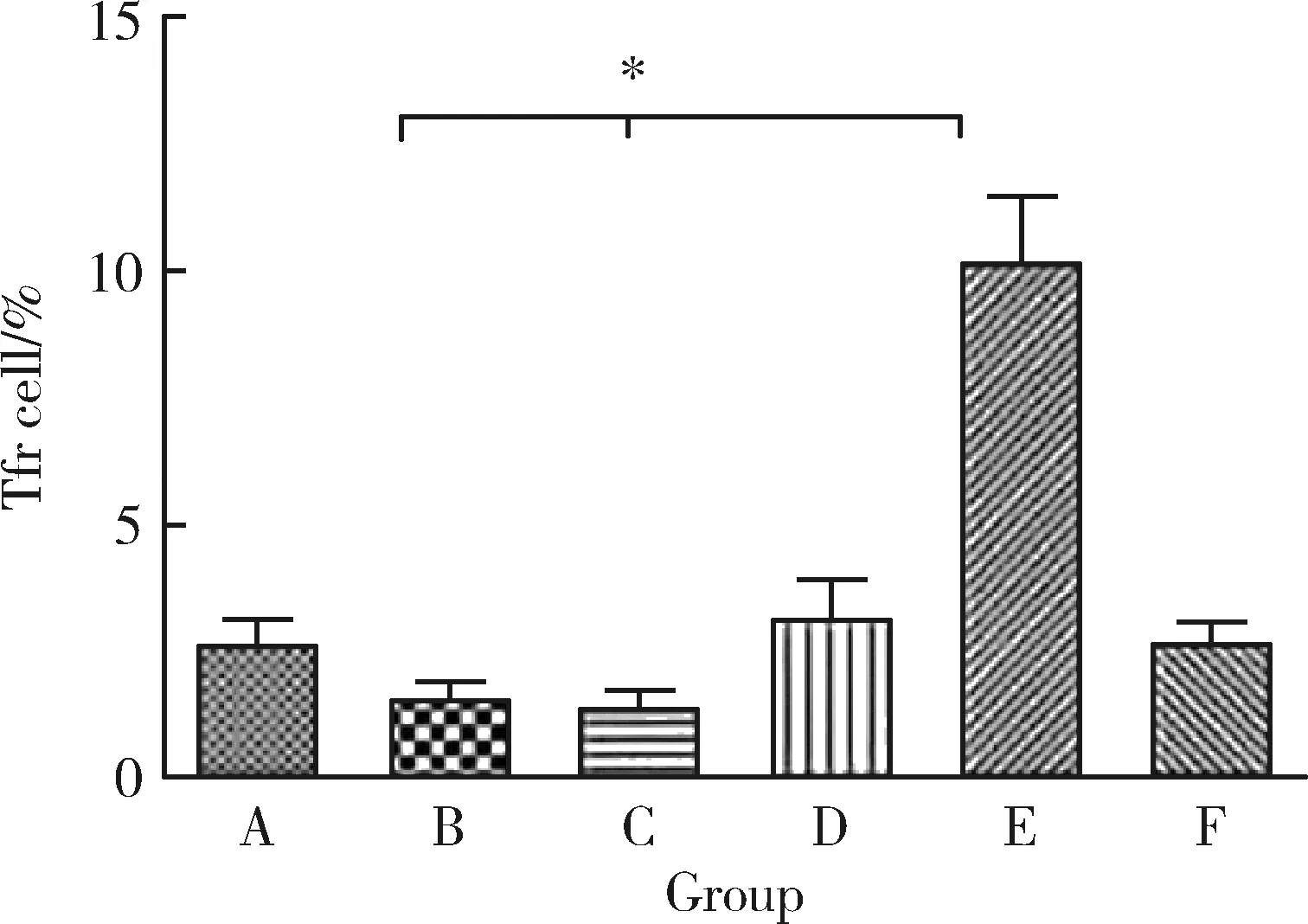
A, blank group; B, model group; C, negative control group; D, PAD4-siRNA1 group; E, PAD4-siRNA2 group; F, PAD4-siRNA3 group.*P<0.05.圖3 小鼠脾細胞中Tfr細胞的比例Figure 3 The proportion of Tfr cells in splenocytes of CIA mouse
2.5 PAD4-siRNA治療后小鼠脾細胞中Tfh/Tfr值的變化
模型組小鼠脾細胞中的Tfh/Tfr值明顯增高,與對照組比較差異有統計學意義(P<0.05);PAD4-siRNA治療后小鼠脾細胞中的Tfh/Tfr值較模型組和陰性對照組明顯降低(P<0.05,圖4)。

A, blank group; B, model group; C, negative control group; D, PAD4-siRNA1 group; E, PAD4-siRNA2 group; F, PAD4-siRNA3 group.*P<0.05.圖4 小鼠脾細胞中Tfh/Tfr值的變化Figure 4 The changes of Tfh/Tfr cells in splenocytes of CIA mouse
2.6 PAD4-siRNA治療后小鼠肺的病理改變
空白組小鼠肺的肺泡壁及氣管結構形態正常,未見炎性細胞浸潤,未見間質纖維組織形成;而模型組小鼠肺中可見肺結構紊亂,正常肺泡明顯減少,肺泡變形及間隔增寬,血管壁可見炎性細胞浸潤,肺組織廣泛纖維化;而治療后的3組小鼠與模型組和陰性對照組比較,可見肺結構紊亂減少,炎性細胞浸潤降低,肺泡壁破壞減少,以及間質纖維化程度降低(圖5)。
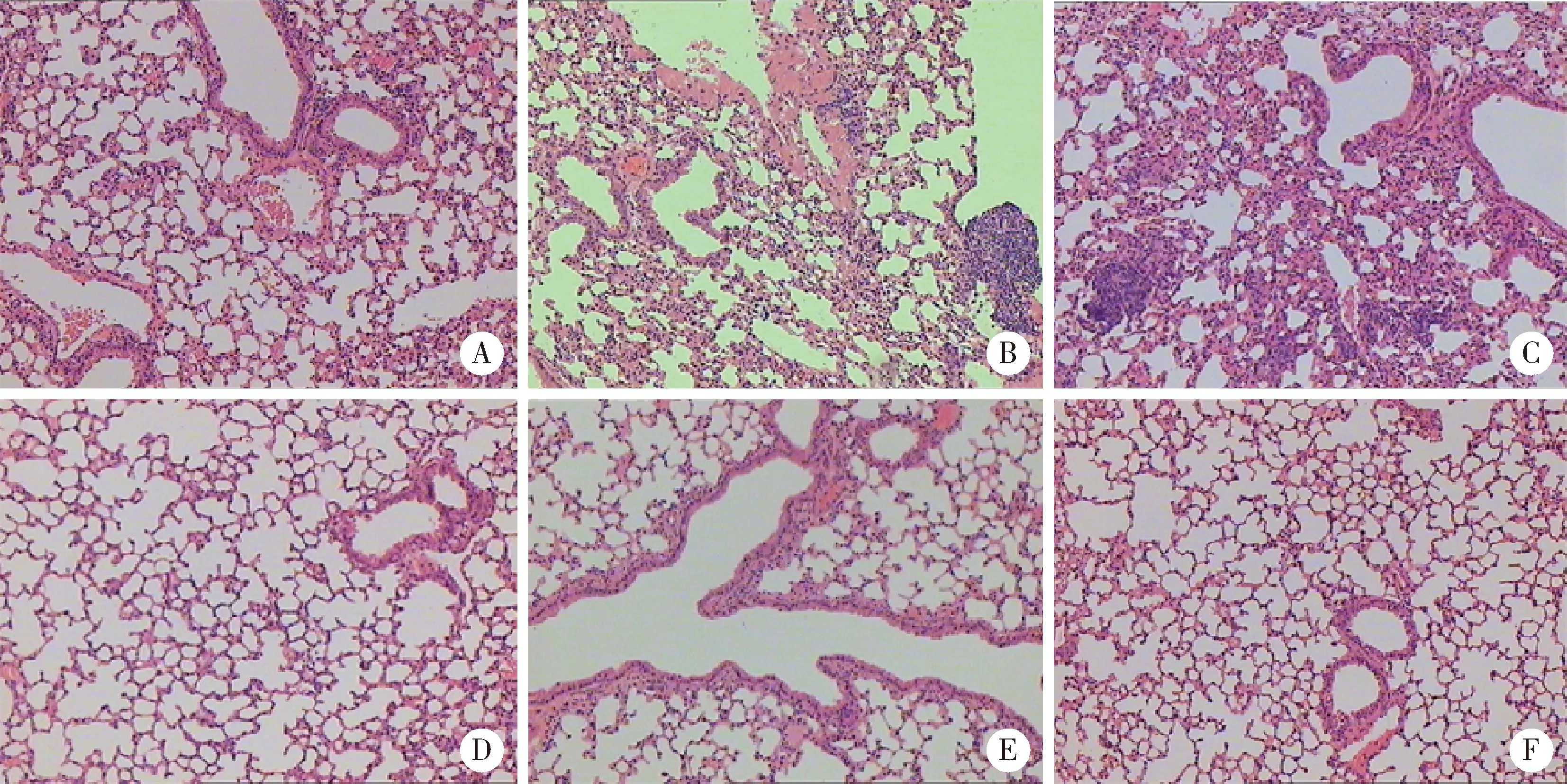
A, blank group; B, model group; C, negative control group; D, PAD4-siRNA1 group; E, PAD4-siRNA2 group; F, PAD4-siRNA3 group.圖5 小鼠肺的組織病理學改變Figure 5 The pathological changes in the lungs of CIA mouse
3 討論
RA是一種慢性炎癥性關節病,通常可引起軟骨和骨損傷,RA又是全身慢性自身免疫性疾病,全身多臟器都可累及,以肺累及最明顯。
肺部受累是RA的常見關節外特征,累及肺時臨床表現多樣,包括胸膜炎、胸腔積液以及氣道疾病,常見的臨床表現有閉塞性細支氣管炎、類風濕結節以及ILD[6]。研究者在觀察CIA大鼠模型肺不同時間的病理變化時發現CIA大鼠肺受累經歷了從肺泡炎至間質性肺病的過程,證明RA發展過程中肺受累可導致其肺泡和肺間質的改變[7]。Darrah等[8]研究發現PAD4是RA發病機制中的關鍵酶,并且抗PAD4抗體與嚴重的關節病變和肺病變相關。PAD4的活性失調與 RA 疾病的發生與發展存在一定的聯系,抗PAD4自身抗體可能是RA中重要的生物標志物。本課題組前期的研究(另文發表)中也發現CIA小鼠除了有明顯的關節病變外,肺會出現間質病變。因此,本實驗設計了3段PAD4-siRNA尾靜脈注射CIA小鼠,結果發現CIA小鼠的肺中PAD4 mRNA和蛋白的表達水平升高,且PAD4蛋白多表達于炎性細胞浸潤區和氣管周圍,采用siRNA技術沉默PAD4的表達后,CIA小鼠肺組織中PAD4 mRNA和蛋白的表達水平降低。CIA小鼠肺組織可見肺結構紊亂,正常肺泡明顯減少,肺泡變形及間隔增寬,血管壁可見炎性細胞浸潤,肺組織廣泛纖維化,PAD4-siRNA治療后CIA小鼠肺組織的病理改變減輕,炎性細胞浸潤降低,肺泡壁破壞減少以及間質纖維化程度降低,提示PAD4確實參與了CIA小鼠肺間質病變的發生,CIA小鼠引起關節病變的同時確實可導致肺間質病變的發生,而PAD4-siRNA可以減輕這種肺間質病變的程度。
RA疾病的進展是免疫細胞相互作用的結果,Tfr與Tfh這兩種細胞在RA的發生發展中也起到了重要的作用[9]。Tfh細胞輔助 B淋巴細胞在自身免疫疾病中發揮核心作用,而Tfr控制生發中心中Tfh和B細胞的過度活化[10],Tfh和Tfr自身的改變以及二者比例的失衡都會導致RA的發展。Wang等[11]發現,RA患者的Tfh和Tfr細胞比健康人群均增加。更重要的是,Tfr / Tfh值降低,表明Tfh和Tfr之間的平衡被破壞[12]。本研究發現CIA小鼠脾細胞中Tfh細胞的比例升高、Tfr細胞的比例明顯降低、Tfh/Tfr值明顯增高,而經過PAD4-siRNA治療后的小鼠Tfh細胞比例下降、Tfr含量升高、Tfh/Tfr值明顯降低,這些結果表明Tfh和Tfr細胞均參與了CIA小鼠的發病,而PAD4-siRNA沉默PAD4的表達后,可抑制Tfh細胞的產生、促進Tfr細胞的生成、逆轉Tfh/Tfr的比例,進而發揮治療CIA小鼠肺間質病變的作用。
綜上所述,CIA小鼠發病的過程會導致肺的病理改變,PAD4-siRNA沉默其mRNA和蛋白的表達后,可以通過調節Tfh和Tfr細胞的比例(平衡)而發揮治療肺間質病變的作用。

