性別控制技術的研究與應用進展
蔡健鋒,潘淳燁,黎文聰,陳慧芳,張獻偉,白銀山*
(1.佛山科學技術學院生命科學與工程學院,廣東佛山 528231;2.溫氏食品集團股份有限公司,廣東新興 527439)
性別控制是使動物按照人們所希望的性別繁殖后代的技術[1-2]。隨著畜牧業智能化的發展,人類對特定性別的畜禽需求顯著增大,因此性別控制技術在畜禽繁殖中有重要的研究價值。根據X、Y 精子DNA 含量的差異,運用流式細胞技術可以有效分離X、Y 精子[3-5]。在奶牛繁育中,運用流式細胞儀分選X、Y 精子進行性別控制,獲得的母犢率超過90%,且成活率、體重等與自然交配后代無顯著差異,極大地提高了經濟效益[6]。研究顯示,通過調控X、Y 精子活力的分離方法以及根據X、Y 精子蛋白特異性表達通過免疫學技術分離X、Y 精子的方法,都能獲得較好效果[7-8]。這些技術是在配子水平上進行性別控制,不影響基因表達和生殖發育,但目前研究并不完善。
性別差異使畜禽肉品質存在顯著不同,根據性別分化規律人為干預性別分化基因的表達,可實現畜禽性別反轉,促進肉品質改善,這將成為畜禽生產中有應用前景的技術[9-10]。通過基因編輯技術使性連鎖基因缺失也能改變后代性別的比例[11-12],表明通過改變基因表達獲得特定性別后代的可行性。本文綜述了性別決定基因調控分子機制,探討了性別反轉技術機制及應用前景,匯總了最新的X、Y 精子分離技術的方法并分析其優缺點,以促進性別控制技術的應用和推廣。
1 性別分化調控機制
性別分化始于性腺的形成和發育,原生殖細胞(Primordial Germ Cells,PGCs)經遷移與體細胞形成生殖腺,隨后向睪丸或卵巢分化[13-14]。該過程依賴于睪丸或卵巢特異性通路的激活,2 個不同的通路激活其中一個則會持續抑制另一通路,如果人為干預來選擇特定通路,則會出現性別反轉[13]。
1.1 睪丸發育的基因調控SRY(Sex-Determining Region of the Y Chromosome)已被證實為雄性動物Y 染色體中起性別決定作用的主開關,是驅動睪丸發育信號通路的關鍵基因[13],貫穿整個雄性動物睪丸發育,能激活SOX9(Sry-Related Hmg-Box Gene 9)的表達[15]。它與下游SOX9 調控了包括WT1(Wilms Tumor 1)、NR5A1(Nuclear Receptor Subfamily 5,Group A,Member 1)、MAPK(Mitogen-Activated Protein Kinase)、GATA4(Gata-Binding Factor 4)和DMRT1(Doublesex and Mab-3 Relatated Transcription Factor 1)等基因的表達,促進睪丸發育[13,16]。
當生殖腺開始向睪丸分化時,EMX2(Empty Spiracles Homeobox 2)與LHX9(Lim Homeobox 9)開始表達,LHX9和WT1可以激活NR5A1表達,最重要的是NR5A1與WT1啟動了AMH(Anti-Müllerian Hormone)表達,誘導繆勒氏管退化,刺激附睪、輸精管和精囊等雄性生殖器發育[17];CBX2(Chromobox Homolog2)不僅能促進性腺形成,也能促進NR5A1、WT1和SRY的轉錄[13,18]。當進入睪丸發育時期,SOX9的表達開啟了睪丸分化。SOX9可以通過睪丸增強子核心序列TESCO(Testis-Specific Enhancer Core)調節自身轉錄,也可以與FGF9(Fibroblast Growth Factor 9)、PTGDS(Prostaglandin D Synthase)形成彼此促進表達的正向調控循環[19],維持高水平表達狀態,取代SRY的調節功能,促進支持細胞譜系分化,誘導睪丸進一步發育[20]。研究顯示在睪丸分化的成熟階段,DMRT1對于維持哺乳動物睪丸后期發育是至關重要的。DMRT1位于減數分裂前的生殖細胞和支持細胞中[21],它可以抑制卵巢發育關鍵基因FOXL2(Forkhead Box L2)表達以維持睪丸發育,這種抑制作用一直持續到機體成年[16]。此外,DMRT1在雞胚早期繆勒氏管中表達,參與導管形成的調控[22](圖1)。
1.2 卵巢發育的基因調控 卵巢發育是以抑制雄性特異性基因表達為發育基礎,通過WNT/CTNNB1 信號通路調控卵巢發育,促進卵巢發育基因的表達,促使雌性動物卵巢發育[13,16,20]。在性腺向卵巢發育時,RSPO1(R-Spondin 1)與WNT4(Wingless Type Mmtv IntegrationSite Family,Member 4)相互協同促進CTNNB1(Catenin Beta 1)表達,激活基因FOXL2抑制SOX9的表達來促進卵巢發 育[20]。FOXL2、RSPO1、WNT4和CTNNB1的 表達能調控多種基因的轉錄,包括重要的卵巢成分和卵泡抑素基因FST(Follistatin)的表達,促使性腺發育開啟卵巢的發育[13,20]。研究發現,FOXL2發揮維持卵巢組織和卵泡發育的主要作用,通過抑制WT1表達來阻止卵巢發育中NR5A1表達,同時在卵巢發育過程阻滯SOX9表達,可防止性別反轉。當進入卵巢成熟階段 時,FOXL2與RUNX1(Runt-Related Transcription Factor-1)相互促進,降低DMRT1表達水平,正向調控芳香化酶基因(Ytochmme P450,Family 19,Subfamily A,Polypeptide 1,CYP19A1)等表達,從而維持和促進卵巢發育[23](圖1)。
2 性別反轉調控
性別反轉是指由于某些原因,后代出現表型與性染色體不符的情況[24],是生物個體從一種性別特征轉變為另一種性別的現象[25],發生反轉的只是生殖腺及表型性征改變而染色體組型不改變[26]。自然界中一些低等動物隨著環境的變化可以改變性別,例如紅耳龜在溫度過高時產生的為雌性,溫度低時則為雄性[27],但高等動物目前只能通過基因和激素調控的方式人為實現反轉,這是通過性別分化機制啟動性別反轉控制的一種方式。早在1991 年,研究者首次把存在SRY的Y 染色體片段導入雌鼠胚胎中,使部分雌性小鼠發育成雄性,證明了性別反轉在動物性別控制應用的可行性[28]。性別反轉能改變動物的肉品質,公豬性別反轉后的母豬不會存在雄烯酮和滑板醇造成豬肉污染的現象[10];但目前性別反轉技術大部分用于科學研究,不能用于生產,究其原因是沒有簡便的技術去敲除或抑制相關性別分化的決定基因,并且性別反轉個體產生可育后代的成功率較低、成本過高。
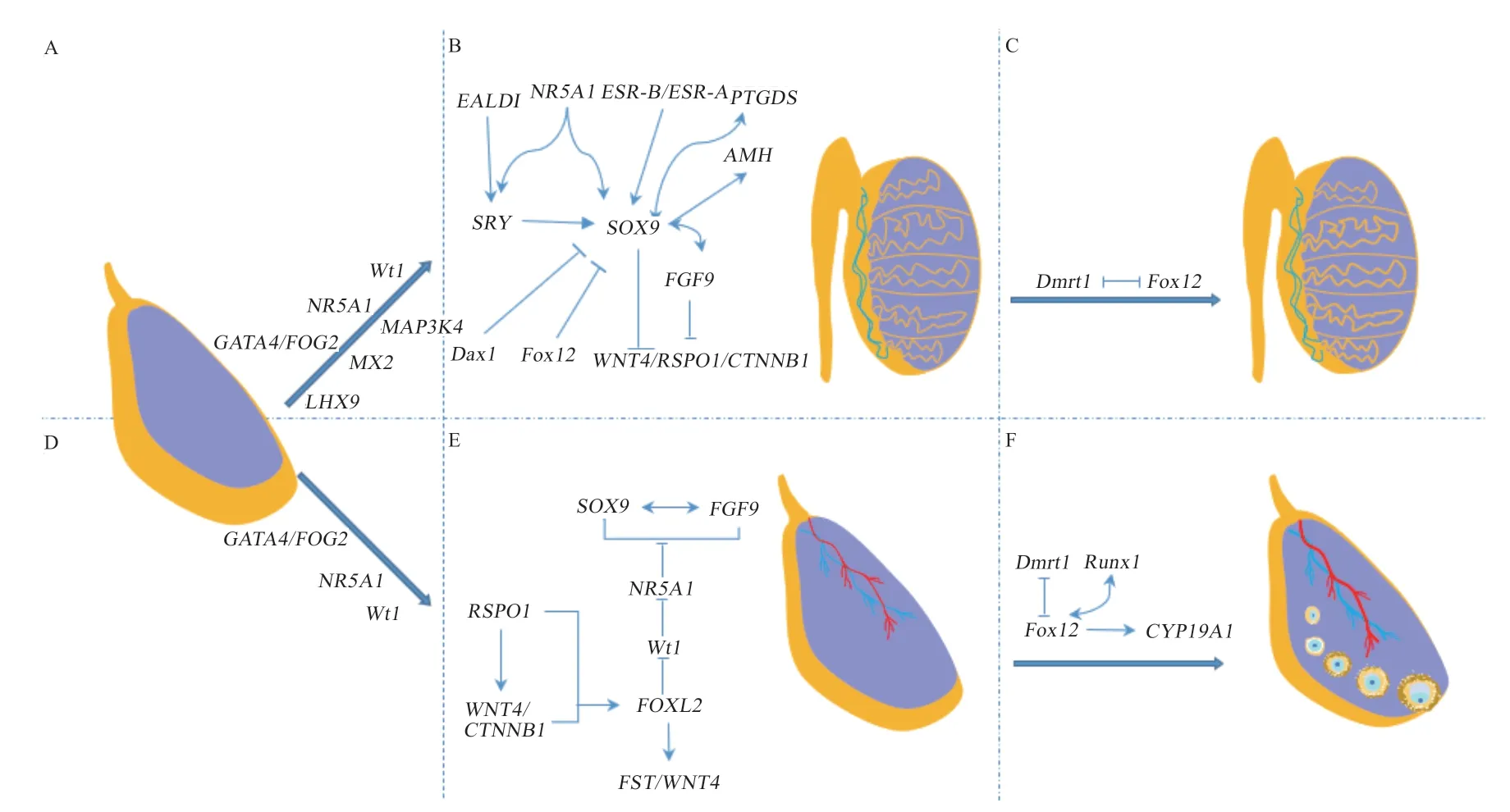
圖1 基因在哺乳動物性腺分化中的調控
研究發現,有些性別反轉動物也能繁殖后代[10,24]。研究者應用CRISPR/Cas9 質粒顯微注射到原核期受精卵的細胞質中,通過破壞兔SRY基因5'側翼區的Sp1-B 和Sp1-C 結合位點導致雄性動物性反轉為雌性[10]。隨后將囊胚期胚胎移植后得到12 只性反轉兔,暗示具有雌性表型的SRY基因敲除的雄性兔子可能維持懷孕并產下活的幼崽[10]。此外,能產生性別反轉后代的B6.XYTIR雄性小鼠與B6 野生型雌鼠交配后,同時產生XX 雌性、XY 雄性以及擁有完整雌性生殖系統的XY 性反轉雌性小鼠。其中,根據XY 性反轉雌性小鼠在所有XY 小鼠后代的比例,性反轉率為47.47%,而后代XYTIR 雄性仍可以繼續繁殖并遺傳到性反轉后代[24]。
SOX9是性別調控的關鍵基因,調控其表達會造成性別反轉。增強子A(Sex Reversal Enhancer-A,ESR-A)、增強子B(Sex Reversal Enhancer-B,ESR-B)以及增強子3(Enhancer Alternate Long-Distance Initiator,EALDI3)參與了SRY激活SOX9表達的進程[15]。研究發現,利用基因組編輯技術將ESR-A同源增強子ENH13(Enhancer 13)敲除后,獲得了雄性轉雌性的性別反轉[29]。同樣,運用CRISPR/Cas9 介導的EALDI3缺失小鼠也實現了性別反轉[15]。
在雞胚孵化過程中,通過RNAi 技術敲除早期雄性雞胚中DMRT1表達,降低SOX9水平,FOXL2水平提高,激活芳香化酶CYP19A1,大量合成雌激素,導致性別反轉[30]。有研究將帶有外源DMRT1 基因的表達載體轉到雌性雞胚的性腺內,使雌性生殖腺中DMRT1高表達,激活了睪丸發育通路,最終實現雌雞性反轉為雄雞[31]。也有研究在構建鴨胚性別反轉模型時,注射芳香化酶抑制劑能使母鴨性反轉,注射雌二醇能使公鴨性反轉[32]。研究者將芳香化酶抑制劑Formestane(類固醇型)和Letrozole(非類固醇型)注射孵化7 d 的番鴨胚蛋,其雛鴨雄性率分別為87.5%和86.7%[33]。
3 X 和Y 精子分離技術
X 和Y 精子分離技術是通過利用X、Y 精子之間的差異來進行分離,如精子頭部細胞核大小、X、Y 精子重量、精子外膜電荷上的差異、運動速度的差異、耐酸堿差異、抗原性差異及檢測Y 精子上特有的F 小體等[34-35]。Lush[36]研究報道,利用精子密度的大小,通過高速離心進行X、Y 精子分離以控制兔子的子一代雌雄,但沒有取得顯著成功。隨后,研究人員運用了X和Y 精子免疫及流式細胞儀分離等方法,但目前還缺乏可靠的抗原,這些方法還并不成熟。近幾年,X 精子受體TLR7/8(Toll-Like Receptor 7/8)和性連鎖基因如SLXL1(Slx-Like 1)、SLY(Sycp3-Like Y-Linked)的研究促進了X、Y 精子分離技術的發展。
3.1 X 和Y 精子流式細胞儀分離法 流式細胞儀分離法原理是根據X 和Y 精子DNA 含量差異達到分離[37]。Johnson 等[38]用流式細胞儀成功分離兔的X 和Y 精子,并用分離的精子授精產下特定性別的后代,其中,X 精子授精得到94%的后代是雌性;Y 精子授精81%的后代為雄性。流式細胞儀分離法是目前效果最好的方法,具有分離純度高和準確的特點,但流式細胞儀分離速度較慢,對精子DNA 含量差別要求高,且操作過程復雜,分離的數量有限,價格昂貴,只在一些高價值動物生產中應用[39-40]。近年來,運用腹腔鏡子宮角輸精技術將精液直接輸送到母羊子宮角內減少了精子在子宮頸的運行,直接提高了性控精液的利用率,有效降低成本[41-42];也可以將性別分離精子進行體外受精產生胚胎,再移植生產特定性別的正常后代,但操作仍然非常復雜,不易于推廣。
3.2 X 和Y 精子免疫法分離 免疫學方法分離X 和Y 精子是基于X 精子和Y 精子表面存在的不同蛋白質抗原而開發出針對X 或Y 特異性的抗體,再運用磁珠和流式等技術將它們分離的方法。現已發現的一些X 精子和Y 精子特異性抗原,以及表達差異較大的抗原等(如表1 所示)[8,35,43-44]。X、Y 精子特異性抗原和精子膜上差異表達蛋白有望成為精子性別鑒定和X、Y 精子分離的關鍵的免疫學分離應用蛋白[45-46]。Bryant 等[3]運用H-Y 抗血清免疫親和柱層析法對人和小鼠的精液進行分離,小鼠分離的H-Y陽性對照精液授精后得到90%的雄性后代。Sills 等[47]研究發現,H-Y 抗原在含X 染色體的精子中也有大量表達;Hendriksen 等[48]用分選的豬精子和牛精子檢測7 種抗H-Y 單克隆抗體,這些抗體只能與一部分精子結合(20%~50%),且在X 和Y 精子富集部分的結合方面沒有發現差異;Mohammadi等[8]利用雄性增強抗原1(Male Enhanced Antigen 1,MEA1)、雄性增強抗原2(Male Enhanced Antigen 2,MEA2)、SRY 和睪丸決定因子(Testis Determining Factor,TDF)4 種特異性H-Y 精子膜外蛋白制備多克隆抗體,隨后將抗體加到豬精液中,使豬Y 精子出現頭對頭或尾對尾的凝集現象,限制了Y 精子的存活率和活力,最終有效地得到功能性的X精子,顯示了在豬繁育性控中的重要應用潛力。與單克隆抗體相比,使用多克隆抗血清具有顯著的成本優勢[8]。
3.3 調控X、Y 精子活力進行分離技術 近年來,研究人員通過調控X、Y 精子活力達到分離X、Y 精子的目的。Umehara 等[7]研究發現小鼠X 染色體基因編碼的TLR7/8 受體與X 精子的活力有關;將TLR7/8 的配體(R848 和R834)加入精子緩沖液后,上層溶液大部分為活躍的Y 精子,活躍度低的X 精子在下層溶液(圖2)[7]。TLR7 表達于X 精子尾部,被R848 激活后使糖原合成酶激酶(GSK3α/β)和核因子KB(NFKB)磷酸化從而切斷己糖激酶途徑,導致糖酵解受抑制減少ATP 的產生。TLR8 表達于X 精子中部,受R837 或R848 激活抑制線粒體活性。有研究表明,線粒體中ATP 的產生調節精子的前進運動,并且該系統獨立于糖酵解[49],因此TLR8 通過抑制線粒體活性從而抑制精子運動。隨后,研究人員通過收集上層和下層溶液的精子在小鼠中展開了人工授精實驗,溶液上層精子后代中雄鼠占90%;下層精子的后代雌鼠占81%[7]。由此證明,運用激活TLR7/8 抑制X 精子達到分離XY 精子效果的方法是簡便高效的,可快速篩選出X 精子和Y 精子,比現有分離技術安全度更高,不損傷精子活性及繁殖能力,適合需大劑量精子受精的家畜(如豬等)繁殖。此外,TLR7/8 還能被丙型肝炎、艾滋病毒和寨卡病毒等RNA病毒釋放的單鏈RNA 激活[50],這些病毒通過感染雌性生殖道可能使進入生殖道的X 精子的活性受抑制,從而影響性別比例。
3.4 基因缺失調控后代性別比例 相關的性連鎖基因缺失會影響動物的性別比例[11-12]。SLY缺失的雄性與雌性交配產生的后代中雄性遠遠少于雌性。研究發現,Y 染色體部分缺失小鼠的SLY基因減少使其產生的Y 精子形態扭曲程度比X 精子更嚴重,這導致Y 精子運動能力受損從而不能到達受精部位參與受精,而X 精子幾乎不受影響仍能正常與卵子結合。值得注意的是,雖然Y 精子運動能力受到影響,但依然能穿透卵丘、透明帶或卵膜結合、精子卵細胞融合或隨后的胚胎發育[12]。還有研究表明,將X 連鎖的SLXL1基因完全去除掉,從而調節減數分裂后生殖細胞(圓形精子細胞到細長精子細胞)發育成熟為更多的Y 精子,進而產生更多的雄性后代[11]。

表1 X 精子和Y 精子表面存在的不同蛋白質抗原

圖2 配體加入前后X、Y 精子之間的變化及發生機制
4 問題與展望
高效和準確控制畜禽性別技術一直是現代化畜牧業生產渴望突破的技術,盡管性別控制技術在研究領域已取得了不少突破性進展,但是在實際生產中還存在許多困難和挑戰。基于DNA 含量差異的流式細胞法的應用能精準地分離X、Y 精子,在牛羊生產領域的應用取得良好經濟價值,但其他物種應用較少,主要因為精子分離過程常常伴隨著精子的損傷,分離成本昂貴和分離效率低等問題,制約著性別控制技術的產業化。隨著研究的不斷深入,一些新的技術應用到性別控制中,新發現的TLR7/8 受體調控方法促使X、Y 精子運動能力呈現差異而進行分離,和H-Y 抗體制備等靶向凝集Y 精子等在實驗中都顯示出較好的性別控制效果,這些研究和推廣將會運用到遺傳改良、優質品系的獲得、伴性遺傳病的規避等領域,促進畜牧業發展。

