氟喹諾酮類藥物殘留限量及檢測技術研究進展
張運尚,杜加茹,王偉東,樊劍鳴
(鄭州大學公共衛生學院,河南鄭州 450001)
氟喹諾酮類藥物(Fluoroquinolones,FQS)是第3 代喹諾酮藥物,其化學結構是在喹啉環的6 位上加入了氟原子,7 位上連有哌嗪基的一類衍生物,此特點使得原本親脂性的吡酮類藥物增加了適度的親水性,同時降低了蛋白結合率,提高生物利用度[1-2]。該類藥物通過抑制細菌的DNA 和RNA 合成從而達到抑菌作用[3]。相比第1 代及第2 代喹諾酮藥物,FQS 的抗菌活性明顯增加,抗菌譜顯著擴大,對革蘭氏陽性菌(金葡球菌、鏈球菌、肺炎球菌)和革蘭氏陰性菌(腸桿菌科、流感桿菌和奈瑟菌屬)[4]以及一些衣原體、支原體和螺旋體均有抗菌作用[5],因此被廣泛應用在臨床上治療細菌感染性疾病。FQS 代表藥物主要包括恩諾沙星(Enrofloxacin,ENR)、環丙沙星(Ciprofloxacin,CIP)、諾氟沙星(Norfloxacin,NOR)、達氟沙星(Danofloxacin,DAN)、氟羅沙星(Flero xacin,FLE)、沙拉沙星(Saraflaxacin,SFX)、依諾沙星(Enoxacin,EX)等。由于養殖業對食品中獸藥殘留的意識不足,存在大量不規范使用獸藥、抗生素及違禁藥品和不嚴格執行休藥期規定等諸多問題,使得動物性產品中獸藥殘留超標[6]。隨著我國居民生活水平提高,對動物性食品的需求也不斷增加。當人們過多食用了含有藥物殘留的動物性食品后,通常不表現為急性毒性,而是藥物在人體蓄積[7-8],對人體多個系統(如中樞神經系統、循環系統、消化系統、泌尿系統、呼吸系統等)造成損害[9-13]。更為嚴重的是,FQS 的不合理使用容易誘導人類致病菌對其耐藥性的增強,不利于該類藥物對人類疾病的治療[14-17]。本文綜述了FQS 在動物源性食品中殘留的檢測標準和3 種檢測FQS 的常用方法,以期為在不同檢測條件下選擇最適的檢測方法提供理論依據。
1 FQS 殘留限量
FQS 殘留存在諸多不良反應,逐漸引起世界各國的廣泛關注。為了監控獸藥在動物性食品中的殘留,聯合國糧農組織和世界衛生組織食品添加劑聯席專家委員會(JECFA)早在1987 年第32 次會議中報告了相關獸藥的殘留毒性;從1997 年8 月20 日起,美國禁止將FQS 作為非限制性藥物使用;美國聯邦法規(21CFRS530,41)規定的禁用獸藥品種(不能使用于供食用的動物)也包括FQS 類藥物[18];歐盟(EC)于2009 年12 月22 日發布了37/20210 號法,其中關于動物性食品及其產品中獸藥殘留(B 類)制定最高殘留限量(MRLs)包括喹諾酮類藥物[19]。日本于2003 年7 月1 日起對進口生鰻魚及其制品進行氧氟沙星、諾氟沙星、環丙沙星、恩諾沙星殘留檢測,并規定最大殘留限量為50 μg/kg[20];我國頒布的首批綠色畜產品論證準則《綠色食品—獸藥使用準則》也取消了FQS 在肉用動物上的使用。我國農業部獸藥殘留專家委員會在參考JECFA 及美國(CFR)和EC 有關標準的基礎上,制定了恩諾沙星(Enrofloxacin)、二氟沙星(Difloxacin)、達氟沙星(Danofloxacin)在動物性食品中最大殘留限量的國家標準[21],具體見表1。
2 FQS 殘留檢測方法
目前,針對FQS 的檢測方法主要有高效液相色譜法(HPLC)、液相色譜-質譜聯用法(HPLC-MS/MS)、酶聯免疫分析法(ELISA)等。不同分析方法對FQS 的檢測結果優缺點見表2。
2.1 HPLC 色譜法原理是利用樣品中各個組分的物理化學性質差異(如分子大小及形狀、親和力、分配系數和吸附力等),使各組分在固定相和流動相中的分布程度不同,從而以不同的速度移動而達到分離樣品的目的。高效液相色譜法又稱“高分離度液相色譜”,是色譜法的一個重要分支。HPLC 利用高壓輸液系統將不同極性的液體流動相泵入裝有固定相的色譜柱,流動相的各個組成成分在色譜柱內被分離開后,進入檢測器得到不同的峰信號,最后通過分析對比這些信號判斷待測樣品所含物質。根據檢測器的種類可以將HPLC 分為不同的方法,如高效液相色譜-紫外吸收檢測法(HPLC-UV/DAD)、高效液相色譜-熒光檢測法(HPLC-FLD)、高效液相色譜-固相萃取(HPLC-SPE)。HPLC 法具有應用范圍廣、分離能力強、測定靈敏度高、樣品易回收等特點。
方永衛等[22]利用HPLC 法建立動物性產品中3 種FQS(麻保沙星、環丙沙星、恩諾沙星)含量的方法,設置波長為278~299 nm,采用流動相為A 液為0.05 mol/L磷酸0.5%三乙胺溶液,B 液為乙腈,進行梯度洗脫,得到最佳色譜分離圖,表明3 種目標藥物的標準曲線的相關系數均大于0.99,3 種藥物的檢測限為0.5 μg/mL。樣品的添加回收率均在82.0%~105.6%,證明該方法用于動物性食品提取方法的可靠性較好,可以用于檢測動物性食品中的FQS 殘留。
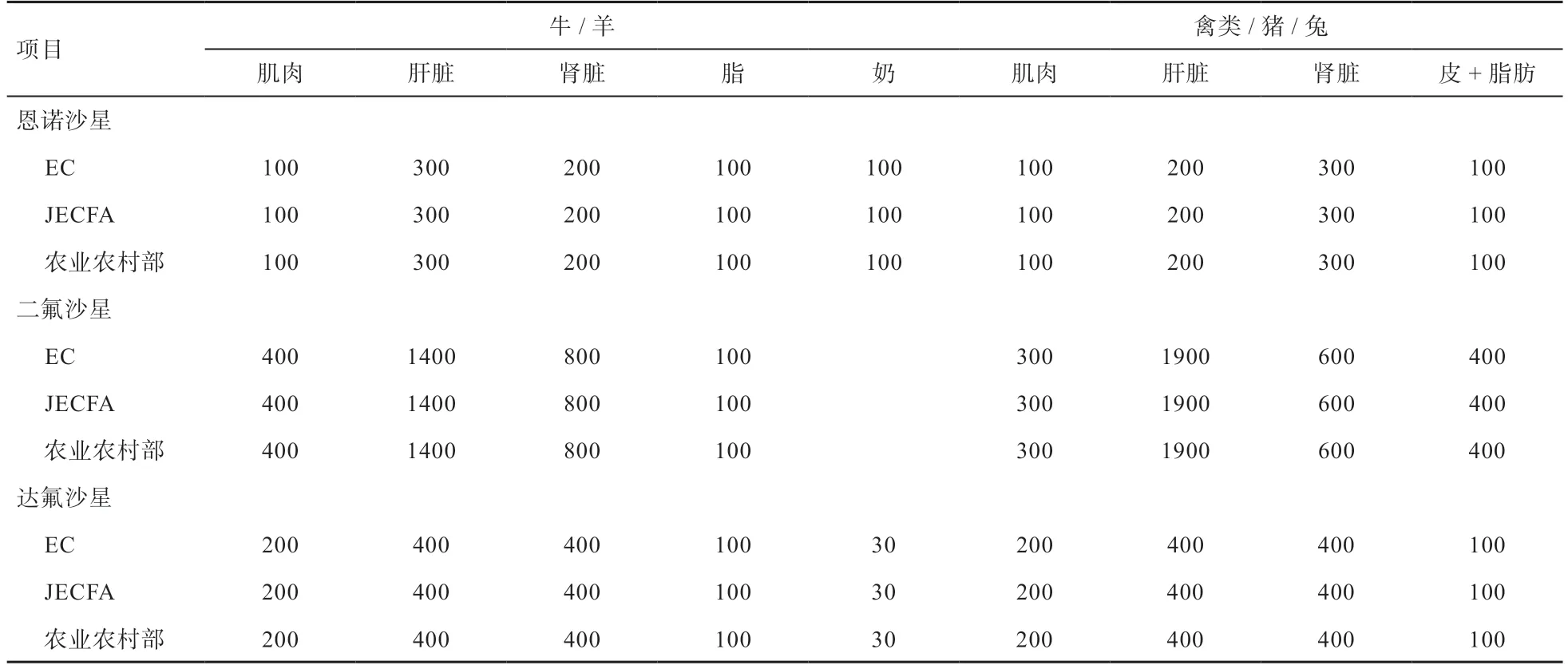
表1 獸用氟喹諾酮藥物在動物源性食品中最大殘留限量 μg/kg
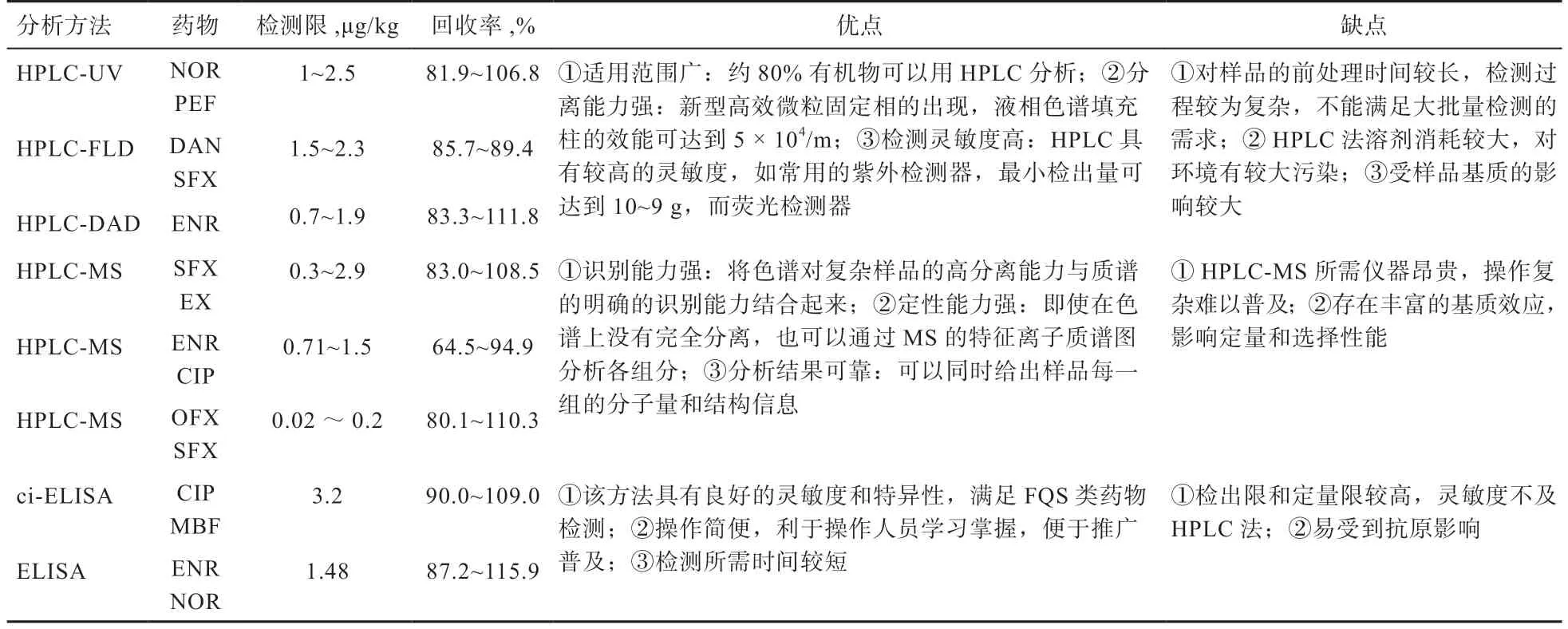
表2 幾種分析方法對不同FQS 藥物的檢測結果優缺點比較
Vakh 等[23]使用Zr-Fe-C 磁性納米粒子作為吸附劑進行自動磁分散微固相萃取,測定肉類嬰兒食品中的氟喹諾酮類抗菌藥物(氟羅沙星、諾氟沙星和氧氟沙星)含量。該方法將樣品溶液注入流化反應器中,然后基于流化床策略使用磁性納米顆粒從樣品基質中在線分離分析物,并使用高效液相色譜系統洗脫和測定分析物。在實驗最佳條件下,3 種藥物的濃度為5~1 000 μg/L,相關系數均大于0.99。計算得出的檢出限為氟羅沙星3.0 μg/L,諾氟沙星和氧氟沙星1.5 μg/L。所有分析物的回收率均在86%~122%。該方法檢出限低于國家標準,可以用于測定肉類嬰兒食品中的FQS 含量。
2.2 超高效液相色譜-串聯質譜法(HPLC-MS/MS)質譜法原理是將樣品的分子進行電離,不同質量的電子在電場或磁場中,按照質荷比的大小和相對強度進行分離和排序,形成有規則的質譜,從而對物質進行結構鑒定和定量分析。HPLC-MS/MS 法是常見的一種色譜-質譜連用技術,首先將樣品中的分析物經過液相色譜柱分離后輸送至質譜,根據特定的質荷比(m/z)離子進行選擇,所選擇的母離子可以產生具有特定結構信息的離子產物,進而可以對目標化合物進行選擇性的定量分析。相比于HPLC,HPLC-MS 分離能力更強,分析結果具有更高的可靠性。
曹騫等[24]利用HPLC-MS/MS 建立了雞蛋中8 種喹諾酮類藥物殘留檢測方法,該方法對雞蛋中各類化合物的檢出限為0.3 μg/kg,定量限為1.0 μg/kg,線性范圍為1~100 μg/L,相關系數均大于0.996 7。在空白雞蛋樣品中添加20 ng/mL 的8 種喹諾酮類藥物進行回收試驗,平均回收率范圍為83.0%~108.5%。該方法靈敏度較高,可以用于檢測雞蛋中FQS 殘留。
不同樣品基質中FQS 液相檢測方法見表3。可以看出HPLC 具有分離度高、靈敏度好及準確度高等特點,是目前檢測FQS 殘留使用較多的方法,但其對樣品的前處理時間較長,檢測過程較為復雜,不能滿足大批量檢測的需求,同時還存在溶劑消耗較大、對環境有較大污染等弊端。而相比于HPLC,HPLC-MS/MS 不僅具有色譜法的分離能力,還具有質譜法的靈敏度、選擇性和識別能力,對于某些分子量大、極性強、穩定性差的樣品有較好的分離檢測和定性分析能力。利用HPLC-MS/MS 針對FQS 殘留的檢出限和定量限均高于HPLC,MS 提供了檢測組織提取物中FQS 所需的特異性,該方法適合用于FQS 殘留的確證。但是,該方法需要的儀器設備昂貴,對樣品的前處理較復雜,對操作人員的要求也較高,導致該方法難以在基層工作中普及。
2.3 ELISA 酶聯免疫吸附技術的基本原理是將抗原或抗體固定在特殊材料上,與其酶標的抗體或抗原發生特異性的反應,在高效的酶促反應下,達到擴大免疫反應的作用。利用FQS 中的羧基與載體蛋白質游離氨基的縮合反應,將FQS 與載體連接合成人工抗原,該方法簡單,快速,且不需要昂貴的儀器設備,適用于大量樣品的快速檢測[32]。同時該方法具有特異性強、靈敏度高、操作簡便等優點,可用于現場樣品的檢測,因此近年來國內外應用ELISA 法測定抗生素殘留的研究越來越多。我國也在2008 年發布了《動物性食品中氟喹諾酮類藥物殘留檢測-酶聯免疫吸附法》(農業部1025號公告-8-2008)標準,該標準規定了在動物性食品中FQS 殘留量檢測的制樣和酶聯免疫吸附法,適用于動物源性食品中豬和雞的肌肉、蜂蜜、雞蛋和蝦中恩諾沙星、環丙沙星、氧氟沙星、諾氟沙星等FQS 殘留量的檢測。
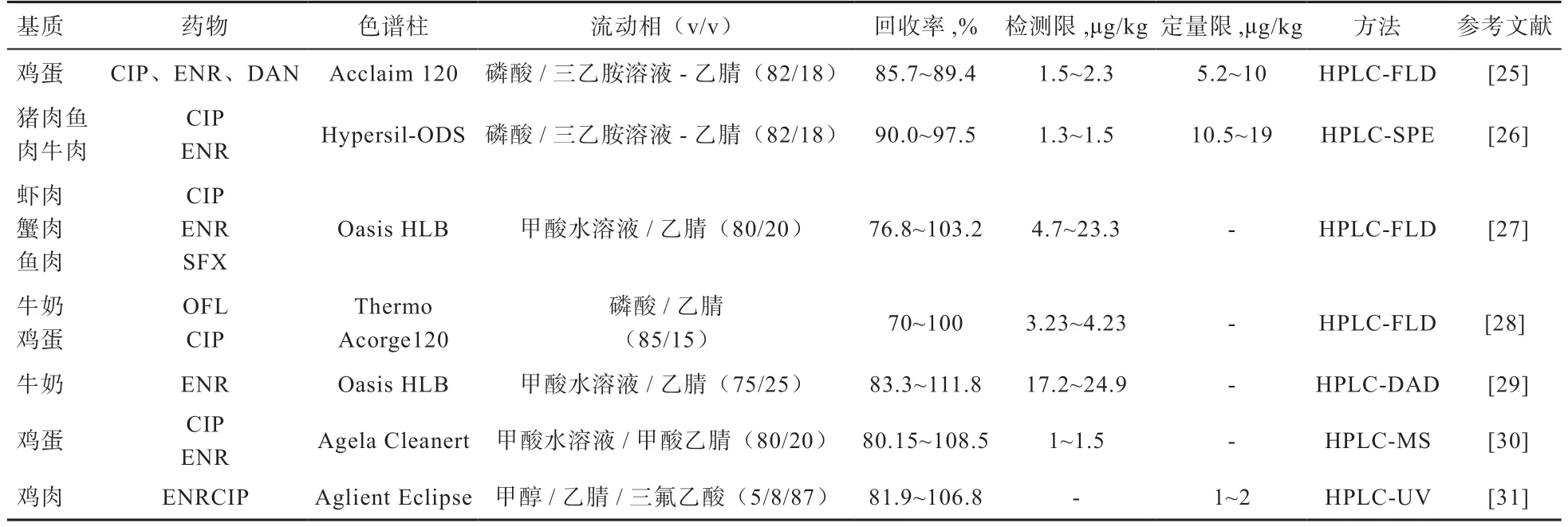
表3 不同樣品基質中FQS 類藥物液相檢測方法的比較
李建鯤等[33]利用酶聯免疫吸附法快速測定肉制品中FQS 殘留,計算50%抑制濃度(IC50 值)可知FQS酶聯免疫試劑盒的相關系數R 為0.997 6,百分吸光率標準曲線中4 次零濃度的標準液的IC50 介于0.306~0.351 ng/g,表明FQS 的濃度與百分吸光率呈負相關。在0~ 400 ng/g 時,添加回收率在81.8%~100.3%,相對標準偏差(Relative standard deviation,RSD) 在0.4%~12%,說明ELISA 法檢測牛肉、羊肉、豬肉和雞肉中FQS 準確、可靠,且重復性好、精密度高。
李燕君等[34]利用ELISA 法同時檢測牛奶中環丙沙星、恩諾沙星、諾氟沙星等6 種FQS 殘留,該方法的IC50 范圍在0.254~0.361 μg/L,最低檢測限為1.48 μg/L,在牛奶中添加5 μg/L 環丙沙星、恩諾沙星、諾氟沙星等6 種FQS 類藥物時,回收率為87.20%~115.92%;同一批內的變異系數均小于15.0%,不同批間的變異系數均小于16.0%。該方法的精密度(變異系數)、回收率和最低檢測限等均符合獸藥殘留試驗技術規范的要求,且回收率和最低檢測限與高效液相色譜法相接近,具有較高的靈敏度和準確度,并且操作相對簡單,容易在基層工作中推廣普及,適合進行大批量樣本的快速檢測。
孫曉崢等[35]用間接競爭ELISA(ci-ELISA)試驗成功地檢測了肉雞組織中環丙沙星(CIP)的殘留,將敏感性強的單抗與膠體金顆粒標記作為金標墊,以CIP-BSA 偶聯蛋白為檢測線,以兔抗鼠IgG 作為質控線,組裝了檢測FQS 藥物的膠體金免疫層析試紙條,檢測肉雞中CIP 的殘留,結果表明該方法對10 種FQS 檢測均為陽性,而檢測的4 種常見藥物均為陰性。對環丙沙星、培氟沙星、達氟沙星的檢測限為3.2 ng/mL,對沙拉沙星、二氟沙星、麻保沙星的檢測限為6.4 ng/mL。該方法操作簡單,檢測所需時間短、靈敏度較高、特異性較強,為大量樣品的篩選和快速檢測提供了一種可靠的方法。
Yuan等[36]利用一種基于等離子體銀納米棱鏡(AgNPR)氧化蝕刻的酶聯免疫吸附法(pELISA),用于達氟沙星的定性和定量檢測。該方法以AgNPR 作為信號轉換器,通過引入生物素標記的單克隆抗體、鏈霉親和素和生物素化葡萄糖氧化酶構建間接競爭的pELISA,催化H2O2的生成來刻蝕AgNPR。該方法對牛奶中達氟沙星的定量檢出限為0.24 ng/mL,定性檢測限為0.32 ng/mL,平均回收率為103%~121%,變異系數為0.6%~3.41%。用液相色譜-串聯質譜法進一步證實了上述回收結果。根據結果可知,AgNPR 蝕刻pELISA法對牛奶中達氟沙星的定量和定性檢測具有較高靈敏度、準確性和可靠性,可以用作牛奶中氟喹諾酮類藥物的殘留檢測。
不同分析方法對FQS 的檢測結果優缺點見表3。盡管相比于HPLC 和HPLC-MS,ELISA 的檢出限和定量限較高,但仍遠低于國家限量標準。該方法具有操作簡單,所需時間短、成本低等諸多優勢,適用于作為食品中FQS 類藥物殘留的初步檢測。近年來,ELISA 為FQS 殘留檢測提供了諸多便利。隨著科學發展,基于免疫法的檢測方法不斷創新,靈敏度不斷提高,今后的研究重點可側重于提高該方法的穩定性和特異性。
3 展 望
隨著分析技術和新型材料的快速發展,HPLC、HPLC-MS/MS、ELISA 等方法被廣泛應用于FQS 殘留的檢測。目前常用的HPLC 法雖然準確度高、重現性好,但所需儀器昂貴、操作復雜、對樣品的前處理繁瑣等。隨著免疫技術的不斷發展,使用ELISA 法檢測FQS 殘留的研究越來越多,該方法靈敏度較高、特異性強,相比于HPLC 法具有簡便、快捷等優勢,適用于對樣品的初步殘留檢測。因此,可以預測ELISA 法將會在快速篩選大批量樣品的FQS 殘留中發揮重要作用。

