低劑量α粒子輻照對斑馬魚胚胎初級造血分子標記物的影響
王慧敏,趙維超,3,胡 南,張燕斌,丁德馨,*
(1.南華大學 鈾礦冶生物技術國防重點學科實驗室,湖南 衡陽 421001; 2.南華大學 極貧鈾資源綠色開發技術湖南省重點實驗室,湖南 衡陽 421001; 3.南華大學 公共衛生學院,湖南 衡陽 421001)
鈾礦開采及水冶不可避免地會產生廢水、廢氣、廢渣,其所釋放的氡及其子體產生的放射性污染對環境和人類健康存在潛在威脅,因此相關研究備受關注。氡及其子體衰變產生的α粒子電離能力強、射程短,能與物質產生較強的相互作用。一方面,α粒子能破壞人體的呼吸系統,誘發呼吸道疾病;另一方面,α粒子被吸入體內后,通過血液循環,從胎盤進入胚胎體內,對嬰兒造血產生不利影響[1]。目前氡衰變產生的α粒子輻照已成為誘發肺癌的第二大因素;而關于低劑量α粒子輻照對孕期嬰兒造血的影響,目前尚未見報道。
斑馬魚的造血過程與哺乳動物相似,包括初級造血和次級造血兩個階段[2]。斑馬魚初級造血發生于10~25 hpf,主要發生在2個區域。其中1個區域位于后部中胚層的中間細胞團(ICM),是形成紅細胞前體細胞的關鍵位置;另1個區域位于胚胎前部血島區(RBI),相當于哺乳動物的卵黃囊,是形成某些髓系細胞前體細胞的關鍵位置。在初級造血期間參與調控的重要轉錄因子主要有gata1a、gata2、spi1b、scl、lmo2等[2-3],其中gata1a為早期紅細胞生成的重要轉錄因子[4],spi1b為早期髓系細胞生成的重要轉錄因子[5],此過程在進化上與人類高度一致[6-9]。已有研究表明,1.4 mGy的α粒子輻照能誘導斑馬魚胚胎產生興奮效應,表現為24 hpf細胞凋亡的數目明顯減少,而當輻照劑量增至2.8、5.6、11.7 mGy時,細胞凋亡數呈線性增加,表明1.4 mGy的α粒子輻照對機體發育具有促進作用[10-11]。
由于脫絨毛膜后的斑馬魚胚胎對外界刺激的敏感度高,且與孕期的嬰兒相似,因此本文擬采用241Am作為α粒子輻照源,對其進行低劑量α粒子輻照,以分析其初級造血分子標記物(gata1a和spi1b)的表達水平及初級造血血紅蛋白的含量,了解低劑量α粒子輻照對孕期嬰兒初級造血系統的影響。
1 材料與方法
1.1 斑馬魚胚胎收集和脫膜處理
野生型AB品系成年斑馬魚,中國科學院水生生物研究所。將斑馬魚雌雄分開并飼養于斑馬魚專用循環系統中,保持恒溫(28±1) ℃。嚴格控制斑馬魚的光周期為14 h光照及10 h黑暗,使其具有穩定的產卵環境。在產卵前一天,選取雌雄比約為1∶2的斑馬魚置于產卵盒中,并用隔板分隔雌雄,產卵盒底部放置帶縫隙的擋板,便于收集胚胎。次日清晨8點,移除隔板,并利用光照刺激斑馬魚雌雄交尾,30 min后收集胚胎。收集到的胚胎用E3培養液(含5 mmol/L NaCl、0.33 mmol/L CaCl2、0.33 mmol/L MgSO4·7H2O和0.085 mmol/L KCl)清洗數次,將魚鱗、糞便、豐年蝦殼及其他雜物完全洗凈,用于后續實驗。
由于斑馬魚胚胎的絨毛膜能吸收大部分α粒子輻照,因此需在輻照實驗開始前脫除斑馬魚絨毛膜。取150枚左右胚胎置于培養皿中,將水吸凈,加入濃度為0.25%的胰蛋白酶-EDTA消化液使其沒過胚胎,靜置消化10 min左右,在光學顯微鏡下觀察到小部分胚胎的絨毛膜脫落時停止消化,用E3培養液清洗5次以上后置于恒溫培養箱中培養。
1.2 胚胎的α粒子輻照
將5 hpf脫絨毛膜后的胚胎放入底部帶有2 mm孔的培養皿中,使用快固膠將1張12 μm厚的聚酯邁拉膜固定在培養皿底部。移動胚胎,使胚胎的細胞朝向孔。使用241Am(天津市博安科工貿有限公司)進行輻照,根據文獻[12]的方法,使用輻照5 min后的最大輻照劑量,計算得輻照劑量率約為1.7 mGy/min。控制輻照時間分別為15、30、60 s,斑馬魚胚胎接受的輻照劑量分別為0.425、0.85、1.7 mGy,α粒子的輻射權重因子為20,因此脫絨毛膜后的斑馬魚胚胎受到的有效劑量應為當量劑量與輻射權重因子的乘積,具體參數列于表1。受輻照條件限制,一次輻照2枚胚胎,所有劑量組胚胎在1.5 h內輻照完畢。輻照后置于恒溫培養箱中,期間每隔6 h更換E3培養液,繼續孵化至14 hpf和22 hpf,待后續處理。

表1 輻照參數Table 1 Irradiation parameter
1.3 斑馬魚胚胎初級造血分子標記物gata1a和spi1b表達的檢測
采用整體原位雜交技術檢測斑馬魚胚胎初級造血前期分子標記物gata1a和spi1b的表達。斑馬魚的初級造血發生在10~25 hpf,實驗選擇發育至約14 hpf的胚胎進行檢測。采用整體原位雜交技術,可直觀地看到斑馬魚胚胎初級造血前期分子標記物gata1a和spi1b在斑馬魚胚胎上表達的具體位置和大致含量。使用4%多聚甲醛固定胚胎不超過2 h,隨后用無水乙醇進行梯度脫水,于-4 ℃下冷藏過夜,并保存于-20 ℃。標記物gata1a和spi1b的表達采用文獻[13]方法進行檢測。
斑馬魚胚胎初級造血發生在10~25 hpf,發育至22 hpf時,初級造血已基本完成,采用實時熒光定量聚合酶鏈式反應技術可定量檢測斑馬魚胚胎初級造血后期分子標記物gata1a和spi1b的相對表達,驗證前期整體原位雜交技術檢測的結果。22 hpf時,各劑量組選取約50枚脫絨毛膜后的胚胎,采用 trizol 法提取各劑量組的總RNA,超微量核酸蛋白測定儀(scandrop100)檢測RNA在260 nm和280 nm處的吸光度,由此確定RNA溶液的濃度。采用Aidlab公司反轉錄試劑盒(TUREscript 1st Stand cDNA Synthesis Kit)進行反轉錄操作,采用20 μL反應體系(總RNA 500 ng,5×RT Reaction Mix 4 μL,Rondam primer/oligodT 1 μL,TUREscript H-RTase/RI Mix 1 μL,RNase Free dH2O 至 20 μL)合成cDNA第一鏈,于-80 ℃保存。qRT-PCR程序反應結束后分析熒光度變化曲線和溶解曲線以確定擴增目的基因片段的特異性。以GAPDH 基因作為內參,采用2-ΔΔCt(Ct為每個反應管內的熒光信號到達設定域值時所經歷的循環數)法計算各基因相對表達量,相關基因引物序列列于表2。

表2 相關基因引物序列Table 2 Sequences of primers of related genes
采用聯大茴香胺染色法檢驗初級造血階段紅細胞中血紅蛋白的表達情況,以進一步確定α粒子輻照對初級造血中原始紅細胞發育的影響,具體方法如下:各劑量組選取約10枚脫絨毛膜后的胚胎,正常培養至48 h,分別加入聯大茴香胺混合染色液(含0.7 mg/mL聯大茴香胺溶液、0.5 mL 0.01 mol/L醋酸鈉溶液、0.1 mL 30%過氧化氫、0.2 mL去離子水),常溫下避光顯色15 min。清洗3~5次后,置于顯微鏡下觀察并拍照。
1.4 數據分析
使用Graphpad Prism 8進行數據分析。用單因素方差分析法分析組間差異,p>0.05時無統計學意義;p<0.05時差異有統計學意義;p<0.01時差異顯著;p<0.001時差異極顯著。
2 結果與討論
2.1 α粒子輻照對斑馬魚初級造血分子標記物表達的影響
1)gata1a和spi1b的相對表達
qRT-PCR檢測的各組gata1a和spi1b基因的相對表達示于圖1。由圖1可見,與對照組相比,22 hpf時0.425 mGy劑量組胚胎中gata1a表達量無顯著性差異(p>0.05),0.85 mGy劑量組gata1a表達量明顯降低(p<0.01),而1.7 mGy劑量組gata1a表達量明顯升高(p<0.001)。0.425 mGy劑量組spi1b表達量降低(p<0.05),0.85 mGy劑量組表達量顯著降低(p<0.01),而1.7 mGy劑量組spi1b表達量極顯著升高(p<0.001)。
2)gata1a和spi1b在斑馬魚胚胎上的表達位置
從圖1可知,劑量為0.425 mGy和0.85 mGy的α粒子輻照能抑制胚胎的初級造血,且具有劑量依賴性,而1.7 mGy能促進胚胎初級造血。為進一步明確α粒子輻照對胚胎初級造血系統的影響,了解分子標記基因的表達范圍,采用整體原位雜交技術檢測了胚胎發育至約14 hpf時α粒子輻照對其造血分子標記物gata1a和spi1b表達的影響,結果示于圖2,所有胚胎均為側面觀,頭部向左尾部向右。由于每個劑量組非同一批取樣,因此同一基因各劑量組表達模式略有不同。由圖2可見,對照組胚胎gata1a與1.7 mGy劑量組胚胎的表達模式類似,主要在后部側板中胚層(ICM區)表達(圖2a、d),0.425 mGy和0.85 mGy劑量組表達模式類似,目標基因出現了非特異性的異位表達,其表達范圍異位擴展至前部側板中胚層(圖2b、c)。與對照組相比,0.425 mGy和0.85 mGy劑量組紫色雜交信號減弱,表明胚胎gata1a表達明顯降低,而1.7 mGy劑量組紫色雜交信號增強,表明gata1a表達顯著升高。對照組胚胎的spi1b表達與1.7 mGy劑量組模式最為接近,在整個胚胎部分均有表達(圖2e、h),0.425 mGy和0.85 mGy劑量組表達模式類似,主要在胚胎的前部側板中胚層頭端表達(圖2f、g)。0.425 mGy劑量組胚胎spi1b表達無明顯變化,0.85 mGy劑量組表達明顯降低,同樣值得注意的是,1.7 mGy劑量組紫色雜交信號增強,spi1b的表達顯著升高(圖2h)。

*——p<0.05;**——p<0.01;***——p<0.001圖1 22 hpf斑馬魚胚胎接受α粒子輻照后gata1a和spi1b的相對表達量Fig.1 Expression levels of gata1a and spi1b of zebrafish embryo at 22 hpf after α particle irradiation
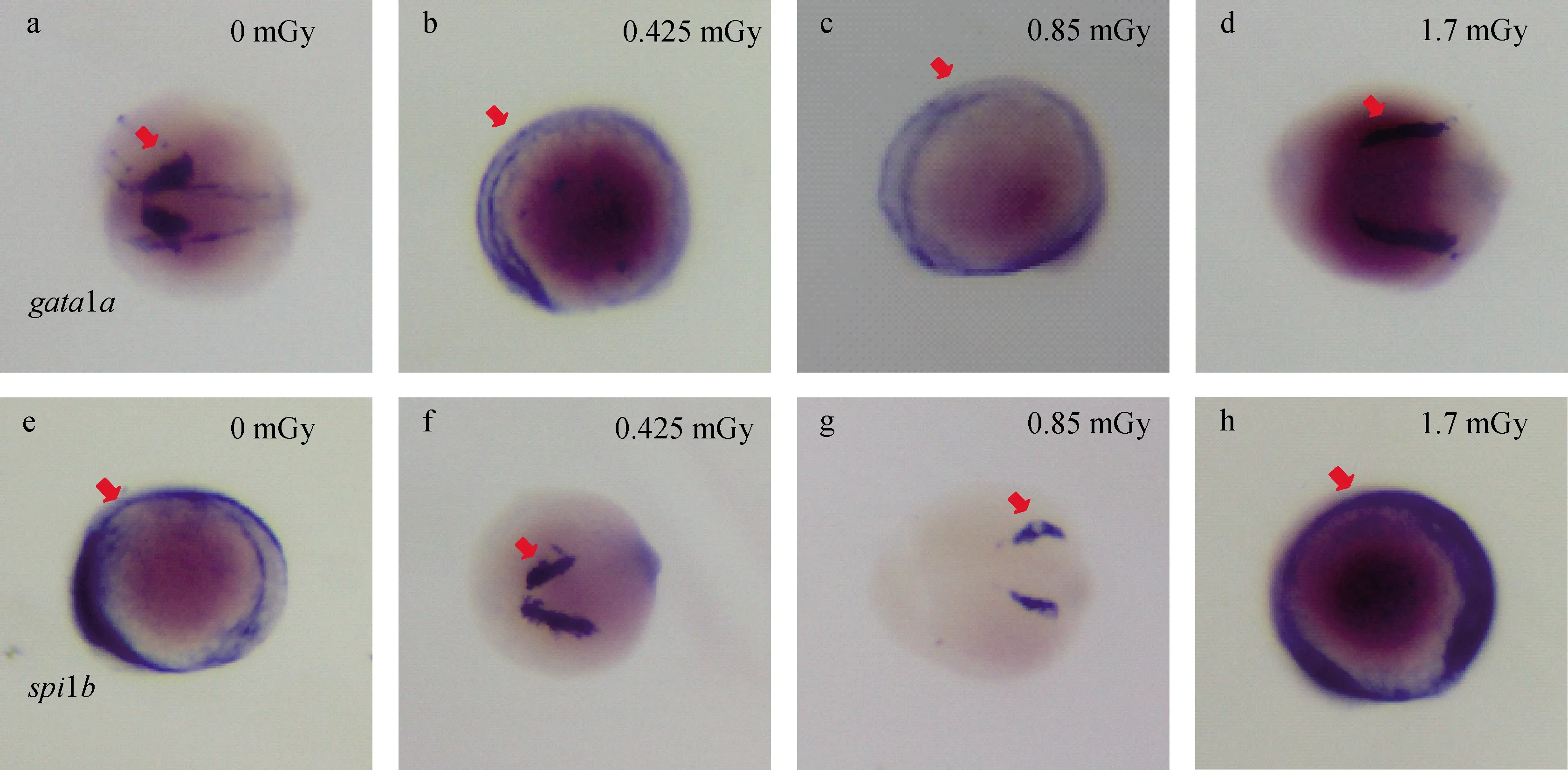
圖2 約14 hpf斑馬魚胚胎α粒子輻照后的gata1a(a、b、c、d)和spi1b(e、f、g、h)表達Fig.2 Expression of gata1a (a, b, c, d) and spi1b (e, f, g, h) in about 14 hpf zebrafish embryos after α particle irradiation
3) 血紅蛋白的變化
α粒子輻照后48 hpf斑馬魚胚胎中血紅蛋白的含量示于圖3,紅色箭頭所指為血紅蛋白,顏色越深,紅色范圍越大說明血紅蛋白含量越多。與對照組相比,0.425 mGy劑量組血紅蛋白含量并無顯著性差異,0.85 mGy劑量組血紅蛋白含量減少,而1.7 mGy劑量組血紅蛋白含量高于對照組。同時,與對照組相比,根據統計染色的胚胎數量和染色信號的增強或減弱,得到量化血紅蛋白含量的差異百分比柱狀圖(圖4)。胚胎發育至48 hpf時,0.425、0.85和1.7 mGy劑量組染色信號減弱的百分比分別約為29%、84%和15%;其染色信號增強百分比約為16%、5%和70%。

圖3 α粒子輻照后胚胎的血紅蛋白含量變化Fig.3 Hemoglobin content of each group after α particle irradiation

圖4 血紅蛋白染色信號百分比Fig.4 Hemoglobin staining signal percentage
2.2 討論
本實驗中,在低于0.85 mGy的劑量下,隨著輻照劑量的增加gata1a和spi1b的相對表達量逐漸降低;在高于0.85 mGy的劑量下,隨著輻照劑量的增加gata1a和spi1b的相對表達量增加。這種在一定的低劑量范圍內,隨著輻照劑量的增加α粒子輻照抑制造血的現象被稱作低劑量輻射超敏感性(HRS),超出一定的劑量后,α粒子輻照促進造血的現象被稱為誘導輻射抗性(IRR),在HRS/IRR現象中發揮重要作用的是DNA損傷修復機制。輻照能致使胚胎發生直接或間接的DNA損傷,當DNA損傷積累到一定程度時,即可激活細胞增殖周期內的G2期檢查點,抑制G2期受損細胞進入M期,使得受損細胞在此得到修復并出現周期性停滯,產生明顯的抗輻射能力[14-17]。馬季等[18]研究了X射線(0~1.2 Gy)分別對DNA-PKcs野生型M059K和突變型M059J兩株基因的影響,檢測了X射線輻照后60 min內G2期檢查點相關蛋白的變化情況,結果發現,1 Gy照射后野生型M059K產生了HRS,并發現0.2 Gy的X射線輻照后,20~50 min內野生型M059K的G2期檢查點相關蛋白pChk1和pChk2活化增強,pChk1/Chk1和pChk2/Chk2的比值顯著高于突變型,表明G2期檢查點在誘導HRS現象中具有重要作用。Wu等[19]研究了0.05~2 Gy的X射線輻照對A549細胞的HRS相關作用機制,發現當輻照劑量小于0.3 mGy以及大于0.5 Gy時,A549細胞存活率明顯降低;而當輻照劑量為0.3~0.5 mGy時,A549細胞存活率明顯升高。此外,照射后1 h,Chk2激酶開始被激活,照射后2 h,M期細胞比例顯著下降,說明此時G2期檢查點被激活且Chk2激酶在G2期檢查點激活過程中起關鍵作用。在本實驗中,當輻照劑量小于0.85 mGy時,可能G2期檢查點未被激活,導致DNA受損的細胞無法得到修復,胚胎細胞對α粒子輻照敏感性增強,從而抑制斑馬魚造血,表現為隨著輻照劑量的增加,gata1a和spi1b的相對表達量逐漸降低;而當輻照劑量達到1.7 mGy時,可能G2期檢查點被激活,DNA受損的細胞得到修復,細胞存活率增加,誘導了低劑量興奮效應,促進斑馬魚造血[20],表現為隨著輻照劑量的增加,gata1a和spi1b的相對表達量增加。
HRS/IRR現象在很多研究中得到了驗證。當α粒子輻照劑量低于2.8 mGy時,24 hpf的胚胎細胞凋亡信號顯著減少,而輻照劑量大于5.6 mGy時,24 hpf的胚胎細胞凋亡信號顯著增加[21-22]。賈曉娟等[23]發現單次輻照劑量為1、2、4 Gy時,能促進外周血淋巴細胞的生長,具體表現為染色體形成率和培養形成的大核數明顯高于空白對照組;而當輻照劑量大于4 Gy時,染色體形成率和大核數明顯減少,對外周血淋巴細胞的生長具有抑制作用。Marques等[24]發現低劑量電離輻射上調了斑馬魚幼蟲的內皮細胞中幾種促血管生成分子的基因表達,如flt1、kdr、angpt2a、tgfb2、fgf2和cyr61,同時促進了胚后發育。這些研究與本文研究的結果相似,小于0.85 mGy的低劑量α粒子輻照對脫絨毛膜后的斑馬魚胚胎初級造血產生了抑制作用,而1.7 mGy的低劑量α粒子輻照誘導了脫絨毛膜后的斑馬魚胚胎初級造血興奮效應。
3 結論
小于0.85 mGy的低劑量α粒子輻照對脫絨毛膜后的斑馬魚胚胎初級造血產生了抑制作用(對應于人體8.5 mGy輻照劑量),而1.7 mGy的低劑量α粒子輻照誘導了脫絨毛膜后的斑馬魚胚胎初級造血興奮效應(對應于人體17 mGy輻照劑量),因此,1.7 mGy的低劑量α粒子輻照對脫絨毛膜后的斑馬魚胚胎初級造血具有促進作用。
這一結論表明,孕期的嬰兒在接受低劑量α粒子輻照后,其初級造血產生了低劑量興奮效應,但1.7 mGy的α粒子輻照劑量可能尚未達到誘導低劑量輻照興奮效應的最大值。因此,在后續研究中,還需進一步確定低劑量α粒子輻照興奮效應的閾值。

