大鼠carabin腺病毒干擾載體構建及功能鑒定
程闊菊,吳 慶,羅健華,魏譚軍,周殿儒,肖 成,黃 河,羅 云,王 毅
carabin是2007年在人T細胞中發現的一個新的鈣調磷酸酶(calcineurin,CaN)結合蛋白,主要表達于脾臟及血液中[1],同時可與Ras結合,基于其與CaN和Ras均能相互作用的特性,將其命名為carabin[1]。前期研究[1-4]表明,carabin作為CaN的內源性負反饋抑制蛋白,通過CaN和Ras信號通路負反饋抑制T細胞及B細胞的持續活化,在機體免疫中發揮著重要作用。最近研究[5-6]表明,carabin在心肌細胞中亦有表達,可通過負性調節CaN和Ras信號通路抑制心肌細胞的肥大,并有可能成為診治心衰引起心肌肥厚的靶點。我們的前期研究[7]發現,carabin在小鼠梗死心臟及經缺血/缺氧處理的人心室肌細胞株AC16中表達均顯著下調,提示carabin在心肌梗死及缺血中可能起到一定的作用,但目前尚無相關研究報道。本研究擬采用腺病毒載體系統,設計針對大鼠carabin基因的干擾序列,構建carabin腺病毒干擾載體(Ad-carabin-shRNA),感染H9C2心肌細胞篩選針對大鼠carabin基因干擾效果最佳的Ad-carabin-shRNA,為進一步觀察carabin信號通路在心肌梗死及缺血中的作用奠定基礎。
1 材料與方法
1.1 材料
1.1.1 細胞及載體質粒 細胞株293A、293T及H9C2購自中國科學院細胞庫,ADV4-U6-CMV重組穿梭質粒和pGp-Ad-pac載體骨架質粒購自吉瑪基因。
1.1.2 主要試劑與儀器 RNA引物合成及DNA測序(美國,Invitrogen公司)。限制性內切酶EcoRI(NEB,R0101M)、BamHⅠ(NEB,R0136S),T4 DNA連接酶(NEB,M0202L),RNAi-Mate轉染試劑(吉瑪基因,G04001),Polybrene(Sigma,H9268)、carabin抗體(Abcam,ab77625)、β-actin抗體(Abcam,ab115777)、山羊抗兔IgG(碧云天,WSA0208)。二氧化碳培養箱(SANYO,MCO-15AC),生物安全柜(上海上凈凈化設備有限公司,BSC-ⅡA2),熒光顯微鏡(Motic,AE31-252B)。
1.1.3 引物設計及合成 針對大鼠carabin基因,設計3對carabin-shRNA寡核苷酸序列(carabin-shRNA-1:5′-GAC CTT ACA CTG GGA GAA GAC-3′;carabin-shRNA-2:5′-GTC TAC CTC CCT GGC TAC TAT-3′;carabin-shRNA-3:5′- AGC TGC AGG AAG AGG TCT TCA -3′),分別插入ADV4-U6-CMV穿梭質粒的EcoRⅠ與BamHⅠ酶切位點,由上海生工生物工程技術服務有限公司合成3對寡核苷酸,規格為2A。
1.2 方法
1.2.1 ADV4-U6-CMV-carabin-shRNA重組穿梭干擾質粒的構建及篩選 將3對carabin-shRNA寡核苷酸退火形成雙鏈,EcoRⅠ與BamHⅠ酶切寡核苷酸和ADV4-U6-CMV穿梭質粒,T4 DNA連接酶連接酶切后的寡核苷酸和ADV4-U6-CMV穿梭質粒。將3組連接產物轉化至DH5a化學感受態細胞,接種于含氨芐西林的培養基平板,次日挑選陽性單克隆菌群,藥液培養過夜,菌液送上海生工生物測序,將序列無誤的質粒分別命名為ADV4-U6-CMV-carabin-shRNA-1、ADV4-U6-CMV-carabin-shRNA-2、ADV4-U6-CMV-carabin-shRNA-3。
1.2.2 AD-carabin-shRNA包裝、收毒及擴增 將制備的ADV4-U6-CMV-carabin-shRNA腺病毒穿梭質粒與pGp-Ad-pac載體骨架質粒經高純度無內毒素抽提后,用轉染試劑RNAi-Mate進行共轉染293A細胞,轉染后6 h更換為完全培養基,培養2周,每7 d左右補充一次新鮮培養基,然后收集細胞和上清液置于離心管中,凍融3次,2 000 r/min離心5 min,取上清即為病毒液初代原液。連續三代反復擴增收集病毒后,行病毒的大量擴增,然后對其純化和濃縮后得到高滴度的腺病毒濃縮液。
1.2.3 AD-carabin-shRNA滴度測定 參考復旦大學遺傳學研究所方法[8],在293T細胞中測定并標定病毒滴度,采用微量全細胞病變法檢測病毒滴度。取96孔板,每孔加入0.5×104~1×104293T細胞,48 h后棄去培養液,每孔加入100 μL經10倍梯度稀釋的病毒液(每排8孔為一稀釋梯度),繼續培養72 h后觀察熒光表達情況。正常情況下,熒光細胞數隨稀釋倍數增加而相應減少,計數最后2排含有熒光細胞的孔中的熒光細胞個數,將得到的數值除以各自相應的稀釋倍數,即可計算出病毒原液的滴度值。病毒滴度=(X+Y×10)×1 000/2V (X、Y分別為最后兩排有熒光的熒光細胞克隆數,V為病毒液的含量)。
1.2.4 AD-carabin-shRNA功能鑒定 H9C2心肌細胞傳代至108時接種于6孔板中,當細胞生長至90%融合時,每孔加入含1×105病毒的100 μL病毒液,孵育4 h后更換培養基,44 h后檢測H9C2心肌細胞的carabin RNA及蛋白表達。采用實時熒光定量PCR及Western blotting檢測carabin mRNA和蛋白表達。其中3孔棄去培養液后,每孔按1 mL/10 cm2加入分離試劑tripure isolation reagent,按照說明書提取總RNA,接著按照Transcriptor First Stand cDNA Synthesis Kit試劑盒將RNA反轉成cDNA,然后用LightCycler 480 PCR儀對carabin進行實時熒光定量PCR擴增。擴增條件為:95 ℃預變性10 min,95 ℃ 10 s~60 ℃ 10 s(熒光檢測),40個循環。carabin引物序列,上游引物:5′-GGT GCA GCA AGG AGC CTG-3′,下游引物:5′-TGA GTC GGA CCC TAG AGA GC-3′,產物長度118 bp。內參β-actin引物序列,上游引物:5′-GGA GCA ATG ATC TTG AT-3′,下游引物:5′-CCT TCC TGG GCA TGG AGT C-3′,產物長度202 bp。另外3孔棄去培養液后,每孔加入500 μL細胞裂解液RIPA,超聲裂解細胞收集蛋白,加入SDS煮沸變性蛋白,然后進行SDS-PAGE電泳、轉膜、孵育一抗、孵育二抗、顯色、成像,觀察carabin蛋白表達,內參為β-actin。
1.3 統計學方法 采用方差分析和q檢驗。
2 結果
2.1 ADV4-U6-CMV-carabin-shRNA重組穿梭干擾質粒的構建 DNAMAN比對分析ADV4-U6-CMV-carabin-shRNA重組穿梭干擾質粒的基因測序結果,挑選與設計的3對carabin-shRNA寡核苷酸序列一致者,分別命名為ADV4-U6-CMV-carabin-shRNA-1、ADV4-U6-CMV-carabin-shRNA-2、ADV4-U6-CMV-carabin-shRNA-3(見圖1)。

2.2 Ad-carabin-shRNA包裝、收毒、擴增及滴度測定 將制備的ADV4-U6-CMV-carabin-shRNA腺病毒穿梭質粒與pGp-Ad-pac 載體骨架質粒共轉染293A 細胞后,2周左右時顯微鏡下觀察細胞出毒情況,待出現明顯噬斑、細胞大部分病變從底部脫落時進行收毒。采用微量全細胞病變法檢測病毒滴度,以倒數第二列(10-3)含有熒光細胞孔中的熒光細胞個數計算,病毒滴度為9×108TU/mL(見圖2)。

2.3 Ad-carabin-shRNA功能鑒定 與對照組相比,Ad-carabin-shRNA-1和Ad-carabin-shRNA-2均可明顯干擾carabin mRNA及蛋白表達(P<0.01)(見圖3、表1)。
3 討論
經結構鑒定,carabin蛋白含有一個CaN 結合區域和一個Ras結合區域:CaN結合區域位于羧基端,其最小結合區域為羧基末端的41個氨基酸殘基(aa 406~446);Ras結合區域為氨基端的89位到294位氨基酸序(aa 89~294)[1]。經在體和離體實驗的功能鑒定:(1)CaN 結合區域,carabin的轉錄和表達依賴于CaN信號通路的活化,而產生的carabin可與CaN結合,進而抑制CaN信號通路,因此carabin是作為CaN的負反饋抑制蛋白來發揮其調節作用的;(2)Ras結合區域,具有Ras GAP活性,可特異性地抑制Ras/ERK1/2信號通路。前期研究[1-4]表明,在T細胞及B細胞中carabin作為CaN的內源性負反饋抑制蛋白通過CaN-NFAT和Ras/ERK1/2信號通路負反饋抑制T細胞及B細胞的持續活化,在機體免疫中發揮著重要作用。

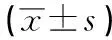
表1 Ad-carabin-shRNA在H9C2心肌細胞內的干擾效應
最近研究[5-6]表明,carabin在心肌細胞中亦有表達,可抑制心臟肥厚,并有可能成為診治心衰的新靶點。我們的前期研究[7]顯示,在小鼠冠狀動脈左前降支結扎誘導的心肌梗死動物模型中,術后7 d及14 d梗死區域carabin的mRNA及蛋白表達水平均顯著下調(約7倍),同時經缺血/缺氧處理的人心室肌細胞株AC16中表達均亦顯著下調。那么下調的carabin在心肌梗死中是否會起到一定的作用呢,目前尚無相關研究報道。 carabin為一新發現的蛋白,目前尚未發現其特異性抑制劑,鑒于此,本研究利用RNA干擾(RNA interference,RNAi)技術,針對carabin蛋白構建相應干擾載體,以達到特異性抑制carabin的作用,為carabin的研究奠定基礎。
RNAi技術是一種由外源性或內源性雙鏈DNA介導的轉綠后基因沉默技術。短發夾RNA(short-hairpin RNA,shRNA)是根據小干擾RNA(small interfering RNA,siRNA)技術設計的類似雙鏈結構的RNA。相比于siRNA,shRNA隨載體進入細胞后具有更高的內在穩定性,并且shRNA根據其特性可以在細胞內快速合成大量的shRNA,其沉默作用更加持久[9]。目前,用于目的基因轉移的病毒載體主要包括腺病毒、腺相關病毒、慢病毒和逆轉錄病毒載體。與其他病毒載體系統相比,腺病毒載體具有遺傳毒性低、不整合基因組、寄主范圍廣、感染效率高、可感染分裂期和靜止期細胞、理化性質穩定及包容量大等優點,在分子生物學領域應用廣泛[10]。因考慮后期研究涉及動物及細胞實驗,對干擾效率要求高,因此本研究采用腺病毒載體構建carabin干擾載體。
在Ad-carabin-shRNA 構建過程中,我們首先合成3對carabin-shRNA寡核苷酸,退火形成雙鏈后定向克隆至ADV4-U6-CMV穿梭質粒,經測序驗證后與pGp-Ad-pac Vector骨架質粒共轉染 293A 細胞,培養2周后收集病毒原液,再連續三代反復行病毒擴增。病毒滴度測定后,感染H9C2心肌細胞行Ad-carabin-shRNA功能鑒定,鑒定結果表明,AD-carabin-shRNA-1和AD-carabin-shRNA-2具有干擾效果。

