固體脂質納米粒理化性質對納米粒吸附蛋白的影響
孫 玥,周文忠
(中國農業大學動物醫學院 北京 100193)
固體脂質納米粒(Solid lipid nanopartcles,SLN)是從20世紀開始逐步發展起來的一種新型納米粒子載體[1]。SLN 采用固態的合成的或者天然的類脂作為脂質材料,在乳化過程或乳化后可使蛋白以某種方式與脂質納米相結合,其粒徑范圍一般在10~1000 nm。SLN擁有生理相容且耐受性好的特點,并且與傳統的藥物制劑相比具有較高的生物利用度[2-3]、增加藥物在體內吸收和靶向性[4-5]、延緩藥物釋放度等優點。
制備SLN的脂質材料有許多種,由于飽和脂肪酸甘油酯、脂肪酸、混合脂質等材料如:三酰甘油類如單硬脂酸甘油酯、三棕櫚酸甘油酯、二十二酸單、雙、三甘油酯混合物、三硬脂酸甘油酯;脂肪酸類如棕櫚酸、硬脂酸等;類固醇類如膽固醇等;蠟質類如鯨蠟醇棕櫚酸酯、鯨蠟醇十六酸酯等。其中硬脂酸使用更頻繁,硬脂酸屬于長鏈飽和脂肪酸,是機體脂肪的重要組成成分和主要能量來源,理化性質穩定,在體內可以降解,是一種理想的脂質材料。此外在制備SLN時也可以混合加入幾種不同的脂質材料,從而達到不同的制備目的如改變粒徑、電位等。
與其它納米載藥系統相比,SLN具有易于制備、成本低、可大規模生產、擁有良好的物理穩定性、無有機溶劑的情況下SLN無脂質載體系統的毒性等[6-7]。SLN已成為國內外藥劑學領域的研究熱點,如今已有SLN作為疫苗佐劑的相關研究,如Himanshu Mishraa等利用SLN呈遞乙肝病毒表面抗原[8]。
蛋白附著到納米顆粒可以通過簡單的物理吸附或更復雜的方法,例如:化學結合或包封實現。吸附通常是基于電荷或疏水作用[9]。包封,即在合成過程中蛋白與納米粒子在納米粒子制備過程中混合,蛋白進入納米顆粒包封完成[10],只有當納米顆粒在體內被分解時才被釋放。對于化學結合,是將蛋白化學交聯到納米粒子顆粒的表面[11]。表面吸附簡單易行、使用方便、成本低,更適合于獸醫藥的應用。
本文研究的固體脂質納米擁有毒性低、制備簡單、易工業化大規模生產等特點,滿足獸醫藥領域的需求。實驗用熱熔乳化超聲技術制備固體脂質納米粒,研究納米粒理化性狀對吸附率影響因素,揭示影響固體脂質納米粒吸附性的主要因素,為固體脂質納米-蛋白載體的研究和應用奠定基礎。
1 材料和方法
1.1 實驗材料 單甘脂、十四酸、考馬斯亮藍(G-250)購于國藥化學試劑有限,聚乙烯醇(Poly vinyl alcohol, PVA)和BSA購于 Sigma,雙十八烷基二甲基氯化銨(Dimethyldioctadecyl ammonium chloride, DDAC)購于上海阿拉丁生化試劑有限公司。
1.2 固體脂質納米粒制備 將1克脂質材料放入50 mL離心管中,置于沸水浴中加熱使脂融化,再將融化的脂質混合物置于55 ℃ 的水浴鍋中放置1~2 min。后加入10 mL在55 ℃ 水浴鍋中預熱的PVA溶液,使用細胞破碎儀(VC X 750 超聲波細胞破碎儀)直徑13 mm探頭,功率35%,超聲處理一定時間,分別加入10 mL冷卻水后搖勻成納米懸液。將各組固體脂質納米懸液樣品分別取2 mL,14000 r/min離心40 min,收集沉淀后再將沉淀懸浮至2 mL水中重復離心一次,收集底部沉淀后將其置于凍干機于-49 ℃、1 Pa的條件下將水分抽干制成凍干粉,于置-20 ℃儲存備用,每組設置三個樣品。
1.3 粒徑、電位、多分散系數的檢測 利用光子相關譜法(PCS)檢測納米粒子的粒徑和分散度。分別取200 μL已制備好的固體脂質納米懸液于4 mL離心管中,將檢測樣品稀釋12.5倍,在樣品池中加入1400 μL在25 ℃ 條件下用納米激光粒度儀ZS90(Malvern Instruments, UK)檢測納米粒子平均粒徑(mean diameter, MD)和多分散性系數(polydispersity index, PDI)。將上述檢測樣品繼續稀釋10倍,取800 μL加入到導電樣品池中檢測表面電位(zeta potential, ZP)。
1.4 Bradford法檢測BSA標準曲線的制作 將10 mg/mL的BSA溶液用PBS稀釋得到濃度分別為100、80、60、40、20 μg/mL的溶液,取500 μL溶液分別與2 mL考馬斯亮藍混合反應5 min后用分光光度計測定595 nm處吸光值。實驗每組三個重復,然后以OD595的三次平均值做橫坐標,BSA溶液的濃度做縱坐標,即得標準曲線。
1.5 吸附率檢測 稱取納米粒凍干粉12.5 mg,加入500 μg/mL的BSA至體積為250 μL。再加入生理鹽水至總體積為1 mL。將其置于離心機14000 r/min離心40 min,將上清液取出500 μL與2 mL配制好的考馬斯亮藍溶液反應,反應5 min后在記錄595 nm處OD值,重復此操作直到上清液與考馬斯亮藍反應呈現陰性,將數值帶入標準曲線計算未被吸附的蛋白量,通過公式計算得出吸附率。
BSA吸附率={(加入總的蛋白量-未吸附的蛋白量)/ 加入的總蛋白量}×100%
2 結果與分析
2.1 固體脂質納米理化性狀 固體脂質納米懸液外觀呈乳白色,無味;顆粒大小均勻,分散性良好,無沉淀。不同制備方案制備的固體脂質納米粒平均粒徑(mean diameter, MD)、多分散性系數(polydispersity index, PDI)、表面電位(zeta potential, ZP)如表1所示。

表1 不同條件制備的固體脂質納米粒理化性狀(mean±S.D.,n=3)
2.2 BSA標準曲線 Bradford法檢測BSA標準曲線BSA在1-100 μg/ml范圍內呈現良好的線性關系, R2為0.9921。
2.3 不同脂質材料納米粒吸附率比較 如圖1 所示,SLN1(單甘脂與十四酸)的吸附率顯著高于SLN5(氫化蓖麻油)固體脂質納米粒的吸附率(P=0.023)。
2.4 不同表面電位納米粒吸附率的比較 由圖2可知,正電位SLN3(25.7±1.15 mV)的吸附率明顯高于負電位SLN1(-25.1±1.6 mV)(P=0.021)。
2.5 不同粒徑納米粒吸附率的比較 如圖3所示,不同粒徑的固體脂質納米顆粒的吸附性比較結果為:SLN1(300±3 nm)分別與SLN2(100±5 nm)、SLN6(669±4 nm)相比差異性不顯著,但SLN2(100±5 nm)與SLN6(669±4 nm)相比較差異顯著(P=0.01)。
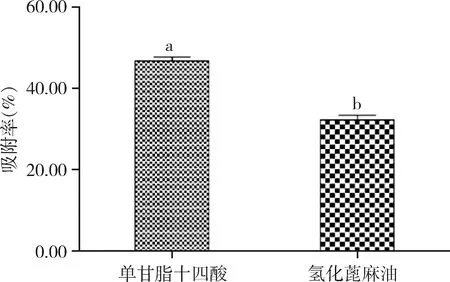
圖1 不同材料固體脂質納米粒吸附率的比較
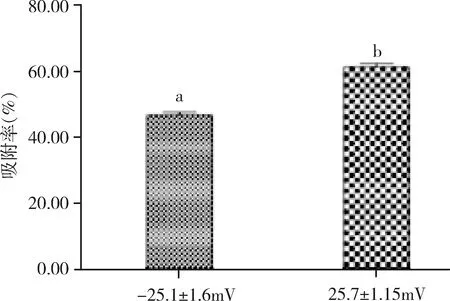
圖2 不同電位固體脂質納米粒吸附率的比較
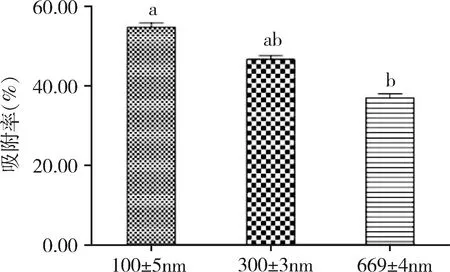
圖3 不同粒徑固體脂質納米粒吸附率的比較
2.6 不同脂質含量固體脂質納米粒吸附率的比較如圖4所示,不同密度的納米懸液中脂質含量不同吸附率也不同,濃縮組和正常組的吸附率無顯著差異,但稀釋組的吸附率與濃縮組和正常組有顯著差異,P值分別為0.028、0.027。

圖4 不同脂質含量固體脂質納米粒吸附率的比較
2.7 不同PVA濃度固體脂質納米粒吸附率的比較 如圖5所示,不同PVA濃度乳化的固體脂質納米粒吸附率比較結果為SLN2、SLN4無顯著差異。
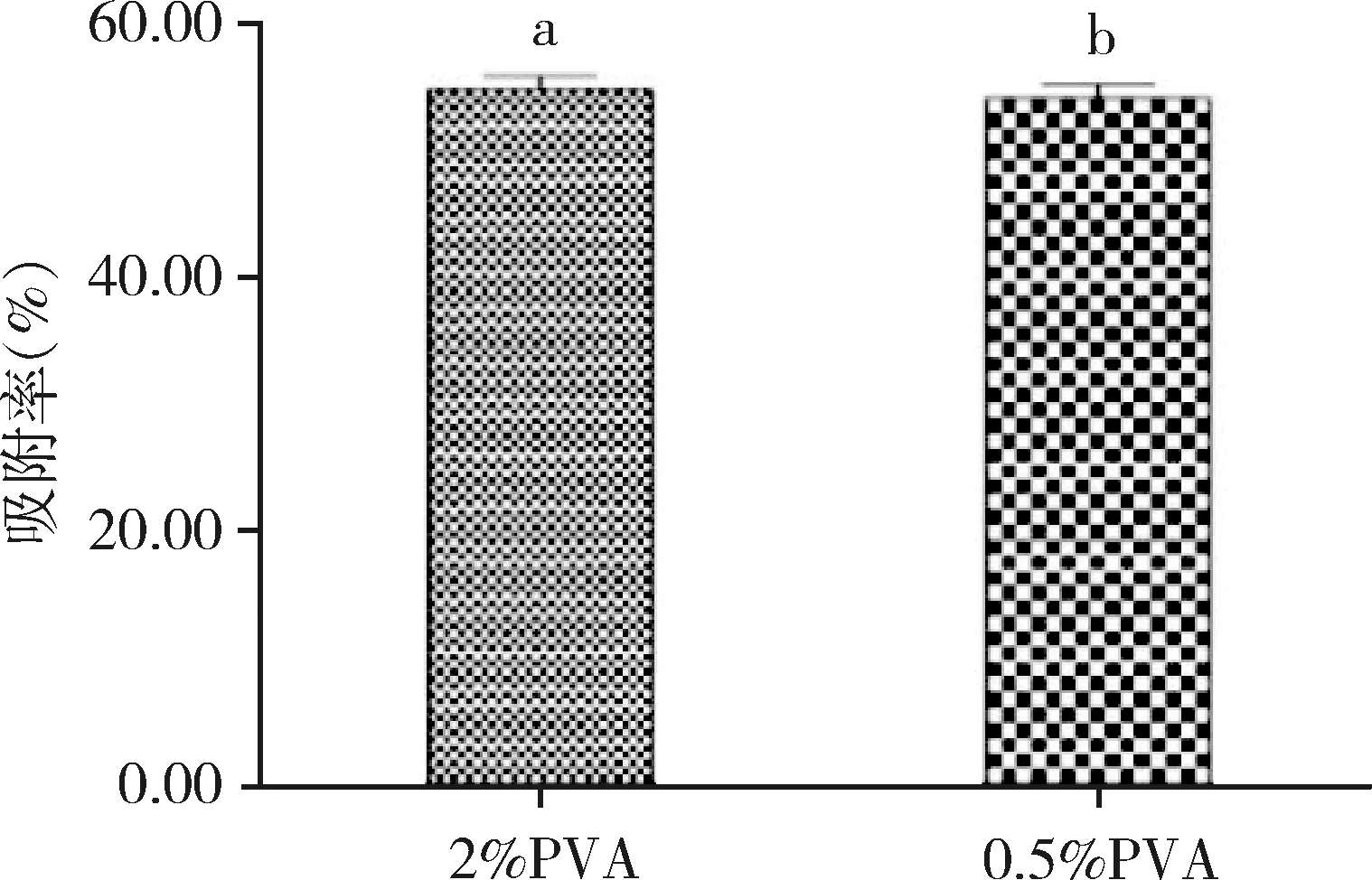
圖5 不同PVA濃度固體脂質納米粒吸附率的比較
3 討論與結論
研究固體脂質納米粒吸附性的影響因素的目的是為了增加蛋白的表面吸附、減少劑量、降低成本或提高安全性。無論是真核細胞還是原核細胞,納米粒子第一步都是先吸附后再通過其他途徑進入到細胞內發揮作用。通常正電位納米粒子與負電位納米粒子在靜電作用下更容易吸附到表面負電位的細菌或細胞表面。細胞對于納米粒子的粒徑也有著嚴格的控制如:DCs會優先攝取病毒大小的顆粒粒徑約為20~200 nm,巨噬細胞則優先攝取0.5~5 μm的顆粒[12]。
氫化蓖麻油的吸附性與單甘脂十四酸混合材料制備的固體脂質納米粒有顯著差異。其原因可能是由于在相同質量下十四酸的相對分子質量為228,單甘脂為358.57。而HCO為938,相同質量下十四酸和單甘脂的分子個數多于氫化蓖麻油,產生的氫鍵也多于氫化蓖麻油。因此,范德華力更強,且十四酸中含有的羧基與BSA產生的范德華力強于HCO中的羥基,十四酸和單甘脂與BSA的吸附更牢固,吸附率更高。
粒徑對于細胞攝取納米粒有著很重要的因素,其對于抗原的吸附率也會產生一定程度的影響。為了制備不同的固體脂質納米粒,將乳化時間延長,制備了粒徑更小的納米粒。結果表明,將不同粒徑納米粒子的吸附性進行檢測粒徑越小吸附性越高,但持續減小并無顯著差異。粒徑小吸附率高可能是由于小粒徑的比表面積(即單位質量物料所具有的總面積)更大,與蛋白接觸機會多,使更易納米粒子結合。
為了制備表面電位為正的固體脂質納米粒,在脂質材料中加入了帶有陽離子基團的雙十八烷基二甲基氯化銨(DDAC)。DDAC的量要適當,過多提高固體脂質納米粒的表面電位可能會引起溶血等不良反應[13]。將帶有正、負不同表面電位的固體脂質納米粒進行比較正電位的吸附率顯著高于負電位。BSA等電點為4.8,在中性溶液中帶負電,在靜電作用下更易與正電位的固體脂質納米粒結合。
適宜的脂質含量對制劑的使用也很重要,過多的脂質材料注入機體可能會對注射部位產生不良反應,對體內的代謝、抗原的緩釋也有一定的影響[14]。本實驗中,納米粒密度低時增加密度可以提高對蛋白的吸附率,這可能是由于納米粒對BSA的吸附達到飽和狀態,增加納米粒可以吸附游離的蛋白。而進一步提高納米量卻沒有顯著增加吸附率,這可能由于游離的于吸附的BSA量達到了動態平衡,吸附率相對穩定。
我們的前期研究顯示PVA濃度與SLN的粒徑、電位、分散系數、包封率等均有關系[15],但本研究顯示PVA濃度對納米粒吸附率沒有明顯影響,對乳化后固體脂質納米粒的狀態有一定影響。
固體脂質納米粒對蛋白有普遍的吸附性,但影響吸附的因素很多,可針對不同蛋白通過改變材料、表面電位、粒徑、脂質含量進行優化。
固體脂質納米粒通過表面吸附作為蛋白載體在獸藥如疫苗有一定的實用性,通過納米粒制備組方優化能夠更好地發揮納米載體的功效。

