結直腸癌組織中lncRNA FOXC2-AS1與EZH2的表達及臨床意義
趙鋼艷,熊將軍,劉靈芝,王明明,王 璨,易小明
湖南中醫藥高等專科學校附屬第一醫院/湖南省直中醫院檢驗科,湖南株洲 412000
結直腸癌(CRC)是常見的消化系統惡性腫瘤,全球每年新發患者約110萬例,死亡患者達88萬例[1]。近年來,隨著我國人民生活水平的提高,CRC的發病率有逐漸升高的趨勢,嚴重威脅人民的身體健康[2]。深入研究CRC的病因及發生發展的機制,對臨床診斷及治療具有重要意義。長鏈非編碼RNA(lncRNA)是長度約為200~300 bp的非編碼RNA分子,發揮基因調控、分子支架的功能,廣泛參與炎癥、免疫及腫瘤等多種生理病理過程[3-4]。研究表明lncRNA在腫瘤中發揮重要作用[4]。FOXC2-AS1基因位于16q24.1,是一種能調控基因表達的lncRNA,參與細胞發育、分化及衰老等過程的調控[5]。研究表明,lncRNA FOXC2-AS1在非小細胞肺癌、骨肉瘤等腫瘤中存在表達異常的現象[6-7],能夠抑制抑癌基因P16的表達,促進惡性腫瘤的進展。Zeste基因增強子同源物2(EZH2)基因位于7q36.1,該基因編碼的蛋白屬于多梳蛋白復合物家族成員,參與細胞增殖、傳代等,具有維持促增殖基因的持續轉錄狀態的功能。RINKE等[8]報道,EZH2在腫瘤中發揮致癌基因的作用,如在白血病、乳腺癌等腫瘤中均能夠促進腫瘤細胞增殖、浸潤及轉移等。此外,腫瘤中EZH2的表達升高還參與腫瘤化療耐藥性的形成,可能是新的腫瘤診斷及治療靶點[9]。目前CRC中lncRNA FOXC2-AS1與EZH2相關的研究報道較少。本研究通過研究CRC組織中lncRNA FOXC2-AS1與EZH2的表達,探討二者的臨床意義。
1 資料與方法
1.1一般資料 收集2014年2月至2015年2月于本院診治的86例CRC患者的臨床病理資料。納入標準:(1)CRC診斷均經病理學檢查明確診斷;(2)初次診治,患者以往無放化療、靶向治療病史;(3)臨床病理及隨訪資料完整,患者無精神障礙性疾病。排除標準:(1)合并有潰瘍性結腸炎、急慢性胃腸道炎癥及自身免疫性疾病等。(2)有其他器官惡性腫瘤病史。(3)伴嚴重的心肺等臟器功能衰竭。86例CRC患者中男51例,女35例;年齡29~78歲,平均(51.5±7.2)歲;直腸癌31例,結腸癌55例;伴有淋巴結轉移者24例,無淋巴結轉移者62例;腫瘤最大徑≤3 cm者60例,>3 cm者26例;腫瘤分期:Ⅰ期32例,Ⅱ期26例,Ⅲ期22例,Ⅳ期6例;病理分級:高中分化61例,低分化25例。本研究經患者及家屬知情同意并已簽署知情同意書,且經本院倫理委員會審核通過。
1.2方法
1.2.1實時熒光定量PCR檢測lncRNA FOXC2-AS1及EZH2中mRNA表達 取術中黃豆粒大小的癌組織,以及距癌組織邊緣3 cm以上的正常組織(經病理學檢查明確診斷)作為癌旁組織,標本置于液氮中保存。取50 mg組織,應用Trizol法提取組織中總RNA,分光光度法鑒定RNA的濃度及純度,吸光度(A)260/A280為1.8~2.1,無菌無酶水溶解后在-80 ℃條件下保存。以總RNA為模板,用TaqMan反轉錄試劑盒反轉錄合成cDNA。FOXC2-AS1正向引物序列為5′-CCT TCC TGG CTG TTC ATC GG-3′,反向引物序列為5′-TGG AAA TAA GTG GCA CGC CC-3′;EZH2正向引物序列為5′-ATC AGA GTA CAT GCG ACT GAG A-3′,反向引物序列為5′-GCT GTA TCC TTC GCT GTT TCC-3′;內參基因β-actin正向引物序列為5′-TTC CTT CCT GGG CAT GGA GTC-3′,反向引物序列為5′-TCT TCA TTG TGC TGG GTG CC-3′。反應體系20 μL,Master Mix 10 μL,正向及負向引物各1 μL,模板cDNA 2 μL,ddH2O 6 μL。反應條件為:94 ℃ 15 min,94 ℃ 15 s,60 ℃ 30 s,72 ℃延伸30 s,共38個循環。所有反應均在ABI7500實時熒光定量PCR儀上完成。采用相對循環閾值(Ct值)對數據進行分析,檢測lncRNA FOXC2-AS1及EZH2 mRNA的相對表達水平,ΔCt = Ct待測基因-Ctβ-actin。
1.2.2免疫組化法檢測EZH2蛋白表達 將癌組織及癌旁組織用中性甲醛固定24 h后,石蠟包埋切片,60 ℃烤箱中烤片3 h;二甲苯脫蠟2遍;梯度水化;微波爐法抗原熱修復;3%過氧化氫去除內源性過氧化物酶0.5 h;5%羊血清封閉0.5 h;一抗4 ℃孵育過夜,EZH2一抗稀釋比1∶500,抗體購自美國Abcam公司,貨號ab227648;二抗孵育2 h;二氨基聯苯胺顯色2 min;蘇木精復染30 s;梯度脫水,封片鏡檢。制備羊抗人Notch、Dll4多克隆抗體(工作濃度為1∶500)和即用型二抗(工作濃度為1∶2 000);二氨基聯苯胺顯色,蘇木精復染,光鏡觀察。采用二級計分法,結果以染色面積評分×染色強度評分表示,染色面積評分:<5%為0分,5%~25%為1分,>25%~50%為2分,>50%~75%為3分,>75%為4分;染色強度評分:淡黃色為1分,黃或深黃色為2分,褐色為3分。結果<2分判定為陰性,≥2分判定為陽性。
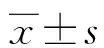
2 結 果
2.1癌組織與癌旁組織中lncRNA FOXC2-AS1、EZH2 mRNA表達水平比較 癌組織中lncRNA FOXC2-AS1、EZH2 mRNA相對表達水平均高于癌旁組織(t=29.837、19.736,均P<0.05),見圖1。

圖1 癌組織與癌旁組織中lncRNA FOXC2-AS1、EZH2 mRNA表達水平比較
2.2癌組織與癌旁組織中EZH2蛋白表達水平比較 癌組織EZH2蛋白主要表達于腫瘤細胞的細胞核,癌組織中EZH2蛋白表達陽性率為88.4%(76/86),癌旁組織中EZH2蛋白表達陽性率為10.5%(9/86),癌組織中EZH2蛋白表達陽性率高于癌旁組織(χ2=104.410,P<0.05)。見圖2。

注:A為癌組織EZH2蛋白陽性表達;B為癌旁組織EZH2蛋白陽性表達。
2.3癌組織中lncRNA FOXC2-AS1與EZH2 mRNA表達的相關性 癌組織中lncRNA FOXC2-AS1與EZH2 mRNA表達水平呈正相關(r=0.611,P<0.05)。
2.4癌組織中lncRNA FOXC2-AS1、EZH2蛋白表達與臨床病理參數的關系 癌組織中lncRNA FOXC2-AS1蛋白表達水平及EZH2蛋白陽性表達與患者腫瘤TNM分期有關(P<0.05),與患者的性別、年齡、腫瘤大小、腫瘤位置、腫瘤分化程度及是否伴淋巴結轉移無關(P>0.05)。Ⅲ~Ⅳ期癌組織中lncRNA FOXC2-AS1蛋白表達水平、EZH2蛋白陽性表達明顯高于Ⅰ~Ⅱ期癌組織(P<0.05)。

表1 癌組織中lncRNA FOXC2-AS1、EZH2蛋白陽性表達與臨床病理特征關系

續表1 癌組織中lncRNA FOXC2-AS1、EZH2蛋白陽性表達與臨床病理特征關系
2.5癌組織中不同lncRNA FOXC2-AS1、EZH2表達水平患者生存率比較 86例CRC患者中,死亡41例,存活45例,5年總體生存率為52.3%。lncRNA FOXC2-AS1高表達組44例,死亡30例,存活14例;lncRNA FOXC2-AS1低表達組42例,死亡11例,存活31例。Kaplan-Meier生存曲線分析結果表明lncRNA FOXC2-AS1高表達組患者5年總體生存率明顯低于lncRNA FOXC2-AS1低表達組患者(P<0.05)。EZH2蛋白高表達組42例,死亡29例,存活13例;EZH2蛋白低表達組44例,死亡12例,存活32例。Kaplan-Meier生存曲線分析結果表明EZH2蛋白高表達組患者5年總體生存率低于EZH2蛋白低表達組患者(P<0.05)。見圖3。

注:A為不同lncRNA FOXC2-AS1表達患者生存率比較;B為不同EZH2表達患者生存率比較。
3 討 論
近年來隨著我國人民飲食方式的改變及人口老齡化的加劇,CRC的發病率及病死率有逐漸升高的趨勢。目前CRC的治療主要包括手術治療、放化療、靶向藥物治療及免疫治療等,部分早期患者獲得良好的治療效果,5年總體生存率達60%[10]。但晚期轉移患者療效不佳,即使經積極綜合治療后,患者的5年總體生存率低于10%。因此,有必要深入研究CRC發生發展的機制,尋找有效的早期診斷及藥物治療靶點。非編碼RNA是近年來發現的細胞內不具有蛋白編碼功能,但參與調控基因表達的小分子RNA,可分為lncRNA、微小RNA及環狀RNA等。研究發現,lncRNA參與細胞發育、分化及凋亡等生物學調控過程,與感染、免疫及腫瘤等密切相關,有可能成為新的疾病診斷治療的分子靶點[11]。
lncRNA lncRNA FOXC2-AS1是叉頭盒蛋白C2(FOXC2)的反義RNA轉錄物,調控哺乳動物的發育及分化等過程[12]。近年來研究表明,lncRNA FOXC2-AS1在骨肉瘤[13]及肺癌[6]等腫瘤中表達上調,并能夠作為一種致癌基因,抑制下游抑癌基因P15的表達,進而促進腫瘤細胞的惡性增殖及轉移。本研究中,CRC癌組織中lncRNA FOXC2-AS1表達上調。但其表達上調的機制尚不清楚,可能與FOXC2-AS1轉錄后調控異常有關。有研究報道,miR-548c-5p能夠結合于FOXC2-AS1 mRNA的3′非編碼區,導致FOXC2-AS1 mRNA的穩定性下降,進而降低lncRNA FOXC2-AS1的表達水平,但在CRC中miR-548c-5p表達水平降低,結合FOXC2-AS1 mRNA的能力降低,從而促進lncRNA FOXC2-AS1表達[14-15]。此外,CRC癌組織中lncRNA FOXC2-AS1的表達水平與腫瘤分期有關,lncRNA FOXC2-AS1促進腫瘤的發生發展。PAN等[16]報道,lncRNA FOXC2-AS1表達水平升高可以促進CRC腫瘤細胞內Ca2+水平升高,激活蛋白酪氨酸激酶2(FAK)信號通路的傳導,增強FOXC2 mRNA的穩定性,從而促進CRC增殖、遷移和侵襲。因此,lncRNA FOXC2-AS1有可能成為新的CRC潛在有效治療靶點。本研究進一步分析癌組織中lncRNA FOXC2-AS1的表達與患者生存預后的關系,結果表明高表達lncRNA FOXC2-AS1的CRC患者5年總體生存率降低,表明lncRNA FOXC2-AS1的高表達可能導致患者的不良預后,檢測癌組織中lncRNA FOXC2-AS1的表達有可能成為提示CRC患者預后的腫瘤標志物。
EZH2屬于多梳蛋白家族成員,位于人類染色體7q36.1,參與調控早期胚胎發育、細胞分化及凋亡等生物學過程[17]。有研究報道,在舌鱗癌[18]、乳腺癌[19]等腫瘤中EZH2基因存在表達上調的現象,其能催化組蛋白H3賴氨酸27位的三甲基化,抑制下游抑癌基因P53等的表達,促進腫瘤細胞的惡性增殖及浸潤、轉移。本研究中,癌組織中EZH2 mRNA及蛋白的表達水平升高,可能與CRC中EZH2的轉錄調控異常有關。FENG等[20]研究表明,調控EZH2表達的轉錄因子E2F轉錄因子1(E2F1)表達水平升高,E2F1結合EZH2的基因啟動子區,導致EZH2表達水平升高。本研究中,CRC中癌組織中EZH2的表達與腫瘤分期有關,表明CRC發生時EZH2促進腫瘤的發生發展。其機制可能是EZH2的表達水平升高激活Wnt信號通路,促進腫瘤細胞發生上皮間質轉化。李妍等[21]發現,EZH2的表達上調能夠抑制Wnt信號通路中β-連環蛋白的表達,促進N-鈣黏素的表達,導致腫瘤細胞的浸潤及轉移能力增強。此外,本研究中高表達EZH2的患者生存預后較差,表明CRC癌組織中EZH2的表達可能有助于預測CRC患者的生存及預后。本研究進一步分析發現,CRC癌組織中lncRNA FOXC2-AS1與EZH2 mRNA表達水平呈正相關,目前二者之間的具體作用機制尚不清楚,但CHEN等[22]在前列腺癌體外細胞實驗中發現,lncRNA FOXC2-AS1可作為分子海綿結合并抑制miR-1253的表達,進而促進miR-1253的下游靶基因EZH2的表達,在腫瘤細胞的增殖及惡性進展中發揮重要作用。
綜上所述,CRC癌組織中lncRNA FOXC2-AS1、EZH2表達水平升高,lncRNA FOXC2-AS1與EZH2 mRNA表達水平呈正相關,可能均參與了CRC的發生發展。癌組織中lncRNA FOXC2-AS1、EZH2的高表達與腫瘤分期及患者不良預后有關,二者有可能成為新的診斷及治療CRC的分子標志物,但其具體的作用機制和臨床意義需深入研究。

