甘藍BobHLH121基因克隆、亞細胞定位及表達分析
秦文斌 山溪 張振超 姚悅梅 戴忠良 秦嶺

摘要:【目的】克隆甘藍bHLH轉錄因子(BobHLH121)基因,分析其在不同組織及低溫脅迫下的表達模式,為深入研究bHLH轉錄因子在甘藍低溫響應中的作用機理提供理論參考。【方法】克隆BobHLH121基因編碼區(CDS)序列,利用生物信息學軟件進行預測分析,并構建pCAMBIA1300-FaFKF1-GFP融合表達載體,通過農桿菌介導轉染煙草表皮細胞,觀察熒光信號以確定蛋白亞細胞定位情況。采用實時熒光定量PCR(qRT-PCR)檢測BobHLH121基因在低溫脅迫下的相對表達量。【結果】BobHLH121基因CDS長度為1367 bp,定位于C06染色體上,其編碼311個氨基酸,蛋白分子量為34.89 kD,理論等電點(pI)為5.42,不穩定系數為52.29,疏水性平均系數為-0.733,說明該蛋白為不穩定的親水性蛋白,且呈酸性,定位于細胞核。BobHLH121蛋白的二級結構主要由α-螺旋(占30.87%)、延伸鏈(占9.32%)、β-轉角(占2.89%)和無規則卷曲(占56.91%)組成,具有保守的HLH結構域。BobHLH121蛋白與擬南芥(NP_191768.2)、琴葉擬南芥(EFH52923.1)、亞麻薺(XP_01909381.1)、薺菜(XP_023638997.1)、油菜(CDY65446.1)、白菜(XP_009104362.1)和蘿卜(XP_018442860.1)等多種植物bHLH蛋白的氨基酸相似性分別為55.6%、54.8%、52.0%、50.3%、76.4%、73.9%和61.1%。系統發育進化樹分析結果顯示,BobHLH121與擬南芥(NP_191768.2)和琴葉擬南芥(EFH52923.1)bHLH蛋白在同一小分支上。BobHLH121基因啟動子區域存在植物生長發育、非生物脅迫、激素應答和光響應大量的順式作用元件。BobHLH121基因在葉片的相對表達量顯著高于其他組織(P<0.05,下同),在其他組織中的相對表達量均較低。低溫脅迫6~12 h時BobHLH121基因的相對表達量較低溫處理0 h(對照)顯著降低,在低溫處理24 h時急劇升高,顯著高于其他處理時間,低溫處理48 h時又顯著降低,表明該基因可能在低溫脅迫下延遲表達。【結論】BobHLH121基因含有bHLH家族典型的HLH保守結構域序列,具有明顯的組織表達特異性,可能參與甘藍葉片的生長發育調控,且響應低溫脅迫,可能在甘藍耐寒性中發揮調控作用。
關鍵詞: 甘藍;BobHLH121基因;亞細胞定位;低溫脅迫;基因表達
中圖分類號: S635.036? ? ? ? ? ? ? ? ? ? ? ? ?文獻標志碼: A 文章編號:2095-1191(2021)12-3320-10
Cloning,subcellular localization and expression analysis of BobHLH121 gene from Brassica oleracea L.
QIN Wen-bin, SHAN Xi, ZHANG Zhen-chao, YAO Yue-mei,
DAI Zhong-liang*, QIN Ling
(Zhenjiang Institute of Agricultural Sciences in Hilly Area, Jurong, Jiangsu? 212400, China)
Abstract:【Objective】The whole length of Brassica oleracea L. bHLH transcription (BobHLH121 gene) was cloned by homologous cloning method,and its expression pattern under organ/tissue and low temperature stress was analyzed,which provided theoretical reference for studying the mechanism of bHLH transcription factor in low temperature response. 【Method】The sequence of the coding region(CDS) of BobHLH121 gene was cloned, the prediction analysis was performed using bioinformatics software, and the pCAMBIA1300-BobHLH121-GFP fusion expression vector was construc-ted through the transfection of tobacco epidermal cells, and the fluorescent signal was observed to determine the subcellular localization of the protein. The relative expression of the BobHLH121 gene under low temperature stress was measured using real-time fluorescence quantitative PCR (qRT-PCR). 【Result】 The CDS length of BobHLH121 gene was 1367 bp, localized on chromosome C06, encoding 311 amino acids, protein molecular weight of 34.89 kD, theoretical isoelectric point (pI) was 5.42, the instability coefficient was 52.29, and the average hydrophobicity was -0.733, indicating that the protein was an unstable hydrophilic protein, which was acidic and localized in the nucleus. The secondary structure of BobHLH121 protein mainly consisted of α-helix (30.87%), extended chain (9.32%),β-turn (2.89%) and random coil (56.91%), with a conserved HLH domain. BobHLH121 protein was closely related to bHLH proteins in Arabidopsis thaliana (NP_191768.2), A. lyrata (EFH52923.1),Camelina sativa? (XP_01909381.1),Capsella brusa-pastoris (XP_023638997.1),B. napus(CDY65446.1),Chinese cabbage (XP_009104362.1) and radish (XP_018442860.1), and had amino acid similarities of 55.6%,54.8%,52.0%,50.3%,76.4%,73.9% and 61.1%,respectively. Phylogenetic tree analysis showed that BobHLH121 was on the same small clade as the A. thaliana (NP_191768.2) and A. lyrata (EFH52923.1) bHLH protein. A large number of cis-acting elements for plant growth and development, abiotic stress, hormone response, and light response existed in the promoter region of the BobHLH121 gene. The relative expression of the Bo-bHLH121 gene was significantly higher in leaves than in other tissues (P<0.05, the same below) and lower in all other tissues. The relative expression of BobHLH121 gene was significantly decreased under low temperature treatment for 6-12 h under low temperature treatment at 0 h (control), and increased sharply at 24 h under low temperature treatment, which was significantly higher than that of other treatments, and decreased significantly at 48 h under low temperature treatment. It indicated that the gene might be delayed in expression under low temperature stress. 【Conclusion】BobHLH121 has a conserved HLH domain typical of the bHLH family, has obvious tissue expression specificity, may participate in the re-gulation of growth and development of cabbage leaves, and respond to low temperature stress, may play a regulatory role in cabbage cold tolerance.
Key words: Brassica oleracea L.; BobHLH121 gene; subcellular localization; low temperature stress; gene expression
Foundation item:Jiangsu Science and Technology Plan Project(BE2020403); Zhenjiang Science and Technology Plan Project(NY2020001)
0 引言
【研究意義】堿性螺旋-環-螺旋(Basic helix-loop-helix,bHLH)轉錄因子是一類廣泛存在于真核生物中的調節蛋白超家族,其家族成員具有高度保守的HLH結構域(Toledo-Ortiz et al.,2003;Li et al.,2006),通過轉錄調控或核定位等相關功能激活或抑制相關的下游基因,從而調節植物的生長發育過程以及生物和非生物脅迫響應(Agarwal et al.,2006a;Feller et al.,2011;Gong et al.,2015)。甘藍(Brassica oleracea L.)為十字花科蕓薹屬植物,在我國廣泛種植,年種植面積達到90萬ha左右,但多為露地栽培,極易遭受冷害、日灼、病蟲害等多種非生物和生物脅迫。其中,低溫脅迫可改變植物細胞內蛋白結構和活性,從而影響光合作用等一系列酶促反應的速率,最終導致植株葉片萎蔫黃化等現象(Miura and Furumoto,2013)。因此,開展甘藍bHLH轉錄因子基因克隆及低溫脅迫下表達模式研究,以期挖掘其抗逆基因,對改良甘藍品種抗性具有重要意義。【前人研究進展】隨著不同植物基因組測序的完成,擬南芥(Carretero-paulet et al.,2010)、大白菜(Song et al.,2014)、番茄(Sun et al.,2015;Wang et al.,2015)、蘋果(Mao et al.,2017)等植物中bHLH轉錄因子家族成員已被鑒定。研究發現,bHLH轉錄因子參與花青素的生物合成(Toledo-Ortiz et al.,2003;Gonzalez et al.,2008;Pires and Dolan,2010)、生物與非生物脅迫(Sorensen et al.,2003;Hichri et al.,2011)、植物器官發育(Goossens et al.,2017;Takahashi et al.,2017)等。bHLH轉錄因子家族蛋白具有高度保守的bHLH結構域,其長度約為50~60個氨基酸,分為2個不同的區域,即堿性區域和螺旋-環-螺旋區域(HLH),其中,N-端的堿性區域包含13~17個親水性的堿性氨基酸,具有與DNA識別和結合的位點,參與DNA結合(Mao et al.,2017)。植物感知低溫后,會將冷信號通過低溫信號轉導途徑傳遞下去,最終誘導冷脅迫相關基因的表達,增加植株適應性,而CBF依賴的冷信號途徑普遍存在于高等植物中,現已在擬南芥中發現(劉雙等,2017)。擬南芥的ICE(Inducer of CBF expression)是CBF低溫響應通道上游的調控基因,編碼一個類似MYC bHLH結構的轉錄因子(Kurbidaeva et al.,2015)。擬南芥中有2個ICE基因(AtICE1和AtICE2),其中AtICE1基因正調控CBF3信號途徑,通過與MYB15蛋白互作,抑制MYB15對CBF的負調控作用(Kurbidaeva et al.,2015);AtICE2基因則通過調節CBF1基因表達來正調控植物的低溫響應(Agarwal et al.,2006b)。此外,Li等(2010)研究發現,水稻OrbHLH001基因在擬南芥中過量表達時,顯著提高了擬南芥的抗寒能力。Chen等(2012)研究發現,菊花bHLH家族基因CdICE1在低溫、干旱和鹽脅迫中均具有調控作用。Guo和Wang(2017)研究發現,小麥WbHLH046基因能被低溫誘導,在低溫脅迫下表達量顯著升高。Man等(2017)研究發現,水稻ICE1基因受低溫誘導上調表達。【本研究切入點】關于植物bHLH轉錄因子的結構特點和功能驗證等研究已有很大進展,但bHLH家族成員眾多,且不同植物bHLH轉錄因子的結構和調控功能變化多樣。目前,甘藍bHLH轉錄因子的相關研究鮮少,甘藍bHLH轉錄因子參與非生物脅迫響應的研究在甘藍中未見報道。【擬解決的關鍵問題】基于甘藍bHLH轉錄因子家族的生物信息學分析結果,利用同源克隆的方法克隆BobHLH121基因編碼區(CDS)序列,并通過構建pCAMBIA1300-FaFKF1-GFP融合表達載體確定蛋白亞細胞定位情況,采用實時熒光定量PCR(qRT-PCR)檢測Bo-bHLH121基因在不同組織及低溫脅迫下的相對表達量,為深入研究bHLH轉錄因子在甘藍生長發育及低溫脅迫的作用機制提供理論參考,對提高甘藍產量和抗性具有重要意義。
1 材料與方法
1. 1 試驗材料
供試的甘藍材料由江蘇丘陵地區鎮江市農業科學院提供。總RNA提取試劑盒購自天根生化科技(北京)有限公司;PrimeScript 1st Strand cDNA Synthesis Kit、T4 DNA連接酶和pMD18-T質粒載體等均購自TaKaRa公司;DNA回收純化試劑盒購自諾維贊生物科技有限公司。主要儀器設備:光照培養箱(南京恒裕儀器設備制造有限公司)、PCR儀(蘇州東勝興業科學儀器有限公司)、凝膠成像系統(上海培清科技有限公司)和實時熒光定量PCR儀(QuantStudio3,美國)。
1. 2 試驗方法
1. 2. 1 樣品采集 種子發芽后播種于基質中,在人工氣候室中進行生長(白天25 ℃/夜晚18 ℃,光照14 h/黑暗10 h),待植株長至五葉一心時進行4 ℃低溫脅迫處理(每個處理至少選取18株)。將幼苗移至春化室中低溫處理0(對照)、6、12和24 h后取樣,取每株頂端第三片完全展開的葉片,使用液氮迅速冷凍,保存于-80 ℃冰箱。
1. 2. 2 BobHLH121基因克隆 稱取2份新鮮葉片0.1 g,分別用于RNA和DNA提取。以RNA為模板,使用PrimeScript 1st Strand cDNA Synthesis Kit反轉錄合成cDNA第一條鏈。采用CTAB法提取葉片總DNA。
從甘藍基因組數據庫(Bolbase,http://brassicadb.org/brad/index.php)下載BobHLH121(Bol010854)基因編碼區(CDS)序列,使用Primer Premier 5.1設計引物(表1),委托金斯瑞生物科技有限公司合成引物。以甘藍葉片DNA為模板進行BobHLH121基因的擴增。反應體系:10×PCR Buffer 2.0 μL,40 ng/μL DNA模板1.0 μL,10 μmol/L正、反向引物(BobHLH121-1-F/BobHLH121-1-R)各1.0 μL,2 mmol/L dNTP 2.0 μL,25 mmol/L MgCl2 2.0 μL,Taq聚合酶0.25 μL,ddH2O補足至20.0 μL。擴增程序:94 ℃預變性5 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 60 s,進行35個循環;72 ℃延伸7 min。PCR產物用1%瓊脂糖凝膠電泳檢測,并使用凝膠成像儀拍照。利用PCR產物回收試劑盒回收純化目的片段,將其連接至pMD18-T后轉化大腸桿菌DH5α感受態細胞。使用LB培養基(含氨芐青霉素)進行菌落篩選,挑選陽性克隆送往南京斯普金生物科技有限公司進行測序。
1. 2. 3 生物信息學分析 在甘藍基因組數據庫中搜索BobHLH121基因的CDS、DNA和蛋白序列,利用NCBI數據庫BLAST搜索同源序列。使用MEGA 6.0的鄰接法(Neighbor-joining,NJ)構建系統發育進化樹,Bootstrap值設置為1000,其他參數為默認值。使用ExPASy(https://web.expasy.org/protparam/)預測蛋白的理化性質。使用Mapchart繪制BobHLH121基因在染色體上的位置。利用New PLACE(https://sogo.dna.affrc.go.jp/)分析BobHLH121起始密碼子上游2000 bp序列中順式作用元件;使用SOPMA(http://npsa-pbi.libcp.fr/cgi-bin/secpred-sopma.pl)預測蛋白二級結構;使用Plant-mPLoc(http://www.csbio.sjtu.edu.cn/bioinf/plant-multi/)、BacelLo(http://gpcr.biocomp.unibo.it/bacello/pred.htm)和PredictProtein(https://www.predictprotein.org/)進行Bo-bHLH121亞細胞定位預測。
1. 2. 4 BobHLH121基因在不同組織及低溫脅迫下的表達分析 BobHLH121基因在甘藍不同組織中的表達數據均從NCBI的GEO數據庫下載(登錄號:GSE42891)。根據BobHLH121基因序列,設計實時熒光定量PCR的特異引物(BobHLH121-2-F/Bo-bHLH121-2-R)(表1),選用甘藍GAPDH為內參基因(Brulle et al.,2014),并委托金斯瑞生物科技有限公司合成引物。以甘藍葉片的cDNA第一條鏈為模板,使用熒光定量PCR試劑盒SYBR Premix Ex TaqTM II,檢測BobHLH121基因在不同低溫處理時間下的表達量。反應體系:40 ng/μL cDNA模板1.0 μL、0.2 μmol/L正、反向引物(BobHLH121-2-F/BobHLH121-2-R)各1.0 μL,SYBR Premix Ex Taq 10.0 μL,ddH2O補足20.0 μL。PCR擴增采用兩步法:95 ℃ 5 s,60 ℃ 20.0 s,進行40個循環;熔解曲線分析:95 ℃ 15 s,60 ℃ 1 min,95 ℃ 1 s。
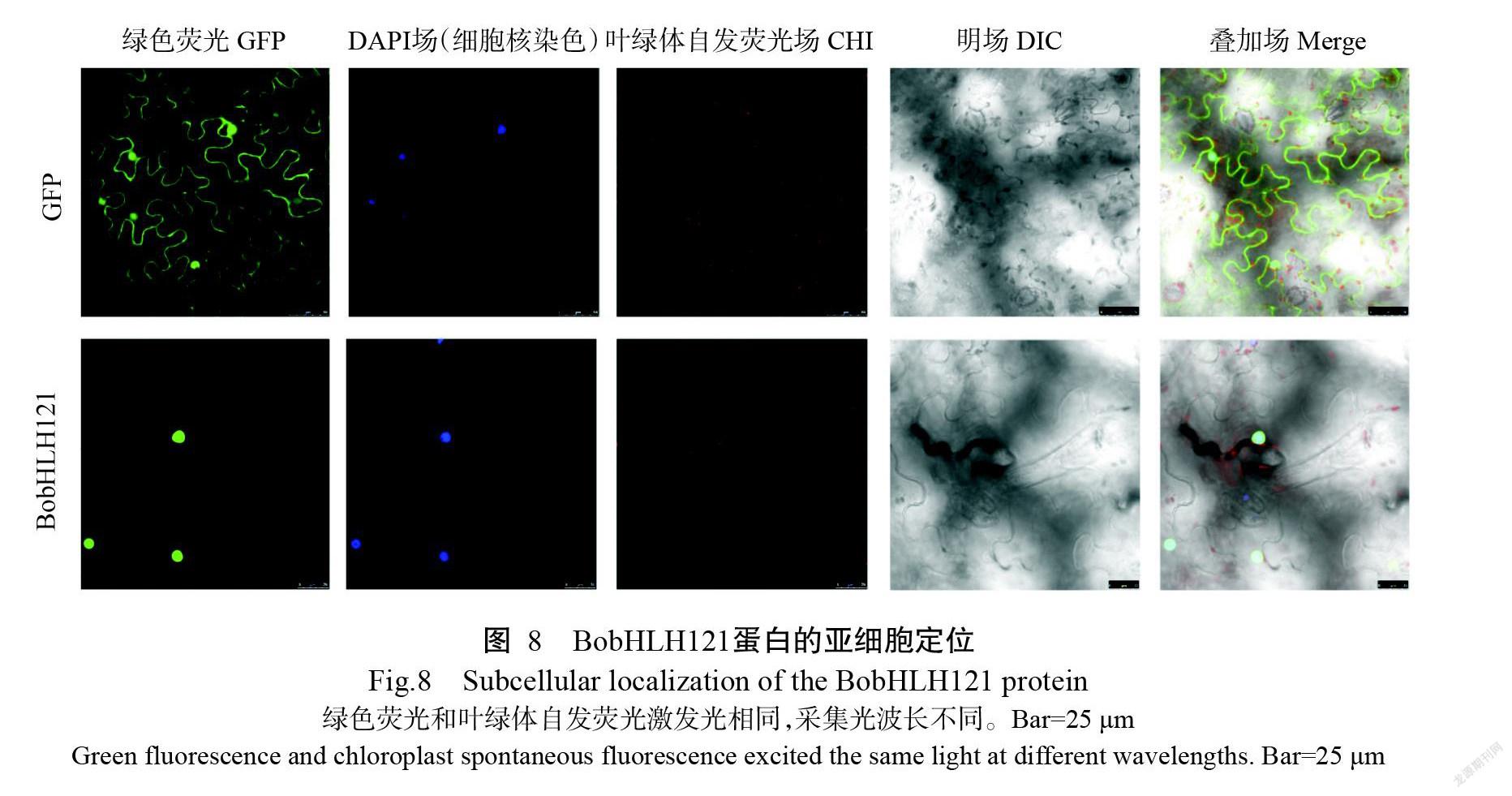
1. 2. 5 亞細胞定位 根據BobHLH121基因序列設計帶有酶切位點的引物(BobHLH121-3-F/Bo-bHLH121-3-R)(表1),以攜帶目的基因序列的克隆載體pMD18-T為模板進行PCR擴增,回收純化目的片段。分別使用Sac I和Xba I酶切帶有熒光蛋白(GFP)基因的質粒載體PCAMBIA2300-GFP和目的片段,然后用T4連接酶連接,構建融合表達載體PCAMBIA2300-GFP-BobHLH121(賀丹等,2021),將其轉化大腸桿菌DH5α感受態細胞,挑取陽性克隆進行測序,測序結果正確的質粒轉化根瘤農桿菌GV3101。將農桿菌菌液注射煙草葉片,暗培養72 h后在激光共聚焦顯微鏡下觀察葉片中熒光信號。
1. 3 統計分析
根據2-ΔΔCt法計算BobHLH121基因的相對表達量。采用GraphPad Prism 5.0整理分析數據及繪圖。
2 結果與分析
2. 1 BobHLH121基因克隆結果
以甘藍葉片DNA為模板進行PCR擴增,結果如圖1所示。BobHLH121基因CDS長度為1367 bp,編碼311個氨基酸殘基。回收目的條帶的測序結果與甘藍基因組數據庫中Bol010854基因CDS的序列完全一致,表明克隆片段為目的基因。
2. 2 染色體定位結果
在甘藍基因組數據庫中搜索BobHLH121基因信息,結果發現該基因定位于C06染色體上(圖2),基因位置信息為C06:16463282-16464648(-),屬于MF2亞組上的反義鏈基因。BobHLH121是個雙拷貝基因,與白菜和擬南芥的同源基因之間具有相同的共線性區塊(圖3)。
2. 3 啟動子順式作用元件分析結果
利用PlantCARE數據庫預測BobHLH121基因的上游2000 bp啟動子區域的順式作用元件,結果(表2)顯示,BobHLH121基因的啟動子區域存在大量的順式作用元件,主要分為植物生長發育、非生物脅迫、激素應答和光響應四種類型。
2. 4 理化性質分析和二級結構預測結果
根據ExPASy在線工具推測BobHLH121蛋白的分子式為C1510H2389N421O494S17,分子量為34.89 kD,理論等電點(pI)為5.42,不穩定系數為52.29,疏水性平均系數為-0.733,說明該蛋白為不穩定的親水性蛋白,且呈酸性。使用SOPMA在線工具預測Bo-bHLH121蛋白的二級結構,結果如圖4所示。Bo-bHLH121蛋白的二級結構比較豐富,主要由α-螺旋(占30.87%)、延伸鏈(占9.32%)、β-轉角(占2.89%)和無規則卷曲(占56.91%)組成,說明α-螺旋和無規則卷曲是該蛋白多肽鏈中主要的結構元件。
2. 5 序列比對及同源分析結果
SMART分析結果顯示,BobHLH121蛋白具有保守的HLH結構域(圖5)。通過NCBI數據庫BLAST搜索BobHLH121蛋白的同源序列,結果發現Bo-bHLH121蛋白與擬南芥(NP_191768.2)、琴葉擬南芥(EFH52923.1)、亞麻薺(XP_01909381.1)、薺菜(XP_023638997.1)、油菜(CDY65446.1)、白菜(XP_009104362.1)和蘿卜(XP_018442860.1)等多種植物bHLH蛋白的氨基酸相似性分別為55.6%、54.8%、52.0%、50.3%、76.4%、73.9%和61.1%(圖6)。由圖7可知,BobHLH121與擬南芥(NP_191768.2)和琴葉擬南芥(EFH52923.1) bHLH蛋白在同一小分支上。
2. 6 亞細胞定位分析結果
Plant-mPLoc、BacelLo和PredictProtein預測結果均顯示,BobHLH121蛋白定位于細胞核中。將PCAMBIA2300-GFP-BobHLH121融合表達載體通過農桿菌介導轉染煙草葉片表皮細胞,從而獲得煙草瞬時表達體系,通過觀察熒光信號發現對照組細胞核和細胞質可見明顯的綠色熒光,處理組僅在煙草表皮細胞的細胞核檢測到綠色熒光信號,即BobHLH121蛋白定位于細胞核中(圖8),表明Bo-bHLH121具有核蛋白的功能。
2. 7 BobHLH121基因組織表達分析結果
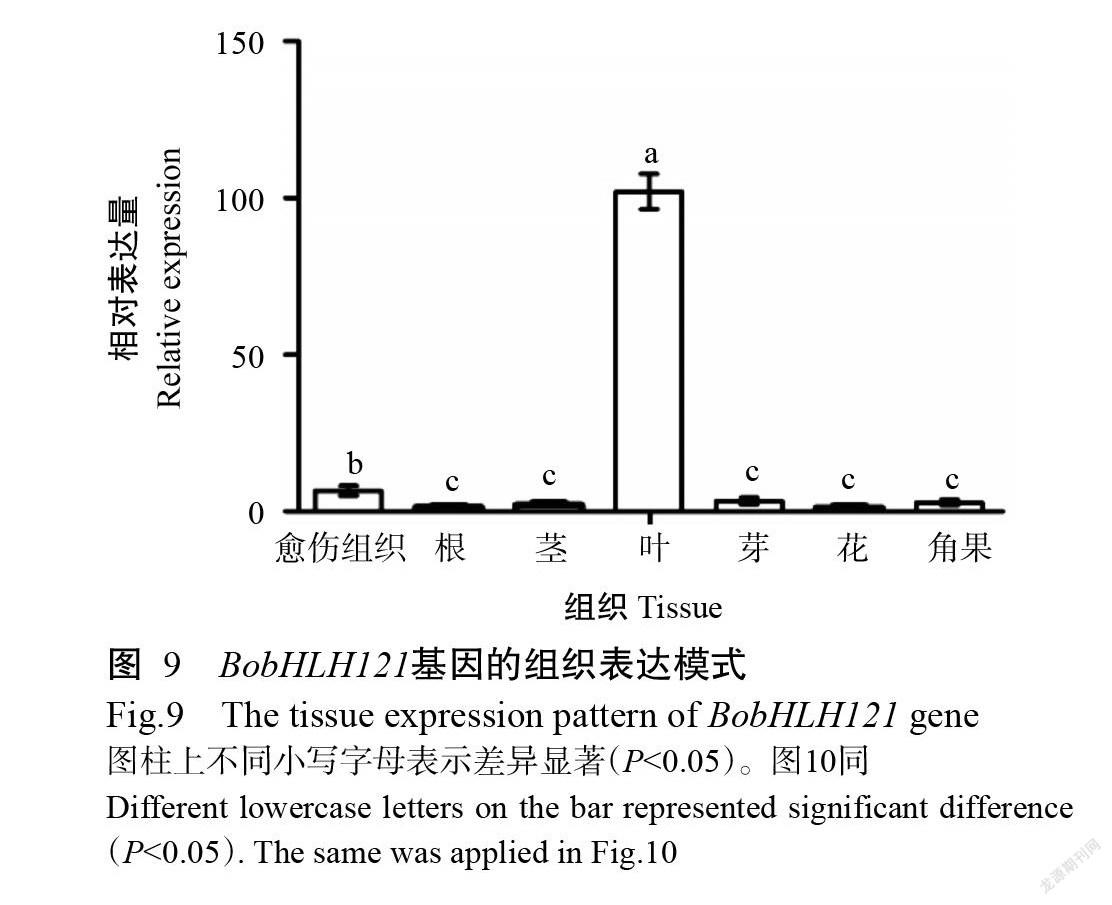
BobHLH121基因在甘藍愈傷組織、根、莖、葉、芽、花和角果中的表達模式如圖9所示。BobHLH121基因在不同組織中的相對表達量存在明顯差異,其中在葉片的相對表達量顯著高于其他組織(P<0.05,下同),在其他組織中的相對表達量均較低,尤其是在花中的相對表達量最低,表明BobHLH121基因可能參與甘藍葉片的生長發育調控。
2. 8 BobHLH121基因在低溫脅迫下的表達分析結果
對BobHLH121基因在低溫脅迫下甘藍幼葉中的表達模式進行分析,結果如圖10所示。低溫脅迫6~12 h時BobHLH121基因的相對表達量較低溫處理0 h(對照)顯著降低,低溫處理24 h時相對表達量急劇升高,顯著高于其他處理時間,低溫處理48 h時又顯著降低,表明BobHLH121基因可能在低溫脅迫下延遲表達,響應24 h才被激活表達。
3 討論
bHLH轉錄因子家族是植物中的第二大轉錄因子家族,在光合作用、光信號轉導、色素生物合成、種子發育和脅迫響應等過程中具有重要的調節作用。有關bHLH轉錄因子的非生物脅迫響應研究在擬南芥(Xiang et al.,2008)、水稻(Liu and Zhou,2018)等模式植物中已廣泛展開,但甘藍中鮮見報道。本研究從甘藍克隆獲得BobHLH121基因CDS全長為1367 bp,其編碼的氨基酸序列中具有HLH保守結構域,是bHLH轉錄因子家族典型的結構特征。HLH保守結構域主要參與結合下游基因中啟動子區域的E-box/G-box順式作用元件。BobHLH121蛋白與擬南芥bHLH家族Ia組蛋白的氨基酸序列相似性較高(Shan et al.,2019)。將BobHLH121與其他植物的bHLH蛋白進行比對及系統進化分析,結果發現Bo-bHLH121與擬南芥和琴葉擬南芥bHLH蛋白聚在一個分支上。BobHLH121蛋白與擬南芥bHLH蛋白(NP_191768.2)的氨基酸相似性分別為55.6%,推測甘藍與擬南芥發生基因分化之后,出現了基因復制和基因丟失的現象,導致基因的多樣化和功能分化。亞細胞定位結果顯示,BobHLH121蛋白定位在細胞核,表明BobHLH121具有核蛋白功能,推測其主要功能是在細胞核中調控下游基因的轉錄水平,進而調控甘藍在低溫脅迫下的響應(劉海霞等,2010;豆玉娟等,2014)。因此,今后深入研究BobHLH121蛋白的生物學功能。
啟動子順式作用元件可調控基因的表達模式(Saeed et al.,2006),且與多種脅迫響應的基因密切相關(Walther et al.,2007;Le et al.,2012)。啟動子位于轉錄起始位點上游的2000 bp片段,對結合靶基因具有重要影響(Fang et al.,2008;Wu et al.,2012)。本研究發現BobHLH121基因的啟動子區域有許多激素應答相關的元件,表明BobHLH121基因可能在脫落酸(ABA)、赤霉素(GA)和茉莉酸甲酯(MeJA)信號通路中發揮積極作用。擬南芥AtICE2基因的啟動子區域存在許多與非生物脅迫相關的順式作用元件,且在低溫響應中發揮重要的作用(Sorensen et al.,2003)。而BobHLH121基因的啟動子區域也包含LTR等低溫響應元件。目前已有大量研究證明,在脅迫條件下,部分bHLH轉錄因子被激活并結合到參與各種信號通路的關鍵基因啟動子上,進而通過調控目的基因的轉錄水平來調節植物的抗逆性(Lu et al.,2017)。例如,擬南芥AtICE1(AtbHLH116)能識別CBF3基因啟動子序列中的MYC位點(CANNTG),誘導CBF3基因的表達,提高擬南芥對低溫脅迫的抗性(Badawi et al.,2008)。Feng等(2012)從蘋果中獲得AtICE1的同源蛋白(MdCIbHLH1),其與DREB家族基因MdCBF2啟動子區域的MYC識別位點結合,導致MdCBF2基因表達上調,從而提高了蘋果的低溫耐性。Nakamura等(2011)研究發現在低溫處理下水稻OsICE1和OsICE2蛋白可誘導轉錄因子基因OsDREB1B和OsHSFA3的表達上調,可調控植株的低溫耐受性。李宇偉等(2012)在蒺藜苜蓿中發現1個低溫響應基因MtbHLH1,在4 ℃低溫脅迫下,不同處理時間的相對表達量具有明顯的差異性。本研究通過熒光定量PCR檢測發現,BobHLH121基因在低溫處理24 h的相對表達量顯著上調,說明BobHLH121基因參與調控低溫脅迫響應,今后應深入研究揭示其低溫響應機制。
4 結論
BobHLH121基因含有bHLH家族典型的HLH保守結構域序列,具有明顯的組織表達特異性,可能參與甘藍葉片的生長發育調控,且響應低溫脅迫,可能在甘藍耐寒性中發揮調控作用。
參考文獻:
豆玉娟,曹飛,馬躍,李賀,劉月學,張志宏. 2014. 栽培草莓果實中特異表達的bHLH78基因的克隆及過量表達載體構建[J]. 分子植物育種,12(3):456-465. [Dou Y J,Cao F,Ma Y,Li H,Liu Y X,Zhang Z H. 2014. Cloning of bHLH78 gene expressed specifically in fruits of cultiva-ted strawberry and construction of overexpression vector[J]. Molecular Plant Breeding,12(3):456-465.] doi:10. 13271/j.mpb.012.000456.
李宇偉,連瑞麗,王新民. 2012. 蒺藜苜蓿低溫脅迫響應基因MtbHLH-1的克隆及功能分析[J]. 中國農業科學,45(16):3430-3436. [Li Y W,Lian R L,Wang X M. 2012. Isolation and functional analysis of the low-temperature-responsive gene MtbHLH-1 in Medicago truncatula[J]. Scientia Agricultura Sinica,45(16):3430-3436.] doi:10. 3864/j.issn.0578-1752.2012.16.024.
劉海霞,康俊根,頡建明,簡元才,丁云花. 2010. 甘藍OguCMS相關的花藥優勢表達轉錄因子BoBHLH1的克隆與表達分析[J]. 園藝學報,37(12):1953-1960. [Liu H X,Kang J G,Xie J M,Jian Y C,Ding Y H. 2010. Cloning and expression of an OguCMS-related anther-preferential transcription factor in Brassica oleracea[J]. Acta Horticulturae Sinica,37(12):1953-1960.] doi:10.16420/j.issn. 0513-353x.2010.12.023.
劉雙,陳沼汀,董昭旭,孫國旭,李暉,關淑艷. 2017. 擬南芥抗寒基因ICE1的克隆及功能分析[J]. 西北農林科技大學學報,45(5):175-182. [Liu S,Chen Z T,Dong Z X,Sun G X,Li H,Guan S Y. 2017. Cloning and functional ana-lysis of Arabidopsis thaliana cold resistance gene ICE1[J]. Journal of Northwest A & F University,45(5):175-182.] doi:10.13207/j.cnki.jnwafu.2017.05.024.
Agarwal M,Hao Y J,Kapoor A,Dong C H,Fujii H,Zheng X W,Zhu J K. 2006a. A R2R3 type MYB transcription factor is involved in the cold regulation of CBF genes and in acquired freezing tolerance[J]. Journal of Biological Chemistry,281(49):37636-37645. doi:10.1074/jbc.M605 895200.
Agarwal P K,Agarwal P,Reddy M K,Sopory S K. 2006b. Role of DREB transcription factors in abiotic and biotic stress tolerance in plants[J]. Plant Cell Reports,25(12):1263-1274. doi:10.1007/s00299-006-0204-8.
Badawi M,Reddy Y V,Agharbaoui Z,Tominaga Y,Danyluk J,Sarhan F,Houde M. 2008. Structure and functional analysis of wheat ICE(inducer of CBF expression) genes[J]. Plant and Cell Physiology,49(8):1237-1249. doi:10.1093/pcp/pcn100.
Brulle F,Bernard F,Vandenbulcke F,Cuny D,Dumez S. 2014. Identification of suitable qPCR reference genes in leaves of Brassica oleracea under abiotic stresses[J]. Eco-toxicology,23(3):459-471. doi:10.1007/s10646-014-1209-7.
Carretero-Paulet L,Galstyan A,Roig-villanova I,Martinez-garcia J F,Bilbao-castro J R,Robertson D L. 2010. Genome-Wide classification and evolutionary analysis of the bHLH family of transcription factors in Arabidopsis,poplar,rice,moss,and algae[J]. Plant Physiology,153(3):1398-1412. doi:10.1104/pp.110.153593.
Chen L,Chen Y,Jiang J F,Chen S M,Chen F D,Guan Z Y,Fang W M. 2012. The constitutive expression of Chrysanthemum dichrum ICE1 in Chrysanthemum grandiflorum improves the level of low temperature,salinity and drought tolerance[J]. Plant Cell Reports,31(9):1747-1758. doi:10.1007/s00299-012-1288-y.
Fang Y J,You J,Xie K B,Xie W B,Xiong L Z. 2008. Systematic sequence analysis and identification of tissue-specific or stress-responsive genes of NAC transcription factor family in rice[J]. Molecular Genetics and Genomics,280(6):547-563. doi:10.1007/s00438-008-0386-6.
Feller A,Machemer K,Braun E L,Grotewold E. 2011. Evolutionary and comparative analysis of MYB and bHLH plant transcription factors[J]. The Plant Journal,66(1):94-116. doi:10.1111/j.1365-313X.2010.04459.x.
Feng X M,Zhao Q,Zhao L L,Qiao Y,Xie X B,Li H F,Yao Y X,You C X,Hao Y J. 2012. The cold induced basic helix-loop-helix transcription factor gene MdCIbHLH1 encodes an ICE-like protein in apple[J]. BMC Plant Bio-logy,12:22. doi:10.1186/1471-2229-12-22.
Gong H X,Rehman J,Tang H Y,Wary K,Mittal M,Chaturvedi P,Zhao Y Y,Komarova Y A,Vogel S M,Malik A B. 2015. HIF2α signaling inhibits adherens junctional disruption in acute lung injury[J]. The Journal of Clinical Investigation,125(3):1364. doi:10.1172/JCI81377.
Gonzalez A,Zhao M Z,Leavitt J M,Lloyd A M. 2008. Regulation of the anthocyanin biosynthetic pathway by the TTG1/bHLH/Myb transcriptional complex in Arabidopsis seedlings[J]. The Plant Journal,53(5):814-827. doi:10. 1111/j.1365-313X.2007.03373.x.
Goossens J,Mertens J,Goossens A. 2017. Role and functioning of bHLH transcription factors in jasmonate signalling[J]. Journal of Experimental Botany,68(6):1333-1347. doi:10.1093/jxb/erw440.
Guo X J,Wang J R. 2017. Global identification,structural analysis and expression characterization of Bhlh transcription factors in wheat[J]. BMC Plant Biology,17:90.
Hichri I,Barrieu F,Bogs J,Kappel C,Delrot S,Lauvergeat V. 2011. Recent advances in the transcriptional regulation of the flavonoid biosynthetic pathway[J]. Journal of Experimental Botany,62(8):2465-2483. doi:10.1093/jxb/erq442.
Kurbidaeva A,Novokreshchenova M,Ezhova T. 2015. ICE genes in Arabidopsis thaliana:Clinal variation in DNA polymorphism and sequence diversification[J]. Biologia Plantarum,59(2):245-252. doi:10.1007/s10535-015-0497-y.
Le D T,Nishiyama R,Watanabe Y,Vankova R,Tanaka M,Seki M,Harm L H,Yamaguchi-Shinozaki K,Shinozaki K,Tran L S P. 2012. Identification and expression analysis of cytokinin metabolic genes in soybean under normal and drought conditions in relation to cytokinin levels[J]. PLoS One,7(8):e42411. doi:10.1371/journal.pone.0042411.
Li F,Guo S Y,Zhao Y,Chen D Z,Chong K,Xu Y Y. 2010. Overexpression of a homopeptide repeat-containing bHLH protein gene(OrbHLH001) from Dongxiang wild rice confers freezing and salt tolerance in transgenic Arabidopsis[J]. Plant Cell Reports,29(9):977-986. doi:10. 1007/s00299-010-0883-z.
Li X X,Duan X P,Jiang H X,Sun Y J,Tang Y P,Yuan Z,Guo J K,Liang W Q,Chen L,Yin J Y,Ma H,Wang J,Zhang D B. 2006. Genome-wide analysis of basic/helix-loop-helix transcription factor family in rice and Arabidopsis[J]. Plant Physiology,141(4):1167-1184. doi:10. 1104/pp.106.080580.
Liu Y K,Zhou J. 2018. Mapping kinase regulation of ICE1 in freezing tolerance[J]. Trends Plant Science,23(2):91-93. doi:10.1016/j.tplants.2017.12.002.
Lu Y,Yang L,Yu M Y,Lai J B,Wang C,McNeil D,Zhou M X,Yang C W. 2017. A novel Zea mays ssp. mexicana L. MYC-type ICE-like transcription factor gene ZmmICE1 enhances freezing tolerance in transgenic Arabidopsis tha-liana[J]. Plant Physiology and Biochemistry,113:78-88. doi:10.1016/j.plaphy.2017.02.002.
Man L L,Xiang D J,Wang L N,Zhang W W,Wang X D,Qi G C. 2017. Stress-responsive gene RsICE1 from Raphanus sativus increases cold tolerance in rice[J]. Protoplasma,254(2):945-956. doi:10.1007/s00709-016-1004-9.
Mao K,Dong Q L,Li C,Liu C H,Ma F W. 2017. Genome-wide identification and characterization of apple bHLH transcription factors and expression analysis in response to drought and salt stress[J]. Frontiers in Plant Science,8:480. doi:10.3389/fpls.2017.00480.
Miura K,Furumoto T. 2013. Cold signaling and cold response in plants[J]. International Journal of Molecular Sciences,14(3):5312-5337. doi:10.3390/ijms14035312.
Nakamura J,Yuasa T,Huong T T,Harano K,Tanaka S,Iwata T,Phan T,Iwaya M. 2011. Rice homologs of inducer of CBF expression(OsICE) are involved in cold acclimation[J]. Plant Biotechnology,28(3):303-309. doi:10.5511/plantbiotechnology.11.0421a.
Pires N,Dolan L. 2010. Origin and diversification of basic-helix-loop-helix proteins in plants[J]. Molecular Biology and Evolution,27(4):862-874. doi:10.1093/molbev/msp288.
Saeed A I,Bhagabati N K,Braisted J C,Liang W,Sharov V,Howe E A,Li J W,Thiagarajan M,White J A,Quackenbush J. 2006. TM4 microarray software suite[J]. Methods in Enzymology,411:134-193. doi:10.1016/S0076-6879(06)11009-5.
Shan X,Zhang W,Yu F W,Wang S Y,Li J B,Tang J,Dai Z L. 2019. Genome-wide analysis of basic helix-loop-helix superfamily members reveals organization and chilling-responsive patterns in Cabbage(Brassica oleracea var. ca-pitata L.)[J]. Genes,10(11):914. doi:10.3390/genes1011 0914.
Song X M,Huang Z N,Duan W K,Ren J,Liu T K,Li Y,Hou X L. 2014. Genome-wide analysis of the bHLH transcription factor family in Chinese cabbage(Brassica rapa ssp. pekinensis)[J]. Molecular Genetics and Geno-mics,289(1):77-91. doi:10.1007/s00438-013-0791-3.
Sorensen A M,Kr?ber S,Unte U S,Huijser P,Dekker K,Saedler H. 2003. The Arabidopsis ABORTED MICROSPORES(AMS) gene encodes a MYC class transcription factor[J]. The Plant Journal,33(2):413-423. doi:10.1046/ j.1365-313X.2003.01644.x.
Sun H,Fan H J,Ling H Q. 2015. Genome-wide identification and characterization of the bHLH gene family in tomato[J]. BMC Genomics,16(1):9. doi:10.1186/s12864-014-1209-2.
Takahashi Y,Ebisu Y,Shimazaki K. 2017. Reconstitution of abscisic acid signaling from the receptor to DNA via bHLH transcription factors[J]. Plant Physiology,174(2):815-822. doi:10.1104/pp.16.01825.
Toledo-Ortiz G,Huq E,Quail P H. 2003. The Arabidopsis basic/helix-loop-helix transcription factor family[J]. The Plant Cell,15(8):1749-1770. doi:10.1105/tpc.013839.
Walther D,Brunnemann R,Selbig J. 2007. The regulatory code for transcriptional response diversity and its relation to genome structural properties in A. thaliana[J]. PLoS Genetics,3(2):e11. doi:10.1371/journal.pgen.0030011.
Wang J Y,Hu Z Z,Zhao T M,Yang Y M,Chen T Z,Yang M L,Yu W G,Zhang B L. 2015. Genome-wide analysis of bHLH transcription factor and involvement in the infection by yellow leaf curl virus in tomato(Solanum lycopersicum)[J]. BMC Genomics,16(1):39. doi:10.1186/s12864-015-1249-2.
Wu J,Peng Z,Liu S Y,He Y J,Cheng L,Kong F L,Wang J,Lu G. 2012. Genome-wide analysis of Aux/IAA gene fami-ly in Solanaceae species using tomato as a model[J]. Molecular Genetics and Genomics,287:295-311. doi:10. 1007/s00438-012-0675-y.
Xiang D J,Hu X Y,Zhang Y,Yin K D. 2008. Over-expression of ICE1gene in transgenic rice improves cold toleran-ce[J]. Rice Science,15(3):173-178. doi:10.1016/S1672-6308(08)60039-6.
(責任編輯 陳 燕)

