發酵條件對畢赤酵母高密度表達地特胰島素前體DesB30的影響
鄭華亮,賈小峰,馬魯南,劉 忠,張貴民
(山東新時代藥業有限公司 山東省蛋白類藥物工程實驗室,山東 臨沂 273400)
2017年國際糖尿病聯盟發布的第8版糖尿病概覽數據顯示,我國糖尿病(20~79歲)患病人數達到了1.14億[1],糖尿病已成為繼心血管疾病和癌癥之后,嚴重危害我國人民健康的三大疾病之一[2]。人胰島素分短效、中效和長效三類,目前市場上應用于臨床的長效胰島素有甘精胰島素、地特胰島素等。地特胰島素由丹麥諾和諾德公司研制,于2004年在歐洲上市。地特胰島素是第一個采用化學修飾方法獲得的胰島素類似物,即將天然人胰島素分子B鏈上的第30位蘇氨酸去掉,通過酰化反應在第29位賴氨酸上結合一個C14游離脂肪酸[3],C14游離脂肪酸可以與血液中的白蛋白結合,形成蛋白結合體,從而延長作用時間[4-5]。目前,國際市場僅有原研藥諾和諾德上市,2019年銷售收入15.4億美元,國內地特胰島素只有幾家藥企處于申報階段,且普遍存在表達量低、表達的胰島素前體容易形成包涵體等問題。
近年來,以低等真核生物酵母作為表達系統表達外源蛋白越來越被廣泛研究和應用。與大腸桿菌相比,酵母表達的蛋白質可以進行翻譯后加工、修飾以及合理的空間折疊,能有效克服大腸桿菌系統缺乏蛋白相關修飾的不足[6]。1983年,Wegner[7]為克服釀酒酵母的局限,開發了以畢赤酵母甲醇營養型酵母為代表的第二代酵母表達系統。畢赤酵母由于醇氧化酶(AoXl)基因的強啟動子,特別適合于外源基因的調控表達[8],采用這個系統成功表達了200種以上蛋白,包括病毒、細菌、真菌、動植物和某些人源蛋白[9]。在甲醇畢赤酵母表達系統中,受不同蛋白氨基酸組成以及空間結構差異等因素影響,其最優表達條件不同,在發酵過程中,pH、溫度、溶氧、甲醇誘導量和誘導前菌體濃度都可能對蛋白表達有很大影響[10-13]。
因此,本文中,筆者嘗試采用酵母表達系統分泌表達胰島素前體,以帶有編碼地特胰島素前體DesB30基因的甲醇營養型重組畢赤酵母為實驗菌株,使用5 L玻璃發酵罐進行培養條件的優化,考察pH、溫度、誘導前菌體濃度和甲醇流加速度對地特胰島素前體DesB30蛋白表達的影響,擬通過優化發酵條件得到高表達可溶性的目的蛋白。
1 材料與方法
1.1 菌株
畢氏酵母(Pichiapastoris)GS115菌株,載體為pPIC9K(分泌性表達載體),信號肽來自釀酒酵母的α-雜交因子。重組人胰島素源類似物HMPIDesB30基因根據酵母密碼子的偏好性人工合成。按照Multi-copyPichiaexpression Ki(Version B)經SalⅠ酶切,用電轉化方法將重組質粒HMPIDesB30/pPIC9K轉入畢赤酵母GS115中,隨后通過組氨酸缺陷培養基以及G418抗性培養基篩選具有外源基因高拷貝數的菌株,整個實驗操作參考畢赤酵母表達實驗手冊。構建的菌株保存于山東新時代藥業有限公司。
1.2 培養基
YPD種子培養基(g/L):葡萄糖20.0,蛋白胨20.0,酵母粉10.0。
發酵罐培養基(BSM)(1 L):85%H3PO426.7 mL,CaSO40.93 g,K2SO418.2 g,MgSO4·7H2O 14.9 g,KOH 4.13 g,甘油40 g,PTM1微量元素溶液12 mL[14]。
補料培養基:質量分數50%甘油,每1 000 mL含有12 mL PTM1微量元素溶液。
PTM1(1 L):CuSO4·5H2O 6.0 g,KI 0.08 g,MnSO4·H2O 3.0 g,Na2MoO40.2 g,H3BO30.02 g,CoCl20.5 g,ZnSO420.0 g,FeSO4·7H2O 65.0 g,VH(生物素)0.2 g,H2SO45.0 mL。
1.3 方法
1.3.1 搖瓶種子培養
從平板上挑取單菌落接種至100 mL YPD培養基的搖瓶中,30 ℃、200 r/min培養過夜至OD600為5.0左右。
1.3.2 發酵罐培養
將搖瓶種子液按照體積分數4%接種量接入到裝有2 L發酵罐培養基的五聯裝5 L玻璃發酵罐中,每升培養基添加4.35 mL PTM1微量元素溶液,用氨水調初始pH至5.0。當甘油耗盡,溶氧快速回升到80%以上后,開始補加質量分數50%甘油,流加速度為18.15 mL/(h·L)(以初始發酵體積計)。甘油補料結束后,待溶氧快速回升后調到合適的pH和誘導溫度。隨后補加甲醇進行誘導。開始保持低速流加甲醇,之后緩慢提高甲醇補加速度,根據Invitrogen公司提供的方法,補加速度最終提升至10.9 mL/(h·L),并保持至發酵結束,發酵時間為128 h左右。通過調節轉速、罐壓、空氣流量使溶氧大于10%。甲醇誘導期間取樣檢測,測定菌體濃度(以菌體濕質量表示),離心收集上清液并進行蛋白濃度測定。在此基礎上分別對誘導pH、誘導溫度、誘導前菌體質量濃度和甲醇補速進行單因素實驗優化。
1.3.3 細胞濕質量
取40 mL發酵液,12 000 r/min 離心10 min,去上清液,稱菌體質量。
1.3.4 目的蛋白DesB30濃度測定
發酵液12 000 r/min離心,上清液用鹽酸調pH至4.0,經0.45 μm膜過濾后進行HPLC(島津公司)分析,色譜柱為C18。流動相A(5%乙睛,0.1%三氟乙酸),流動相B(95%乙睛,0.1%三氟乙酸)。洗脫條件:先用流動相A平衡柱子,洗脫條件為30 min流動相B從0~100%,流速1 mL/min,柱溫40 ℃[15]。蛋白含量計算見式(1)。
發酵液蛋白濃度=發酵液上清液峰面積/標準品峰面積×標準品蛋白濃度
(1)
2 結果與討論
2.1 pH對DesB30表達的影響
由于畢赤酵母可耐受較寬的pH(pH 3.0~7.0),因此可以通過優化 pH 條件來提高目的蛋白的表達量。為了確定DesB30表達最適的pH條件,在誘導溫度為25 ℃、誘導前菌體質量濃度280 g/L培養條件下,選擇pH 5.5、6.0、6.5和7.0不同梯度進行優化,結果如圖1所示。由圖1(a)發酵結果可知:在不同pH條件下,誘導前期和誘導后期的生物量相差不大,生長趨勢幾乎無差別,說明pH對菌體的生長影響較小,發酵后期濕菌體質量濃度均能達到500 g/L左右。

圖1 不同pH對菌體濕質量和DesB30表達的影響Fig.1 Effects of pH on wet weight of bacteria and DesB30
在不同pH誘導條件下,誘導24 h后,經HPLC檢測,DesB30已有少量表達。在pH 6.0和pH 6.5條件下,DesB30表達相差不大,具有較高的表達量。與pH 6.0和pH 6.5條件下的表達量相比,pH 5.5和pH 7.0條件下的表達量在誘導24 h后至發酵結束這一階段明顯降低(圖1(b))。中性條件pH 7.0并不是蛋白表達的最適條件,因此,DesB30在中性條件下表達量很低,DesB30的等電點pI為5.5,在pH 5.5的條件下,DesB30的表達量偏低,可能是由于DesB30在等電點附近時目的蛋白溶解度較低,一部分蛋白分泌到上清液后沉淀出來造成單位偏低。綜上,DesB30最適的表達pH為6.0~6.5,偏中性或者偏酸性都不利于目的蛋白的表達。
2.2 誘導溫度對DesB30表達的影響
通過pH單因素實驗發現DesB30最適表達條件為pH 6.0~6.5。選取誘導表達pH為6.0、誘導前菌體質量濃度280 g/L條件下,分別設置22、24、26、28和30 ℃這5個溫度梯度,以考察溫度對酵母工程菌的生長狀況和DesB30表達量的影響,結果如圖2所示。由圖2可知:在22、24和26 ℃這3個溫度條件下,菌體生長狀態相似,生物量相差不大;在誘導48 h前,28和30 ℃這2個溫度條件下的菌體生長狀態與22、24和26 ℃這3個溫度條件下的生長狀態相似,但是在48 h以后,28和30 ℃這2個溫度條件下的菌體生長明顯變慢,并且96 h以后上清液變混濁,推測是在較高的溫度條件下菌體生長過快,在誘導過程中由于受到甲醇補速的限制,碳源供應不足,影響了工程菌的生長,造成菌體部分自溶。
在誘導60 h前,在22、24、26和28 ℃條件下,DesB30表達量相差不大。誘導60 h后,22、24和26 ℃條件下的DesB30表達量明顯更高,到發酵后期,3個溫度條件下表達量相差不大。在22 ℃條件下,誘導表達104 h后表達量達到最大,而在24和26 ℃條件下,誘導表達128 h后表達量還有繼續增長的趨勢。考慮到發酵過程中較低的溫度不易控制,選取26 ℃作為最合適的誘導溫度。
DesB30為分泌性表達,在28和30 ℃條件下誘導時,由于菌體部分自溶,蛋白酶釋放到上清液中,造成蛋白降解。因此,過高的溫度不利于蛋白的積累,而過低的溫度又影響了菌體的生長,隨著發酵過程的進行,甲醇容易積累,毒害菌體,后期培養條件不再適合菌體發酵,也不利于蛋白的積累,因此在實際發酵中盡量控制合適的溫度。
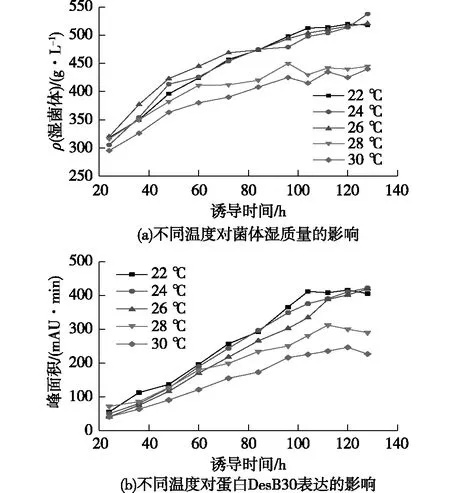
圖2 不同溫度對菌體濕質量和DesB30 表達的影響Fig.2 Effects of temperature on wet weight of bacteria and DesB30
2.3 誘導前菌體濃度對DesB30表達的影響
為了考察誘導前菌體濃度對DesB30表達的影響,在誘導pH為6.0、誘導溫度26 ℃條件下,筆者選取了誘導前菌體質量濃度分別為120、200和280 g/L 3個條件,結果如圖3所示。由圖3可知:誘導前菌體質量濃度為120 g/L時,誘導后菌體質量濃度相比于誘導前200和280 g/L的菌體質量濃度一直偏小。這表明誘導前菌體濃度太低的情況下,在相同甲醇補速條件下,甲醇濃度偏高,對菌體的毒害作用影響了菌體生長,進而影響了DesB30的表達。當誘導前菌體質量濃度200 g/L時,誘導之后生長比280 g/L時的更快,這可能是誘導前太高的菌體濃度,而甲醇補料不足導致碳源不足,使菌體生長受限,蛋白表達受影響;到后期菌體進入平臺期,兩者菌體濃度相差不大。在誘導表達50 h前,3個誘導條件下,DesB30的表達區別不大;但在誘導表達60 h后,誘導前菌體質量濃度200 g/L時的DesB30表達量比另外兩個條件下的表達量更大,這表明合適的誘導前菌體濃度對蛋白表達具有很大影響。由此確定200 g/L為最適的誘導前菌體質量濃度。
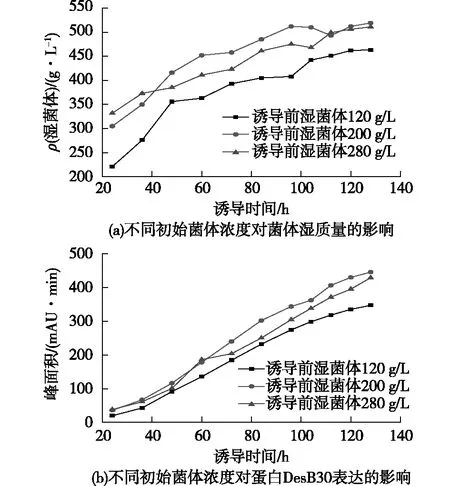
圖3 不同初始菌體濃度對菌體濕質量和DesB30 表達的影響Fig.3 Effects of initial concentration on wet weight of bacteria and DesB30
2.4 甲醇流加速度對DesB30表達的影響
在誘導pH為6.0、誘導溫度26℃、誘導前菌體質量濃度200 g/L條件下,繼續考察甲醇流加補速對DesB30表達的影響。根據Invitrogen公司提供的方法,選取甲醇終誘導補速分別為10.9、16.3和21.8 mL/(h·L)3個條件,結果如圖4所示。由圖4可知:甲醇流加速度越大,菌體濃度越高,生長越旺盛,培養后期受各種條件影響,菌體生長進入平臺期。在誘導前期,由于甲醇補速是逐漸增加的,在誘導40 h前,DesB30表達量相差不大;而在誘導40 h后,甲醇補速越大,DesB30表達量越大。由此可見,提高甲醇流加速率使發酵液中的甲醇濃度維持在較高水平,有利于DesB30的表達。但在誘導100 h后,較高的甲醇流加速率已造成細胞損傷,菌體濃度開始降低,逐漸進入衰亡期。另外,在實驗中發現,在較高的甲醇補速條件下,細胞代謝甲醇需要更多氧氣,受發酵罐條件限制,無法維持合適的溶氧水平,因此在誘導過程中合適的甲醇補速對細胞生長和蛋白表達至關重要。在誘導過程中,較高的甲醇補速致使菌體生長越旺盛,產熱嚴重,耗氧增加,對發酵罐的要求較高,而且甲醇終補速為16.3和21.8 mL/(h·L)條件下,誘導后期DesB30表達量相差不大。因此,綜合各種條件及考慮成本因素,確定甲醇終流加補速16.3 mL/(h·L)為最適條件。
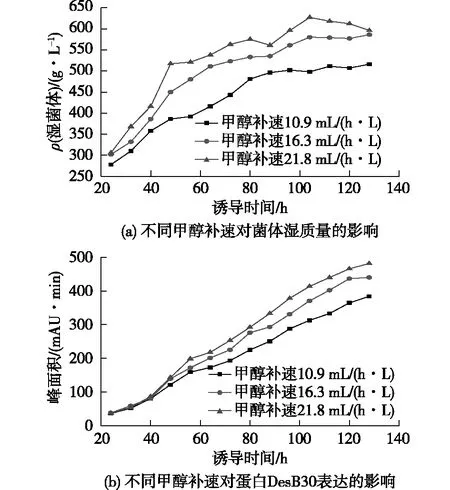
圖4 不同甲醇補速下對菌體濕質量和DesB30 表達的影響Fig.4 Effects of different methanol flow rate on wet weight of bacteria and DesB30
2.5 優化條件下的發酵結果
在上述優化的發酵條件下,使用5 L玻璃發酵罐進行發酵實驗。在30 ℃、pH 5.0培養條件下消耗基礎培養基,待培養基中甘油消耗完畢后補料50%甘油,補料結束后調溫度至26 ℃,pH至6.5,0.5 h后甲醇誘導,15 h內將甲醇補速提至16.3 mL/(h·L),發酵過程中將溶氧控制在15%以上,直至發酵結束。發酵結束時,下罐DesB30表達量能夠達到2.5 g/L左右。彭強強等[16]利用一株重組畢赤酵母,通過優化的培養工藝,在5 L反應器水平發酵生產人胰島素前體,108 h后產量達到1.85 g/L。與彭強強等[16]研究結果相比,本研究的DesB30表達量高出35%左右,具有明顯的提升,說明本研究優化的條件更能利于DesB30的表達。
3 結論
畢赤酵母具有能夠高效表達并有效分泌胞外蛋白、生產成本低等優點,普遍用于重組蛋白商業生產。在本研究中,筆者通過畢赤酵母成功地表達了地特胰島素前體DesB30,并通過單因素實驗,初步確定了DesB30蛋白的最優表達條件:誘導pH為6.0~6.5,誘導溫度26 ℃,誘導前菌體質量濃度200 g/L,甲醇終補速16.3 mL/(h·L)。在優化的發酵條件下,5 L玻璃發酵罐中DesB30表達量能夠達到2.5 g/L左右。
單因素試驗能確定DesB30各種發酵因素的最佳發酵條件,但各因素之間可能存在交互作用,后續還需通過中心復合實驗確定各因素之間最優的比例。另外在實驗中發現,這種固定的甲醇誘導補料方式在發酵后期存在甲醇補料不足的問題,影響菌體正常生長,需要根據生長狀況和蛋白表達情況及時調整甲醇流加速率。本結果對下一步利用大型發酵罐進行重組畢赤酵母發酵有借鑒作用,從而為DesB30大規模工業生產提供實驗基礎。

