巖藻寡糖的制備及其抗氧化與益生活性
曹聲生,朱本偉,高 翔,王劍朋,杜媛媛,周婉婷,姜進舉,周明柱,姜 帥
(1.南京工業大學 食品與輕工學院,江蘇 南京 211800;2.青島明月海藻集團有限公司,山東 青島 266400;3.宿遷市南京工業大學新材料研究院,江蘇 宿遷 223800)
巖藻多糖是一種天然雜多糖,是海帶(Laminariajaponica)、裙帶菜(UndariapinnatifidaSuringar)等大型褐藻門植物細胞間組織的主要成分,其結構上是由L-巖藻糖作為主鏈骨架,并通過1,2或者1,3及1,4糖苷鍵與其他多種糖殘基(甘露糖、鼠李糖、葡萄糖醛酸和木糖等)及硫酸基結合形成[1]。研究發現,巖藻多糖具有多種生物活性:Silva等[2]發現來源于Padinagymnospora的巖藻多糖具有顯著的抗凝血活性,其結構中的4-α-L-巖藻糖單元C3位置的硫酸酯含量對其抗凝血活性具有重要作用;Rocha等[3]研究發現,來源于Spatoglossumschroederi的巖藻多糖在體外實驗中未表現出抗凝血活性,但是在形成血栓的動物模型中卻表現出顯著的抗血栓形成作用。硫酸化的多糖例如巖藻多糖、卡拉膠等在實驗中都表現出了抗病毒活性:Hayashi等[4]研究發現來源于Undariapinnatifida的巖藻多糖可以抑制單純皰疹病毒(HSV)的增殖,并能增強其免疫功能來抵御HSV病毒的侵染;Hidari等[5]研究發現巖藻多糖可以有效抑制登革熱Ⅱ型病毒的侵染,通過與DEN2顆粒進行特異性地結合來達到抑制病毒與細胞合體的形成。此外,巖藻多糖還表現出顯著的抗腫瘤活性:Alekseyenko等[6]發現巖藻多糖可以有效抑制小鼠肺腺癌細胞的轉移;Hyun等[7]研究發現,利用巖藻多糖處理HCT-15結腸癌細胞后,部分細胞出現DNA斷裂等細胞凋亡現象,可有效抑制結腸癌細胞的生長和轉移。另外,巖藻多糖還具有多種免疫調節活性:Tissot等[8]研究證實巖藻多糖可以抑制正常人血清中的補體蛋白,以此來抑制細胞中補體的激活;Mizuno等[9]發現巖藻多糖可以刺激RAW264.7細胞產生腫瘤壞死因子,從而抑制細胞中白介素mRNA的表達。
綜上,巖藻多糖具有多種生物活性,受到了越來越多的來自于藥物研發、功能食品開發等領域研究者的重視與關注,但是有關巖藻多糖益生等活性的研究卻鮮有報道。此外,巖藻多糖存在分子量大、吸收性差、難以通過血腦屏障及吸收率低等缺點,其應用受到了一定限制[10]。作為巖藻多糖的降解產物,巖藻寡糖(FOS)具有分子量小、水溶性和吸收性好、生物利用度高等多種巖藻多糖所不具備的優點,克服了多糖在應用過程中受到的種種限制,在功能食品開發、新型保健品開發等領域具有很好的應用前景。因此,通過適當的方法將巖藻多糖的分子量降低,將其降解成小分子的寡糖是目前巖藻多糖及其產品開發亟待解決的問題。
本研究中,筆者以巖藻多糖為原料,采用酶法降解的方式制備了不同聚合度的巖藻寡糖混合物,通過電噴霧質譜對其結構進行表征,并采用多種方法對降解得到的巖藻寡糖的抗氧化及益生活性進行研究,以期為巖藻多糖資源的開發奠定基礎。
1 材料與方法
1.1 材料與試劑
巖藻多糖(來源于海帶Laminariajaponicia),山東結晶集團;ABTS+·、DPPH·,美國Sigma公司;透析袋(分子量100),索萊寶公司;植物乳桿菌(Lactobacillusplantarum,BIO-097551)和嗜酸乳桿菌(Lactobacillusacidophilus,BIO-099454),中國工業微生物菌種保藏中心;巖藻多糖降解酶,實驗室自制;無水乙醇、濃H2SO4、苯酚、水楊酸、丙酮、石油醚、NaCl、氯仿、正丁醇和抗壞血酸等化學試劑均為市售分析純。
1.2 儀器與設備
Wtherm-B5型開口加熱循環浴槽、C410型防腐蝕隔膜真空泵,德國Wiggens公司;Scientz-18N型壓蓋型冷凍干燥機,寧波新芝生物科技公司;Allegra64R型高速臺式冷凍離心機,美國貝克曼公司;Ultrospec 7000型紫外可見光分光光度計,美國GE公司;LTQ XL線性離子阱質譜分析儀,美國賽默飛公司。
1.3 實驗方法
1.3.1 巖藻寡糖的酶法制備
稱取20 g巖藻多糖,溶于2 L去離子水中,加入適量巖藻多糖降解酶進行水解反應,反應溫度為30 ℃,反應48 h后,用二硝基水楊酸(DNS)法測定不同反應時間的還原糖含量[11],將反應體系加熱到100 ℃來終止反應。將反應得到的產物冷凍干燥,得到巖藻寡糖粉末。
1.3.2 巖藻寡糖的電噴霧質譜分析
取少量降解得到的寡糖,用透析袋除去里面的無機鹽等小分子雜質,凍干后得到樣品,溶于水和乙腈1∶ 1體積比的混合液中,得到樣品液,取2 mL,用LTQ XL線性離子阱質譜分析儀對樣品進行負離子模式分析,條件如下:電源電壓4.5 kV,毛細管溫度275~300 ℃,管內電壓250 V,鞘內氣體30 AU。掃描范圍150~2 000m/z。
1.3.3 巖藻寡糖的體外抗氧化活性分析
1)ABTS+·清除能力計算。參照文獻[12]中的方法,將7.0 mmol/L ABTS+·溶液和2.45 mmol/L過硫酸鉀溶液等體積混合,室溫條件下避光反應16 h,用磷酸鹽(PBS)緩沖液(pH 7.4)稀釋25倍,使其在734 nm處吸光值為0.700±0.050,即得ABTS+·工作液。取不同質量濃度(0.2、0.4、0.6、1、2、4、8和10 mg/mL)的寡糖溶液0.2 mL,加入0.8 mL ABTS+·工作液,振搖充分混合,避光靜置15 min后,在734 nm波長處測定吸光值,每組實驗做3個平行,以相同濃度梯度的維生素C作為對照。計算見式(1)。

(1)
式中:A1為樣品反應后的吸光值;A2為ABTS+·工作液由等體積的PBS緩沖液代替的吸光值;A0為樣品溶液由等體積純水代替的吸光值。
2)DPPH·清除能力計算。參照文獻[13]中的方法,吸取1.0 mL不同濃度的巖藻寡糖溶液,加入 1.0 mL的0.2 mmol/L 的DPPH·乙醇溶液,充分混勻后在室溫下避光反應,分別在0.5、6和12 h后測定波長515 nm處的吸收值,每組實驗做3個平行。計算見式(2)。

(2)
式中:A1′為樣品反應后的吸光值;A2′為DPPH·溶液由等體積的無水乙醇溶液代替的吸光值;A0′為樣品溶液由等體積純水代替的吸光值。以巖藻寡糖濃度與對應的清除率做顯性回歸方程,以此計算清除率為50%時的寡糖濃度,即為半清除濃度IC50。
3)·OH清除能力計算。按照文獻[14]中的方法,在4 mL離心管內依次加入0.25 mL 9 mmol/L FeSO4溶液,0.25 mL 9 mmol/L 水楊酸-乙醇溶液,3 mL不同濃度(0.2、0.4、0.6、1、2、4、8、10 mg/mL)的寡糖溶液和0.25 mL 8.8 mmol/L H2O2溶液,充分混勻后在室溫下靜置1 h,然后在510 nm處測定吸光值,每組實驗平行3次,以相同濃度梯度的維生素C作為對照。計算見式(3)。
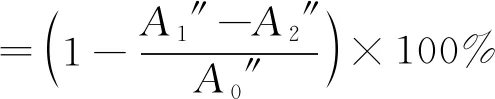
(3)
式中:A1″為樣品反應后的吸光值;A2″為不加H2O2改由等體積純水代替的吸光值;A0″為樣品溶液由等體積純水代替的吸光值。以巖藻寡糖濃度與對應的清除率做顯性回歸方程,以此計算清除率為50%時的寡糖濃度,即為半清除濃度IC50。
1.3.4 巖藻寡糖的益生活性分析
參照文獻[15]中的方法,將植物乳桿菌(Lactobacillusplantarum)和嗜酸乳桿菌(Lactobacillusacidophilus)分別接入MRS液體培養基,37 ℃(嗜酸乳桿菌需厭氧)培養48 h,之后經兩次轉管復壯后備用。配制MRS液體培養基(不加葡萄糖),調節pH至6.8。分別稱取50 mg的葡萄糖(glucose)和巖藻寡糖,加入菌種瓶中,每個樣品做一組平行對照(blank)。然后將配制好的液體培養基分裝入瓶中,分裝體積為5 mL,這樣培養基中碳水化合物(即糖含量)的質量分數為1%。另外,用不加糖的培養基作為對照組。將培養基在121 ℃滅菌20 min,冷卻后接入200 μL復壯好的植物乳桿菌和嗜酸乳桿菌菌種,37 ℃(嗜酸乳桿菌需厭氧)培養,每隔2 h測一次OD值,繪制菌的生長曲線。
1.4 數據統計分析
分析結果以平均值±標準偏差(Mean ± SD)表示,采用SPSS 13.0軟件對數據統計,每組實驗設置3個平行實驗。
2 結果與討論
2.1 巖藻寡糖的制備與結構鑒定
2.1.1 巖藻多糖水解的還原糖曲線
為了監測巖藻多糖水解過程進行的程度,采用DNS法測定反應體系中不同時間的還原糖含量,并以此繪制了巖藻多糖的降解曲線,結果如圖1所示。由圖1可知:在反應的初始階段,還原糖的含量迅速上升,當反應時間為10 h時,反應體系中的還原糖達到24 mg/mL;隨著反應時間的進一步延長,反應體系中的還原糖含量趨向于穩定,當反應進行到48 h后,測得反應體系中的還原糖為27 mg/mL。

圖1 巖藻多糖降解過程中的還原糖曲線Fig.1 The curve of reducing sugars during the degradation procedure of fucoidan
2.1.2 巖藻寡糖的結構鑒定
采用電噴霧質譜對降解得到的寡糖產物進行鑒定,結果如圖2所示。由圖2可知:寡糖混合物中主要包括單硫酸化([Fuc1SO3Na-Na]-、[Fuc2SO3Na-Na]-、[Fuc3SO3Na-Na]-、[Fuc4SO3Na-Na]-)、二硫酸化([Fuc2(SO3Na)2-Na]-、[Fuc4(SO3Na)2-Na]-、[Fuc5(SO3Na)2-Na]-)、三硫酸化([Fuc4(SO3Na)3-Na]-、[Fuc5(SO3Na)3-Na]-)和四硫酸化([Fuc4(SO3Na)4-Na]-、[Fuc5(SO3Na)4-Na]-)的巖藻糖及巖藻寡糖,分子量范圍為243~1 133,說明酶通過內切模式作用于巖藻多糖底物,產生一系列具有不同聚合度的巖藻寡糖。

圖2 巖藻寡糖的ESI-MS分析Fig.2 ESI-MS analysis of fucoidan oligosaccharides
2.2 巖藻寡糖的體外抗氧化活性
2.2.1 巖藻寡糖的ABTS+·清除能力
ABTS+·被廣泛應用于測定樣品的抗氧化能力。ABTS+·經氧化形成相對穩定的藍綠色自由基,在734 nm處有吸收峰。當加入具有抗氧化能力的樣品時,溶液會褪色,吸光值降低。圖3為巖藻寡糖對ABTS+·的清除結果。由圖3可知:巖藻寡糖具有顯著的清除ABTS+·的能力,且清除率與濃度呈良好的劑量效應關系。當質量濃度為10 mg/mL時,巖藻寡糖對ABTS+·的清除率高達98.83%,接近于維生素C對ABTS+·的清除率。

圖3 巖藻寡糖對ABTS+·的清除能力Fig.3 Scavenging ability of fucoidan oligosaccharides on ABTS+· radicals
2.2.2 巖藻寡糖的·OH清除能力
·OH是細胞中最活潑的自由基,它可引發組織細胞的病變,導致各種疾病發生和加速機體衰老。巖藻寡糖對于·OH清除能力如圖4所示。由圖4可知:隨著寡糖濃度的提高,·OH的清除率也隨之上升,呈現出一定的量效關系,IC50為6.02 mg/mL。當巖藻寡糖質量濃度為10 mg/mL時,巖藻寡糖對·OH的清除率高達70.49%,而巖藻多糖對于·OH的清除率與濃度的關系未呈現出明顯的量效關系。張加幸等[16]研究發現,在巖藻多糖質量濃度達到1.0 mg/mL時,清除能力不再隨濃度增加出現明顯變化,達到44.69%。因此可知,巖藻寡糖對于·OH的清除能力要優于巖藻多糖。

圖4 巖藻寡糖對·OH的清除能力Fig.4 Scavenging ability of fucoidan oligosaccharides on ·OH radicals
2.2.3 巖藻寡糖的DPPH·清除能力
DPPH·是一種穩定的有機自由基,常用來測定樣品是否具有抗氧化活性。考察巖藻寡糖的DPPH·清除能力,結果如圖5所示。由圖5可知,巖藻寡糖對DPPH·的清除率隨著時間延長而增大。當反應時間為0.5 h、巖藻寡糖為0~10 mg/mL時,對DPPH·的清除率與寡糖濃度呈劑量關系,巖藻寡糖的IC50為6.46 mg/mL;當巖藻寡糖的質量濃度為10 mg/mL時,DPPH·的清除率達到81.94%。當反應時間為6 h、巖藻寡糖為0~10 mg/mL時,對DPPH·的清除率與寡糖濃度也呈劑量關系,IC50為3.02 mg/mL;當反應時間進一步延長到12 h、巖藻寡糖的質量濃度為10 mg/mL時,IC50為2.01 mg/mL,DPPH·的清除率達到94.91%。張加幸等[16]研究發現,巖藻多糖在2 mg/mL的質量濃度下,對DPPH·的清除率僅達到63.97%。因此,巖藻寡糖對DPPH·的清除能力遠遠高于巖藻多糖對DPPH·的清除能力,其原因可能是多糖在被酶法降解的過程中產生的寡糖含有很多不飽和鍵。

圖5 巖藻寡糖對DPPH·自由基的清除能力Fig.5 Scavenging ability of fucoidan oligosaccharides on DPPH· radicals
2.3 巖藻寡糖的益生活性
2.3.1 巖藻寡糖對于植物乳桿菌的益生活性
筆者以植物乳桿菌(Lactobacillusplantarum)為研究對象,通過繪制菌株生長曲線的方法來測定巖藻寡糖的益生活性,結果如圖6所示。由圖6可知:巖藻寡糖和葡萄糖在菌株生長初期就顯示出很好的促進菌株生長的能力,在菌株培養8 h時,菌液密度(OD600)就達到了1.36,與相同濃度的葡萄糖效果相似;但是隨著培養時間的進一步延長,相同濃度的巖藻寡糖促進植物乳桿菌生長的效果要優于葡糖糖。因此,巖藻寡糖具有較好的益生活性。

圖6 巖藻寡糖對植物乳桿菌生長的影響Fig.6 Effects of fucoidan oligosaccharides on Lactobacillus plantarum
2.3.2 巖藻寡糖對于嗜酸乳桿菌的益生活性
筆者以嗜酸乳桿菌(Lactobacillusacidophilus)為研究對象,考察巖藻寡糖對于嗜酸乳桿菌的促生長作用,結果如圖7所示。由圖7可知:巖藻寡糖和葡萄糖在菌株生長初期就顯示出很好的促進菌株生長的能力;與葡萄糖為對照的結果相比,在菌株生長初期,巖藻寡糖對于菌株的生長并未表現出明顯的促進作用,但是隨著培養時間的延長,巖藻寡糖開始表現出了促生長作用,菌株生長的速度明顯加快且高于對照的結果,最終菌液密度(OD600)達到了1.43。

圖7 巖藻寡糖對嗜酸乳桿菌生長的影響Fig.7 Effects of fucoidan oligosaccharides on Lactobacillus acidophilus
目前尚無有關巖藻多糖的益生活性的報道,因此無法與之進行比較,但有研究報道海洋寡糖如瓊膠寡糖、殼寡糖等均具有顯著的促進有益菌的生長和增殖作用,例如胡斌[17]發現1%添加量的新瓊寡糖可以促進嗜酸乳桿菌(Lactobacillusacidophilus)的生長,并且可以縮短菌株的適應期。同樣地,巖藻寡糖可以縮短植物乳桿菌(Lactobacillusplantarum)的適應期,其具體機制有待于進一步驗證和分析。
3 結論
筆者以巖藻多糖為原料,利用酶法制備了不同聚合度的巖藻寡糖,并系統研究了其體外抗氧化活性和益生活性,研究結果表明巖藻寡糖具有較好的自由基清除能力,能夠顯著促進兩種腸道有益菌的生長,具有進一步開發為新型益生元的應用潛力。以上研究結論將有助于進一步豐富對巖藻寡糖結構和活性的認識,并為海洋藻類多糖資源的深加工應用奠定理論基礎。

