CIH對仔鼠胰腺基因芯片測序及相關(guān)生物信息學(xué)的影響研究
黃 煌,許險艷,許相洋,鄭 鳴,呂國榮,林逕蒼△
(1.泉州醫(yī)學(xué)高等專科學(xué)校,福建泉州 362000;2.福建醫(yī)科大學(xué)基礎(chǔ)醫(yī)學(xué)院,福州 350004)
BARKER等[1-4]學(xué)者曾經(jīng)提出了成年人的某些疾病起源于胎兒的學(xué)說,比如營養(yǎng)、氧氣等環(huán)境因素作用于早期的胎兒發(fā)育,將程序性地控制成人期機體心血管疾病及代謝性疾病的發(fā)生風(fēng)險[5]。課題組前期實驗表明,宮內(nèi)慢性間斷性缺氧(chronic intermittent hypoxia,CIH)模型可引起胎兒成年期發(fā)生動脈粥樣硬化的早期改變、子代心臟的表型改變、胰島素信號轉(zhuǎn)導(dǎo)障礙導(dǎo)致胰島素抵抗(insulin resistance,IR)等現(xiàn)象[6-9]。IR指的是機體內(nèi)正常劑量的胰島素,在和它的特異性受體結(jié)合后生物效應(yīng)低于正常的一種狀態(tài)[10-12]。
本實驗利用基因芯片技術(shù)的高靈敏度、高通量、平行性等特性,建立CIH模型,對母體常氧和缺氧環(huán)境下出生的成年期雄性仔鼠胰腺全基因表達情況進行比較,分析其生物信息學(xué)的改變,深入研究IR的分子機制。
1 材料與方法
1.1 材料
清潔級SD孕大鼠12只,體重(210±10)g,購于福建省福州振和實驗動物技術(shù)開發(fā)有限公司,許可證號:SCXK閩2018-0001。實驗于泉州醫(yī)學(xué)高等專科學(xué)校無特定病原體(SPF)級動物實驗室進行,許可證號:SYXK(閩)2008-0001。自制有機玻璃缺氧箱(60 cm×60 cm×60 cm),壓縮氮氣、氧氣(濃度大于99%)購自福建省泉州協(xié)輝氣體有限公司,希瑪AR8100便攜式測氧儀、強生血糖儀、5%水合氯醛購自福建省泉州第一醫(yī)院制劑室,大鼠空腹胰島素(FINS) ELISA試劑盒購自上海瑞番生物科技有限公司,Gene Expression Wash Buffer1、2及TRIzol購自美國Life Technologies公司,另外還有生物質(zhì)粉碎機、研磨珠均質(zhì)器、雜交室等。
1.2 方法
1.2.1CIH模型的建立
根據(jù)前期建立動物模型的方法[13-15],12只孕齡7 d的SD大鼠分為兩組,即正常組和缺氧組,每組6只。將缺氧組孕鼠置于缺氧箱內(nèi),氧濃度控制在(10.0±0.5)%,每天8 h,重復(fù)以上過程至分娩前1 d停止缺氧處理,待產(chǎn)孕鼠分籠。分娩后的第12周,每窩選取1只雄性仔鼠,心尖取血,雙抗夾心法檢測FINS,血糖儀檢測空腹血糖(FBG);麻醉后處死取胰腺于液氮中速凍待送檢。
1.2.2全基因表達譜芯片的檢測
大鼠胰腺的安捷倫全基因組寡核苷酸芯片檢測主要步驟:TRIzol法提取胰腺組織的總RNA,利用分光光度計檢測總RNA純度,合成cDNA并標(biāo)記,檢測熒光標(biāo)記的效率,已標(biāo)記的探針與高密度基因組芯片進行雜交,使用GenePIX4000B芯片掃描儀掃描芯片的熒光強度,保存數(shù)據(jù),并用Feature Extraction 軟件處理、分析數(shù)據(jù)。對于分光光度計評價總RNA純度:以260 nm處吸光度(A)值與280 nm處A值的比值(A260 nm/A280 nm)在1.8~2.1表示總RNA的純度合格,或以A260 nm/A220 nm>1.8表示總RNA純度合格。使用t檢驗分析差異表達顯著基因,篩選標(biāo)準(zhǔn):Fold Change≥2.0且P≤0.05,分析pathway 富集、判定GO(gene ontology)功能分類等。
1.2.3大鼠FINS、FBG的測定
分娩后第12周的雄性仔鼠采用鼠尾采血的方法,用強生血糖儀檢測FBG;FINS測定用酶聯(lián)免疫吸附試驗(ELISA)法測定。穩(wěn)態(tài)模式評估胰島素抵抗(HOMA-IR) = (FBG×FINS)/22.5,評估胰島素抵抗能力。
1.3 統(tǒng)計學(xué)處理
2 結(jié) 果
2.1 血液相關(guān)指標(biāo)的檢測結(jié)果
12周齡缺氧組雄性仔鼠FINS、FBG、以穩(wěn)態(tài)模式評估胰島素抵抗(HOMA-IR)均高于正常組雄性仔鼠,差異有統(tǒng)計學(xué)意義(P<0.05),見表1。
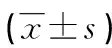
表1 第12周雄性仔鼠血液相關(guān)指標(biāo)
2.2 總RNA的定量和質(zhì)量保證
正常組雄性仔鼠和缺氧組雄性仔鼠胰腺組織的總RNA的A260 nm/A280 nm為分別1.96及1.95,接近2.00;兩組總RNA的A260 nm/A220 nm分別為2.36及2.33,均大于1.8,提示實驗提取的總RNA純度合格,兩組雄性仔鼠胰腺組織所提取的總RNA的濃度、體積、質(zhì)量見表2。

表2 ND-1000型紫外分光光度計檢測胰腺組織mRNA的純度及濃度
2.3 基因芯片差異表達基因(DEGs)篩選
散點圖坐標(biāo)的X軸、Y 軸分別為正常組、缺氧組雄性仔鼠胰腺 cy3 熒光強度值。每一個基因的雜交信號用對應(yīng)的數(shù)據(jù)點代表,紅色信號代表缺氧組雄性仔鼠胰腺的某個基因較正常組雄性仔鼠胰腺信號值相對較強,基因表達上調(diào);綠色代表的基因信號值相對較弱,基因表達下調(diào);黑色代表基因表達無明顯差異性,見圖1。基因芯片共檢測胰腺23 088個基因,依照表達基因差異篩選的標(biāo)準(zhǔn)(Fold Change≥2.0且P≤0.05),缺氧組雄性仔鼠胰腺與正常組雄性仔鼠胰腺比較有2 628個基因表達上調(diào)(紅點),有2 321個基因的表達下調(diào)(綠點)。

圖1 基因芯片信號強度的散點圖
2.4 GO功能分類
2.4.1分子功能的分析
缺氧組雄性仔鼠較正常組雄性仔鼠胰腺DEGs,表達上調(diào)的主要集中于:跨膜轉(zhuǎn)運體活動、無機分子實體跨膜轉(zhuǎn)運活性、次級活性跨膜轉(zhuǎn)運蛋白活性等分子功能;表達下調(diào)的主要集中于:蛋白質(zhì)結(jié)合、酶結(jié)合、含蛋白質(zhì)復(fù)合物結(jié)合等分子功能。見圖2。
2.4.2細胞組分的分析
缺氧組雄性仔鼠較正常組雄性仔鼠胰腺DEGs,表達上調(diào)的主要集中于:質(zhì)膜、神經(jīng)元、神經(jīng)元投射等成分;表達下調(diào)的主要集中于:細胞內(nèi)膜結(jié)合細胞器、膜結(jié)合細胞器、細胞內(nèi)細胞器等成分。見圖3。
2.4.3生物學(xué)過程的分析
缺氧組雄性仔鼠較正常組雄性仔鼠胰腺DEGs,表達上調(diào)的主要集中于:多細胞組織、系統(tǒng)開發(fā)、羧酸轉(zhuǎn)運等生物學(xué)過程; 表達下調(diào)的主要集中于:細胞代謝、有機物代謝等生物學(xué)過程。見圖4。
2.5 pathway 富集分析
缺氧組雄性仔鼠胰腺較正常組雄性仔鼠DEGs,表達上調(diào)的主要集中于:神經(jīng)活性配體-受體相互作用、皮質(zhì)醇合成與分泌、胰島素分泌等轉(zhuǎn)導(dǎo)通路;表達下調(diào)的主要集中于:核糖體、剪接體、氧化磷酸化等轉(zhuǎn)導(dǎo)通路,見圖5。胰島素分泌通路的路徑圖見圖6,黃色標(biāo)記的節(jié)點與上調(diào)基因相關(guān),綠色節(jié)點基因表達差異不明顯。

A:表達上調(diào)的分子功能;B:表達下調(diào)的分子功能。

A:表達上調(diào)的細胞組分;B:表達下調(diào)的細胞組分。

A:表達上調(diào)的生物學(xué)過程;B:表達下調(diào)的生物學(xué)過程。

A:表達上調(diào)的pathway;B:表達下調(diào)的pathway。

圖6 胰島素分泌通路
2.6 實時熒光定量PCR(RT-PCR) 驗證基因表達譜數(shù)據(jù)的可靠性
為驗證本實驗基因表達譜的可靠性,用RT-PCR方法定量檢測缺氧組雄性仔鼠胰腺與正常組雄性仔鼠胰腺中的胰島素分泌通路的IRS、PKA、PHA、TC10、P13K、AMPK mRNA相對表達水平,實驗重復(fù)3次。用2-ΔΔCt代表mRNA的相對表達水平。缺氧組雄性仔鼠IRS、PKA、PHA、TC10、P13K、AMPK mRNA相對表達水平較正常組雄性仔鼠胰腺均上調(diào),見圖7,mRNA表達趨勢與基因芯片數(shù)據(jù)相互吻合。

圖7 幾個差異表達基因mRNA表達水平比較
3 討 論
BARKER等[1-4]提出了“成人疾病胎兒起源學(xué)說”,在胚胎發(fā)育關(guān)鍵時期,如果胎兒受到的不良因素刺激,胎兒將進行必要的生存適應(yīng),使處于敏感期胚胎的組織器官在結(jié)構(gòu)與功能上發(fā)生程序性改變,如持續(xù)至出生后將增強其成年期某些慢性疾病的易感性。充足的氧氣供應(yīng)及體內(nèi)氧環(huán)境穩(wěn)定是胚胎生長發(fā)育和保持組織結(jié)構(gòu)完整的條件。高海拔地區(qū)的孕婦可引起胎兒缺氧,另外長期一氧化碳環(huán)境污染暴露、被動吸煙、吸煙等因素也可導(dǎo)致胚胎慢性缺氧。此外,孕期因素,如心力衰竭、妊娠高血壓疾病、先兆子癇、貧血、腎功能衰竭及臍帶、胎盤因素等營養(yǎng)物質(zhì)供應(yīng)不足均有可能引發(fā)孕婦缺氧,進而引起胎兒缺氧。綜上,缺氧為臨床上胎兒遭受到的最常見的應(yīng)激反應(yīng)之一。
基因芯片作為是生物芯片的一種,原理是運用計算機芯片集成化特征,使用微加工技術(shù),將特定的基因序列探針固定于支持物上,有序地排成二維DNA探針陣列,形成微觀檢測的器件,根據(jù)分子生物學(xué)核酸互補的特點,把被標(biāo)記樣品與DNA探針陣列雜交,檢測雜交信號,最后對生物樣品進行診斷[16-19]。該技術(shù)有快速、髙效等特點,可整體、全面地研究基因組內(nèi)多個基因的變化,提供相關(guān)基因組學(xué)數(shù)據(jù),是探索疾病相關(guān)聯(lián)基因的有效手段。應(yīng)用此技術(shù)篩選孕母鼠缺氧對仔鼠胰腺基因表達的影響,尚未見報道。本研究基因芯片共檢測胰腺23 088個基因,依照表達基因差異篩選的標(biāo)準(zhǔn),缺氧組雄性仔鼠胰腺較正常組雄性仔鼠胰腺有2 628個基因表達上調(diào),下調(diào)有2 321個基因。為驗證基因芯片的可靠性,用RT-PCR方法定量檢測缺氧組與正常組雄性仔鼠胰腺中的胰島素分泌通路的IRS、PKA、PHA TC10、P13K、AMPK mRNA相對表達水平, mRNA表達趨勢與基因芯片數(shù)據(jù)相互吻合,證實了基因芯片數(shù)據(jù)的有效性。
從GO功能分類的分子功能分析:缺氧組雄性仔鼠胰腺較正常組仔鼠胰腺DEGs表達上調(diào)的主要集中于跨膜轉(zhuǎn)運體活動、無機分子實體跨膜轉(zhuǎn)運活性、次級活性跨膜轉(zhuǎn)運蛋白活性等方面;表達下調(diào)的主要集中于蛋白質(zhì)結(jié)合、酶結(jié)合、含蛋白質(zhì)復(fù)合物結(jié)合等方面。從細胞組分分析:缺氧組雄性仔鼠胰腺較正常組仔鼠胰腺DEGs表達上調(diào)的主要集中于質(zhì)膜、神經(jīng)元、神經(jīng)元投射等成分;表達下調(diào)的主要集中于細胞內(nèi)膜結(jié)合細胞器、膜結(jié)合細胞器、細胞內(nèi)細胞器等部分。從生物學(xué)過程方面分析:缺氧組雄性仔鼠胰腺較正常組仔鼠胰腺DEGs表達上調(diào)的主要集中于多細胞組織、系統(tǒng)開發(fā)、羧酸轉(zhuǎn)運等生物學(xué)過程;表達下調(diào)的主要集中于細胞代謝、有機物代謝等生物學(xué)過程。
pathway 富集分析顯示缺氧組雄性仔鼠胰腺較正常組仔鼠胰腺DEGs表達上調(diào)的主要集中的轉(zhuǎn)導(dǎo)通路如:神經(jīng)活性配體-受體相互作用、皮質(zhì)醇合成與分泌、胰島素分泌等轉(zhuǎn)導(dǎo)通路;表達下調(diào)的主要集中于核糖體、剪接體、氧化磷酸化等轉(zhuǎn)導(dǎo)通路。
本研究通過建立SD大鼠妊娠期CIH模型來模擬孕期所經(jīng)歷的缺氧狀態(tài),缺氧組12周雄性仔鼠的FINS、FBG、HOMA-IR mRNA均高于正常組,差異有統(tǒng)計學(xué)意義(P<0.05),由此推測CIH可致缺氧組雄性仔鼠成年后發(fā)生IR。IR可導(dǎo)致脂代謝紊亂、2型糖尿病、糖耐量異常、肥胖及代謝綜合征等。
由pathway 富集分析胰島素分泌通路的路徑圖可看出胰島素分泌通路36個基因發(fā)生上調(diào),與實驗中CIH可導(dǎo)致缺氧組雄性仔鼠成年后發(fā)生IR的結(jié)果一致。
綜上所述, 妊娠期缺氧可導(dǎo)致成年雄性仔鼠胰腺表達基因、GO功能、胰島素分泌等pathway富集轉(zhuǎn)錄通路等失調(diào),成年雄性仔鼠呈現(xiàn)IR。

