ICU臨床檢出革蘭陰性菌的分布及耐藥性分析
楚新旭,鄒琪,段雨晨,王嬌,何先弟
(1.蚌埠醫學院第一附屬醫院 重癥醫學科,安徽 蚌埠 233000; 2.利辛縣人民醫院 檢驗科,安徽 亳州 236700; 3.安徽省組織移植重點實驗室,安徽 蚌埠 233000)
ICU作為危重患者的診療中心,其住院患者感染率較高的原因有危重患者多合并多臟器功能不全、免疫功能降低甚至抑制及反復接受各種侵襲性操作。約30%的醫院內感染發生在ICU[1],抗菌藥物的廣泛應用甚至濫用導致ICU細菌耐藥,特別是多重耐藥革蘭陰性菌的檢出日益增多,為臨床感染的防治帶來了巨大挑戰[2]。本研究回顧性分析2019年7至2020年6月某院綜合ICU臨床檢出598株革蘭陰性菌的分布及其耐藥特征,并與2019年CHINET三級醫院細菌監測結果比較,為抗菌藥物的合理應用提供依據,報道如下。
1 資料與方法
1.1 一般資料
選取2019年7月至2020年6月某院綜合ICU病區確診為細菌感染并且培養結果為革蘭陰性菌的364例住院患者。其中男240例,女124例;≥60歲206例,<60歲158例。原發病主要集中在顱腦病變、多發傷、肺部疾病、消化道腫瘤術后、心血管疾病、其他普外科術后并發癥以及脊柱損傷和截癱等,標本為痰液、血液、分泌物、尿液等。
1.2 觀察對象
(1) 結合臨床表現及實驗室檢查確診為感染的患者。(2) 培養結果明確為革蘭陰性菌者。
1.3 統計學處理
所得數據采用WHONET 5.6軟件和SPSS 24.0統計軟件進行統計學分析,計數資料使用χ2檢驗,P<0.05為差異有統計學意義。
2 結 果
2.1 病原學標本
共收集某院綜合ICU送病原學標本培養革蘭陰性菌598株,病原學標本主要為痰液(73.75%)和血液(11.37%),見表1。
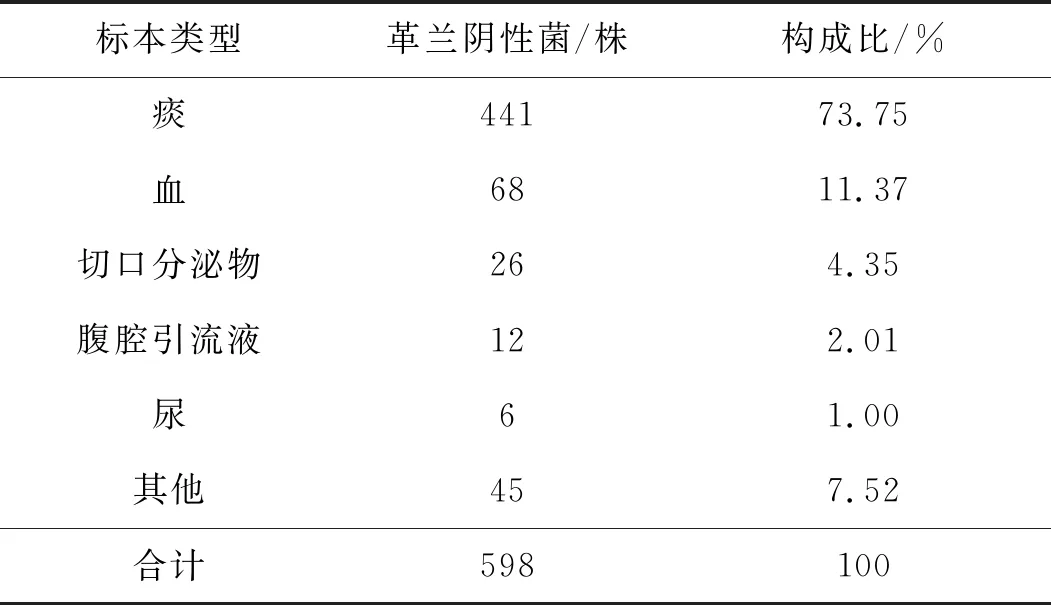
表1 ICU革蘭陰性菌標本來源構成比
2.2 病原菌的構成情況
革蘭陰性菌中腸桿菌科細菌比例最高,特別是肺炎克雷伯菌(24.92%),見表2。
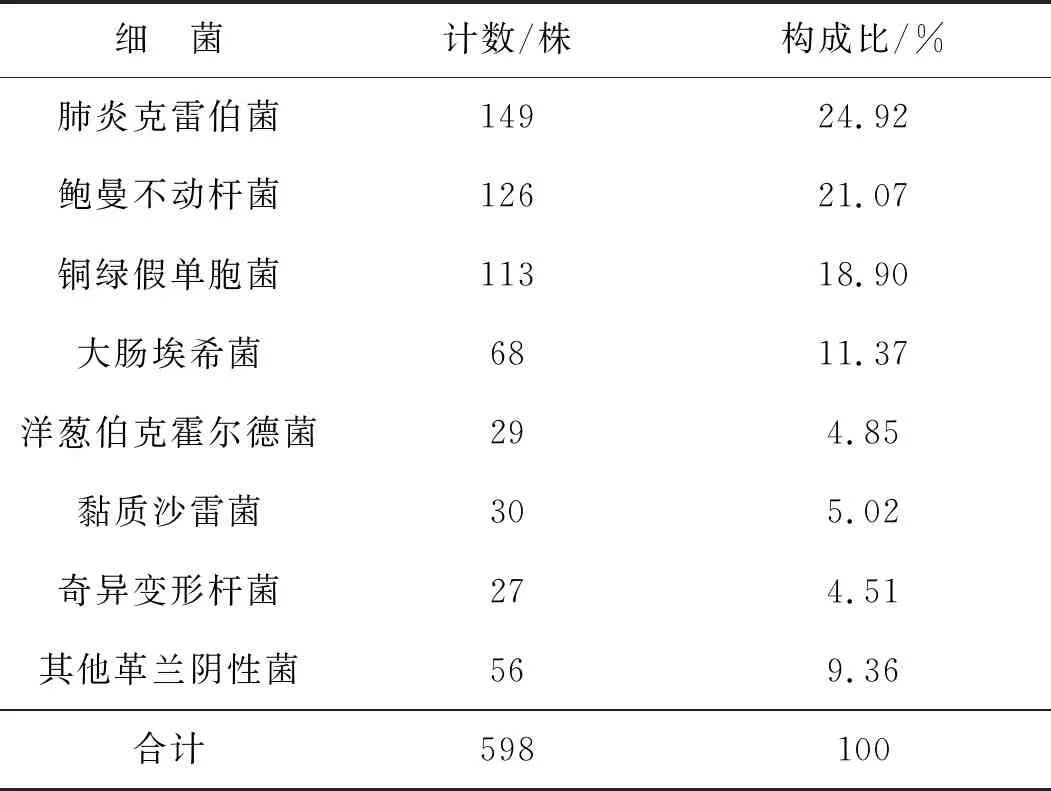
表2 ICU革蘭陰性菌構成比
2.3 主要革蘭陰性菌的耐藥性監測
149株肺炎克雷伯菌中, 產超廣譜β- 內酰胺酶(ESBL)有43株;68株大腸埃希菌中,產ESBL有47株。大腸埃希菌對亞胺培南及丁胺卡那霉素的耐藥率均在2.94%,其他分離的菌株對這兩種抗菌藥物的耐藥率分別是53.02%~100%和38.77%~100%;對于大腸埃希菌和肺炎克雷伯菌,除丁胺卡那霉素外,其他抗菌藥物的耐藥率基本上都高于亞胺培南;丁胺卡那霉素對除洋蔥伯克霍爾德菌外的分離細菌均有著良好的抗菌活性;鮑曼不動桿菌及洋蔥伯克霍爾德菌的耐藥率均較高。見表3。
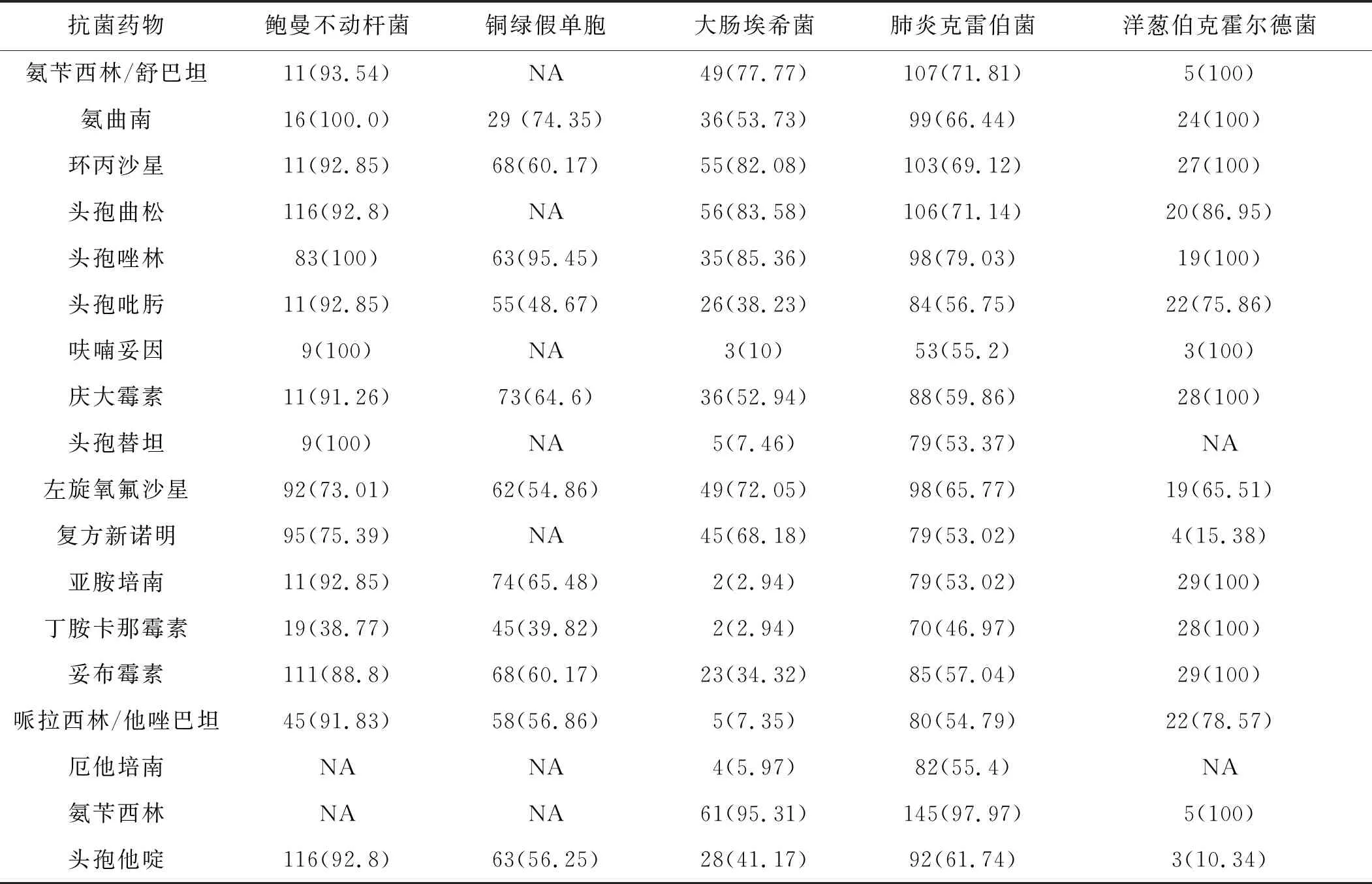
表3 常見革蘭陰性菌對不同抗菌藥物的耐藥性株
2.4 常見革蘭陰性菌多重耐藥菌株檢出情況
ICU多重耐藥菌檢出率較高,為81.27%。洋蔥伯克霍爾德菌和肺炎克雷伯菌多重耐藥的檢出結果分別位100%和73.15%,見圖1。
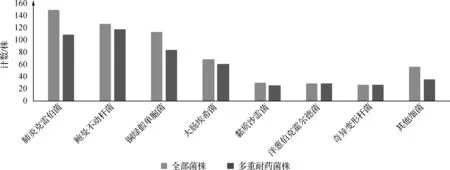
圖1 革蘭陰性菌多重耐藥檢出情況
2.5 某院綜合ICU腸桿菌科細菌耐藥率與CHINET三級醫院研究報告結果比較
某院綜合ICU腸桿菌科細菌耐藥率明顯高于2019年CHINET三級醫院細菌監測結果,見表4。
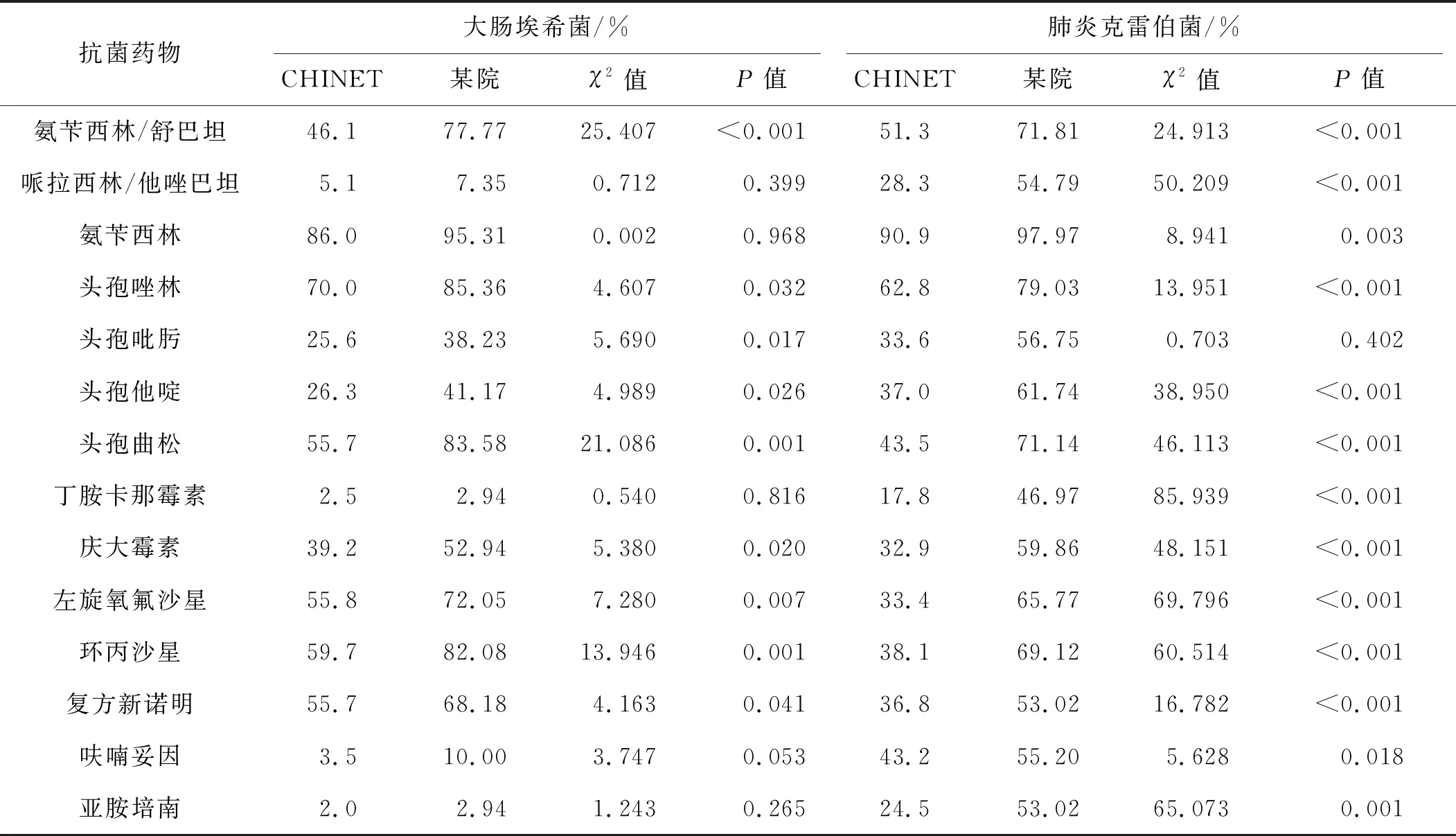
表4 某院綜合ICU腸桿菌科細菌耐藥率與2019年CHINET三級醫院研究報告結果比較
3 討 論
隨著抗菌藥物的廣泛應用,細菌耐藥特別是ICU細菌耐藥已經愈來愈嚴峻,耐藥菌群的控制不當不僅會延長患者住院時間,增加住院費用,更有甚者還使患者死亡率升高[3- 4]。最新研究[2]表明,多重耐藥菌中革蘭陰性菌的檢出呈現快速升高的趨勢。本研究探討ICU革蘭陰性菌分布及耐藥特征,以指導臨床抗菌藥物的合理應用。
ICU檢出革蘭陰性菌占同時期全部細菌的71.78%,高于全國CHINET監測數據及湘雅醫院耐藥菌群大數據分析結果,其中腸桿菌科細菌多見,特別是肺炎克雷伯菌在革蘭陰性菌中檢出率最高,為ICU中主要的耐藥菌。產ESBL肺炎克雷伯菌的檢出率為29.53%,低于2013—2017年湘雅醫院的33.3%~42.0%;產ESBL大腸埃希菌的檢出率為69.11%,高于2013—2017年湘雅醫院的57.4%~67.9%。究其原因,作者認為可能與不同醫院患者的病種、住院時長及抗菌藥物的使用習慣有所不同有關。
高級別抗菌藥物的濫用、各種侵襲性操作及各類激素的使用導致了多重耐藥菌的產生,同時ICU患者本身病情危重,存在各種免疫低下及免疫抑制現象,菌株在壓力誘導下發生變異,形成惡性循環。ICU環境中存在多種菌株,醫務人員院感防控意識不強是引起多重耐藥菌的定植、感染甚至爆發的又一高危因素。對于多重耐藥革蘭陰性菌而言,碳青霉烯類抗生素抗菌活性良好,但由于碳青霉烯類抗菌藥物濫用,耐藥的革蘭陰性菌檢出率逐年升高。耐碳青霉烯類肺炎克雷伯菌(CRKP)檢出率的升高導致了抗感染難度的增加,致使患者高病死率[5- 6]。CRKP及耐碳青霉烯類腸桿菌(CREC)是導致死亡率快速上升的病原菌,其中CREC耐藥機制復雜多變,碳青霉烯酶的產生及菌株攜帶的多種耐藥基因的誘導表達致使碳青霉烯類耐藥的腸桿菌也對其他抗菌藥物耐藥,這在臨床上較為棘手[5- 7]。CRKP的耐藥機制復雜多樣,主要有碳青霉烯酶的產生、AmpC酶或ESBLs的高表達以及外排泵系統和外膜蛋白的缺失。其中較單獨用藥而言,聯合用藥對CRKP有明顯的臨床效果[8]。可聯合應用的藥物通常為替加環素、磷霉素、多黏菌素以及新的酶抑制劑,各種新型抗菌藥物的研發為耐藥菌株的治療提供了新的思路。多黏菌素及替加環素治療CREC的效果良好,但近年來發現此兩種藥物的耐藥菌株出現比例逐漸升高[9- 10]。同樣,頭孢他啶/阿維巴坦對產KPC型碳青霉烯酶菌株有著較高的敏感性,但在產金屬酶菌株上表現出較低的敏感性[11]。
ICU多重耐藥菌的檢出較高,為81.27%,最常見于鮑曼不動桿菌。但鮑曼不動桿菌在革蘭陰性菌中的檢出率低于肺炎克雷伯菌,這與吳強等[12]的報道不同。究其原因,作者認為鮑曼不動桿菌極易在ICU物體表面生長,甚至能存在數月之久,同時ICU患者多病情危重,住院時間較長,隨著住院時間的延長鮑曼不動桿菌極易被篩選出優勢生長,增加鮑曼不動桿菌感染的幾率,形成了一惡性循環鏈[13],導致多重耐藥鮑曼不動桿菌的檢出增多。鮑曼不動桿菌對丁胺卡那霉素的耐藥率為38.77%,對其余抗菌藥物的耐藥率均在73.01%以上,其耐藥形勢非常嚴峻,產ESBL被視為主要機制。多黏菌素協同其他抗生素治療鮑曼不動桿菌時未能達到預想效果,需要更多新型藥物[14]。洋蔥伯克霍爾德菌檢出率為4.85%,略高于文獻報道的檢出率[15- 17]。本實驗只納入革蘭陰性菌,所以其檢出率偏高。其頭孢他啶、復方新諾明耐藥率分別為10.34%和15.38%,在其余抗菌藥物上均表現了高耐藥率甚至全耐藥。本研究所有洋蔥伯克霍爾德菌均為多重耐藥菌。
ICU革蘭陰性菌感染及耐藥形勢嚴峻,應該加強抗菌藥物的規范使用,減少耐藥菌株的出現,結合病原學涂片細菌學分類、細菌培養加藥敏結果指導臨床用藥,可提高臨床療效[18]。控制感染固然重要,但更應將預防感染做到更好,不僅要合理使用和管理好抗菌藥物,更應定期監測細菌耐藥性。醫護人員做好手衛生減少多重耐藥的傳播途徑,有條件醫院應做到單間隔離患者,注意醫療環境的清潔與消毒以及集束化的預防感染措施和持續的質量改進,引進更加全面和快速的技術輔助臨床,合理利用藥敏數據,努力制定更加合理的治療方案,達到對病原菌的精準治療。

