99mTc- MIBI顯像預測骨肉瘤新輔助化療后組織學反應的Meta分析
馬玉萍,謝彥,靳激揚
(1.東南大學 醫學院,江蘇 南京 210009; 2.東南大學附屬中大醫院 核醫學科,江蘇 南京 210009;3.東南大學附屬中大醫院 放射科,江蘇 南京 210009)
骨肉瘤是一種起源于間葉組織的原發性惡性骨腫瘤,且好發于兒童及青少年。在過去的幾十年里,術前及術后的多藥聯合化療方案使得骨肉瘤患者的生存率有明顯的提高。新輔助化療的組織學反應或腫瘤壞死率(TNR)與預后密切相關[1],但TNR僅能夠在手術切除后獲得。更早及無創地獲得腫瘤對新輔助化療的組織學反應,需要一些能夠術前預測腫瘤反應的方法。
已有文獻[2- 5]報道,使用磁共振動態增強、磁共振彌散加權成像、18F- 脫氧葡萄糖(fluorodeoxyglucose, FDG)PET/CT顯像、201鉈(201TI)顯像定量分析預測骨肉瘤新輔助化療后TNR的Meta分析。磁共振動態增強或彌散加權成像常被用于骨腫瘤定性、尋找惡性腫瘤轉移灶,但也有磁共振評估骨肉瘤新輔助化療后TNR的報道,且只能在新輔助化療之后進行評估。18F- FDG是葡萄糖的類似物,可以被細胞膜表面的葡萄糖轉運蛋白轉運至胞內。一般情況下,腫瘤組織的惡性程度越高,腫瘤細胞的無氧酵解越活躍,因此局部的18F- FDG攝取值會增高,所以18F- FDG PET/CT顯像也可用于評估骨肉瘤新輔助化療后TNR以評估患者的預后,不僅可以評估腫瘤局部情況,還可以探查有無全身轉移情況。用化療后的標準攝取值(SUV2)<2.5和化療前后標準攝取值之比(SUV 2∶1)<0.5作為截斷值來預測TNR,靈敏度及特異度均較好,但是也只能在新輔助化療之后進行評估。201TI生物學特性與鉀離子相類似,通過ATP酶依賴性Na+/K+泵的主動轉運和依據胞漿內濃度梯度的被動擴散兩種攝取機制被腫瘤細胞攝取,這種獨特的攝取方式使得201TI更能精確地反映腫瘤細胞活性和代謝活躍程度,在評價骨肉瘤新輔助化療療效方面更有優勢,但是生物毒性較大、生物半衰期較長以及國內藥物來源不方便,使其應用受限[6]。锝- 99m- 甲氧基異丁基異腈(technetium- 99m- sestambi,99mTc- MIBI)是一種正一價脂溶性化合物,通過細胞膜內外兩側的電位差所致的被動轉運進入心肌細胞或腫瘤細胞,最初被用于心肌灌注顯像,近年來也被用于腫瘤顯像。多種細胞機制與骨肉瘤多藥耐藥表型相關,其中細胞前耐藥機制包括ATP依賴的跨膜轉運蛋白[如P糖蛋白(P- gp)]和多藥耐藥相關蛋白(MRP)介導藥物的細胞外轉運增強[7]。用于治療骨肉瘤的經典藥物如阿霉素是P- gp和MRP的底物[8]。體外和臨床觀察[9]表明,P- gp的表達與化療耐藥相關,是骨肉瘤患者重要的不良預后因素。99mTc- MIBI是P- gp和MPR合適的轉運載體[10],99mTc- MIBI的攝取率與P- gp水平呈負相關[11- 13],且99mTc- MIBI的外排率與體外測量的P- gp水平也存在顯著相關性[14- 15]。根據99mTc- MIBI攝取率可以預測腫瘤組織中的P- gp及MPR蛋白表達以預測化療耐藥情況,與患者預后密切相關。因此,利用99mTc- MIBI顯像在評估骨肉瘤新輔助化療TNR率及臨床預后方面更有優勢。
1 資料與方法
1.1 資料來源
在中國知網、萬方數據庫運用關鍵詞“骨肉瘤”“Tc- 99m- MIBI”檢索中文文獻,在PubMed、Web of Science及Elsevier數據庫運用關鍵詞“osteosarcoma”“Tc- 99m- MIBI”檢索英文文獻(截至日期是2020年4月);所有檢索策略通過多次預檢索后確定。納入分析的文獻均可搜索到全文,同時也檢索文獻中相關的參考文獻。當同一批研究對象出現在不同文獻中,只納入最近的或數據最全面的文獻以避免數據重復。
1.2 資料選擇
納入標準:(1) 在新輔助化療前和(或)后利用99mTc- MIBI顯像定量評估骨肉瘤化療反應;(2) 有靈敏度、特異度或化療前后對應的攝取值變化率(AUR)與TNR值或圖,或者攝取值衰減率(WR)與TNR值對應的值或圖;(3) 以手術后組織學反應結果為“金標準”;(4) 考慮到樣本量太小計算靈敏度和特異度誤差較大,單個研究的樣本量即研究對象須≥10;(5) 以中文或英文發表;(6) 能獲得全文的文獻。排除標準:(1) 綜述、講座、會議摘要、畢業論文、病例報告類文獻;(2) 未經病理確診或金標準為非病理診斷;(3) 重復發表數據。金標準為Salzer- Kuntschik的分級標準[16],當TNR≥90%定義為好反應,而TNR<90%為差反應。
1.3 資料提取
由2名研究者獨立檢索和評價相關文獻,決定文獻是否被納入,如有分歧,則共同討論決定。分別從每篇符合納入標準的文獻中提取信息,包括第一作者的名字、發表年份、研究類型、研究對象的總數、年齡及性別比例、化療方案、99mTc- MIBI顯像的參數如AUR或WR、掃描時間、獲取感興趣區域(ROI)方法。對于數據不充分的文章,聯系相應作者,以確保信息完整。當數據在圖表中報告時,AUR/WR和TNR由獲取數據軟件(GetData Graph Digitizer,版本 2.25,2012)估算,具體方法見文獻[17]。
1.4 質量評價
為盡量保持納入文獻的同質性,以診斷性研究質量評價(quality assessment of diagnostic accuracy studies,QUADAS- 2)評分表[18]為基礎制定文獻質量評價標準。PROSPERO網站注冊號為CRD42020177105。
1.5 統計學處理
分別分析用于評估骨肉瘤新輔助化療組織學反應的AUR和WR的預測能力,提取每篇納入文獻中真陽性值、假陽性值、假陰性值及真陰性值,并分別制成2×2四格表;利用Meta- DiSc1.4軟件進行Meta分析,計算不同截斷值的加權靈敏度、特異度,繪制受試者工作特征曲線(ROC曲線),并計算曲線下面積(AUC)。利用χ2檢驗評估納入研究的統計學異質性,P<0.10和(或)I2>50%為有統計學意義,即存在明顯異質性;當研究間異質性較高時使用隨機效應模型,當異質性不明顯使用固定效應模型。所有的分析均采用Rev Manager V5.3和Meta- DiSc1.4軟件。
2 結 果
2.1 檢索結果
根據Meta分析的主要內容P(骨肉瘤患者)、I(利用99mTc- MIBI顯像定量分析化療反應)、C(手術后TNR)、O(AUR或WR)、S(前瞻性或回顧性隊列研究),在上述數據庫中共檢索出113篇中英文文獻,根據標題和摘要排除85篇,排除13篇重復文獻;隨后閱讀全文排除7篇文獻,最終剩下8篇文獻納入分析[19- 26]。其中6篇研究利用AUR預測TNR,一共134例患者[19,21,23- 26];4篇研究運用WR預測TNR,一共96例患者[20,22- 23,26]。由于納入文獻數量較少,且每個亞組分析的文獻數均較少,遂未進行發表偏倚分析。文獻納入的流程見圖1,各研究的基本特點見表1。
2.2 質量評價
對8篇文獻根據Cochrane干預系統評價手冊(方法學質量評估QUADAS- 2工具)進行偏倚風險評估,總體分為兩大部分:第一部分為偏倚風險評價,其中包括針對病例選擇、診斷試驗、金標準選擇、病例流程和進展情況的評價;在病例選擇評價方面,部分文獻并未交待是否納入連續病例,所以病例選擇的評估風險為不清楚;在金標準評價方面,有2篇文獻未交待是否使用盲法。第二部分為臨床適用性評價,包括針對病例選擇、診斷試驗及金標準的評價,在臨床適用性的評價方面,所納入的文獻均為低風險;7個領域有≥5個“低”風險答案,共同的不足之處集中在病人的選擇方面。見圖2、3。
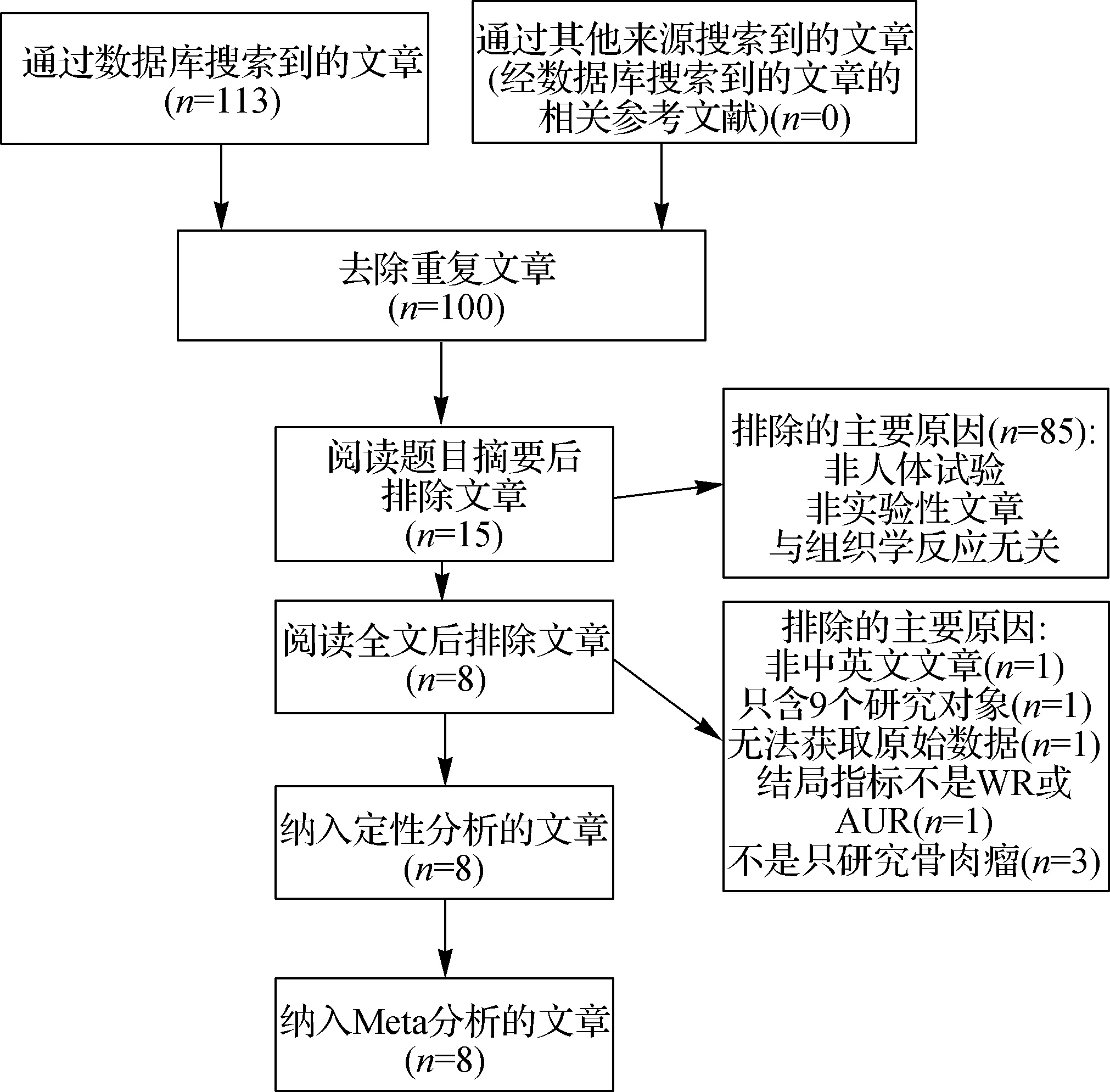
圖1 納入文獻的流程圖
2.3 Meta分析結果
2.3.1 AUR的預測能力 6篇文獻運用AUR預測TNR,共納入134例患者;在異質性檢驗中,P<0.10及I2>50%,間異質性較高,使用隨機效應模型。其中3個研究[21,25- 26]給出明確AUR截斷值,分別為38%、35%、30%。利用上述3個不同的截斷值計算加權靈敏度、特異度及AUC。當AUR截斷值為30%時,加權診斷靈敏度、特異度和AUC分別為0.85(95%CI:0.74~0.93)、0.59(95%CI:0.47~0.70)及0.84(圖4);當AUR截斷值為35%時,加權診斷靈敏度、特異度和AUC分別為0.91(95%CI:0.79~0.98)、0.68(95%CI:0.55~0.79)及0.87(圖5);當AUR截斷值為38%時,加權診斷靈敏度、特異度和AUC分別為0.87(95%CI:0.72~0.96)、0.80(95%CI:0.66~0.89)及0.91(圖6)。根據約登指數或稱診斷正確指數(靈敏度+特異度-1),考慮在AUR取截斷值為38%時,診斷性能最高,且在該截斷值時AUC最大。
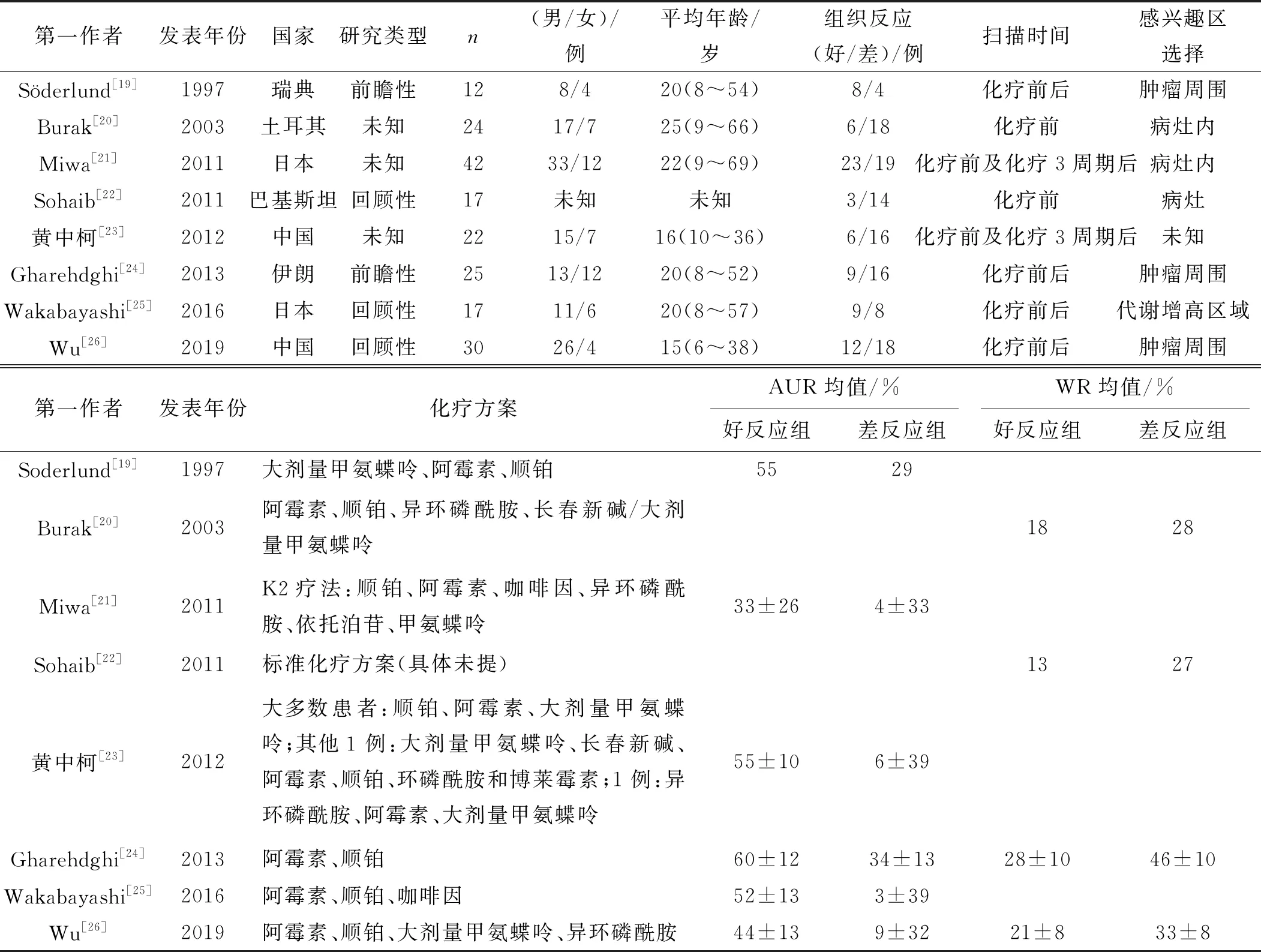
表1 納入文獻基本特征
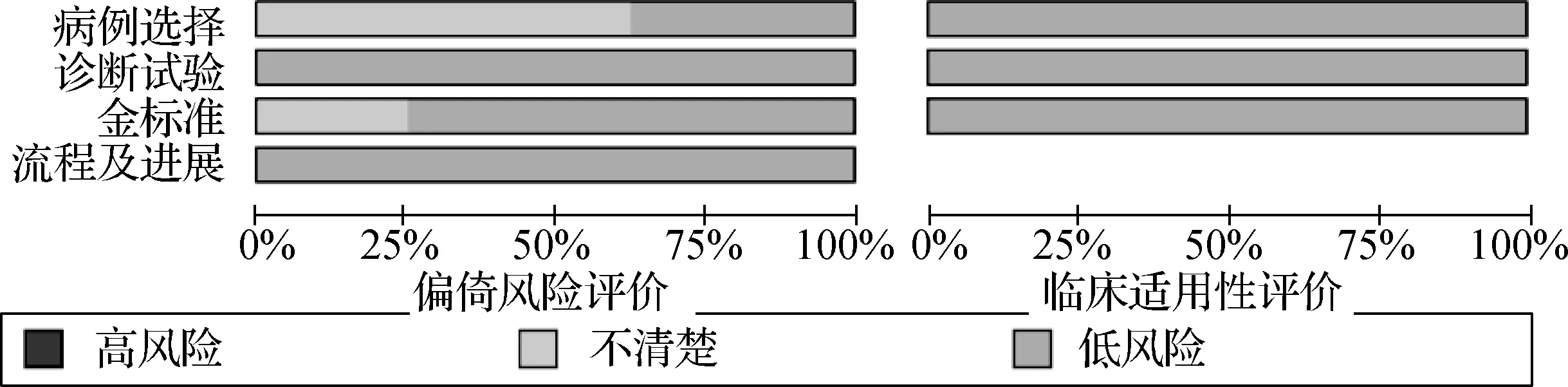
圖2 偏倚風險圖

圖3 偏倚風險總結
2.3.2 WR的預測能力 4篇研究運用WR預測TNR,一共96個患者;在異質性檢驗中,P<0.10及I2>50%,間異質性較高,使用隨機效應模型。其中2篇文獻給出明確截斷值[20,26],分別為22%、25%。利用上述2個不同的截斷值計算加權靈敏度、特異度及AUC。當WR截斷值為22%時,加權診斷靈敏度、特異度和AUC分別為0.57(95%CI:0.37~0.75)、0.94(95%CI:0.85~0.98)及0.90(圖7);當WR截斷值為25%時,加權診斷靈敏度、特異度和AUC分別為0.70(95%CI:0.51~0.85)、0.86(95%CI:0.76~0.94)及0.87(圖8)。根據約登指數,考慮WR取25%為截斷值時診斷性能最高。圖9為AUR截斷值為38%和WR截斷值為25%的ROC曲線。
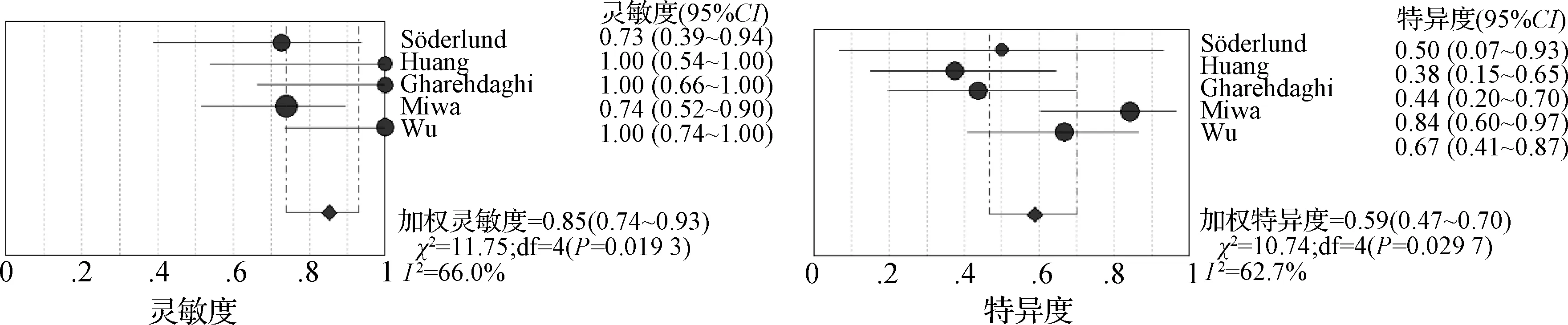
圖4 AUR截斷值為30%的靈敏度、特異度森林圖
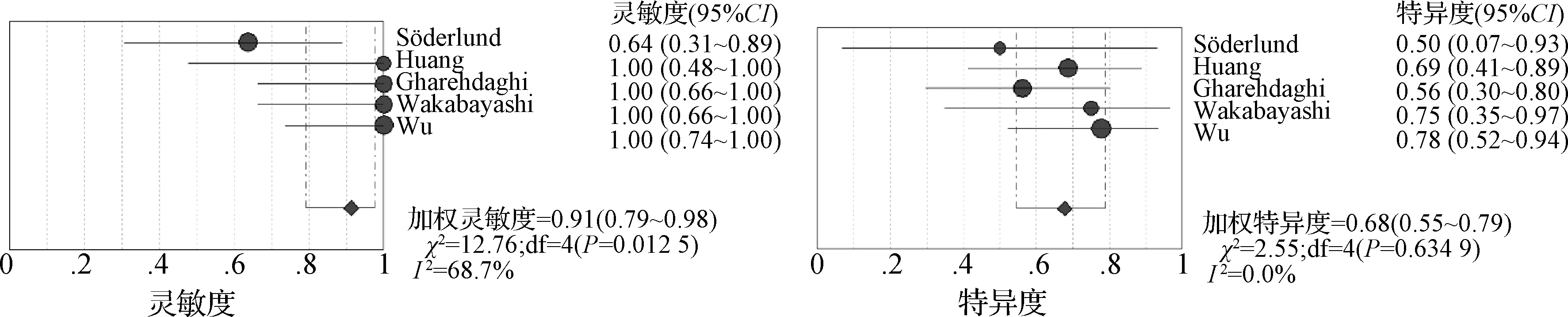
圖5 AUR截斷值為35%的靈敏度、特異度森林圖
3 討 論
99mTc- MIBI顯像是一種用于腫瘤分期和檢測腫瘤復發有效的、無創的方法。近年來臨床研究[19- 26]表明,AUR及WR與骨肉瘤組織壞死率密切相關。Wu等[27]等進行99mTc- MIBI顯像評估骨肉瘤新輔助化療反應的Meta分析,雖然與本研究有些類似,均是利用化療前后AUR及化療前WR預測TNR,但是研究方法大不相同。該研究利用其中某一個截斷值去分析AUR及WR的預測價值,而本研究借鑒了之前的研究中提供的多個AUR和WR截斷值,并利用每個不同截斷值分別進行Meta分析。本研究結果提示,AUR≥38%及WR≤25%對骨肉瘤新輔助化療后腫瘤反應具有預測價值,且AUR≥38%比WR≤25%更具有診斷效能(0.87~0.91)。

圖6 AUR截斷值為38%的靈敏度、特異度森林圖
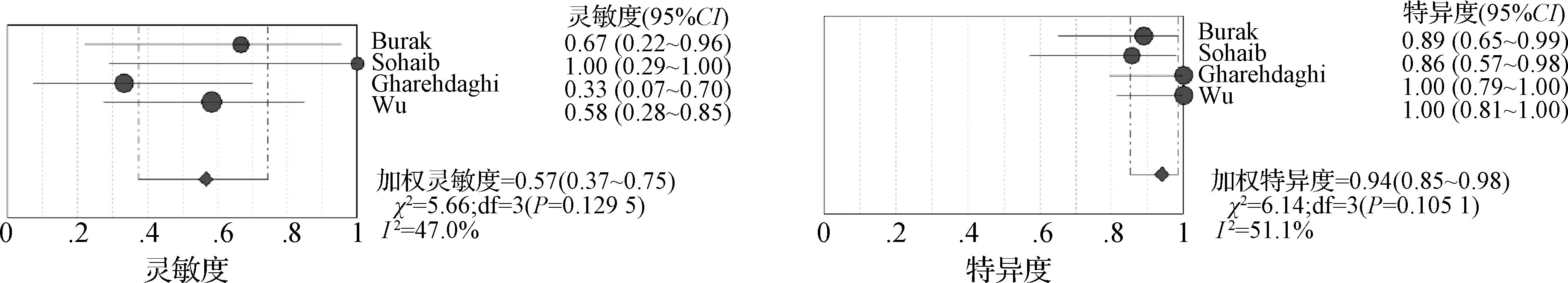
圖7 WR截斷值為22%的靈敏度、特異度森林圖
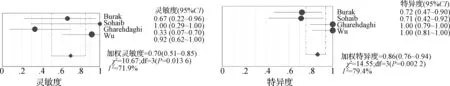
圖8 WR截斷值為25%的靈敏度、特異度森林圖
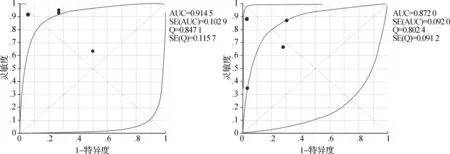
左:AUR截斷值為38%;右:WR截斷值為25%
本Meta分析存在一些缺陷:首先,本研究共納入8篇文獻,數量較少,故未進行發表偏倚風險評估及敏感性分析,其中6篇研究利用AUR預測TNR,只有4篇研究運用WR預測TNR,且每篇文獻中的研究對象數量相對較少,平均每個研究約25人;并且,在部分文獻中只給出截斷值下的靈敏度及特異度,無法將這些文獻數據綜合到其他截斷值下運用,所以在某些截斷值下,只有更少的文獻數量和研究對象;因此需要更多研究文獻及病人數量才能使結果更具有說服力。其次,由于部分研究沒有具體的關于WR或AUR和TNR的數據,只能用文獻中提供的散點圖利用數據軟件提取估算,雖然比對過相關的均值±標準差,差異均在可接受范圍,但是沒有最原始的研究數據會使得Meta分析過程中出現些許誤差。再者,沒有一篇文獻有具體規定99mTc- MIBI掃描方法、掃描時間、感興趣區選取的標準策略,另外納入的文獻中關于新輔助化療的方案、周期、與手術之間的時間間隔都不盡相同,不同的掃描時間窗肯定會導致不同研究間的結果不一致;且因為腫瘤病理分級和大小以及99mTc- MIBI的掃描時間對成像結果影響較大,在評估時應該考慮到這些參數對結果的影響,但是本篇分析并沒有將這些考慮進去。綜上,研究對象、掃描及測量方法可能存在較大異質性,影響合并之后結果的可靠性。
總之,本Meta分析結果顯示,99mTc- MIBI定量顯像相關數據AUR≥38%和WR≤25%可以作為評估化療介導TNR的預測指標,但是更多的研究對象應被納入到研究中以提高數據可信性及避免臨床異質性;另外,有必要結合其他因素規范預后評估體系,從而制定更精確的策略以提高對化療反應好壞的辨別能力,從而更好地治療和服務患者。

