蛋白質(zhì)與多酚相互作用研究進(jìn)展
黃子林 孔祥珍 張麗娜 華欲飛
(江南大學(xué)食品學(xué)院,無(wú)錫 214122)
蛋白質(zhì)是由不同的氨基酸組成的高度復(fù)雜的復(fù)合物,其廣泛存在于奶類、肉類、蛋類和油料種子中。多酚則以天然抗炎、抗病毒、抗氧化活性物質(zhì)著稱[1]。多酚與蛋白的相互作用近年來(lái)已經(jīng)逐漸稱為新的研究熱點(diǎn),這些研究根據(jù)多酚來(lái)源的不同主要可以分兩種:一種是研究食品體系中天然存在的多酚與蛋白質(zhì)的相互作用,例如大豆、核桃、葵花籽等油料作物榨油后的殘?jiān)卸喾优c蛋白之間的相互作用[2-4],通過研究粕中脫酚與未脫酚蛋白的性質(zhì)和營(yíng)養(yǎng)價(jià)值的不同來(lái)探究二者的相互作用;另一種通過外加多酚,探究多酚與蛋白質(zhì)的相互作用及對(duì)二者各自性質(zhì)的影響,根據(jù)其性質(zhì)的改變以探究其應(yīng)用潛力[5,6]。例如通過二者相互作用可以改善多酚穩(wěn)定性,故可將蛋白質(zhì)作為穩(wěn)定多酚的載體[7-9];通過其相互作用可提高蛋白質(zhì)產(chǎn)品的抗氧化性,故將二者復(fù)合物作為易氧化食品的包裝材料[10];也有研究發(fā)現(xiàn)二者的相互作用能夠改善蛋白質(zhì)的乳化性質(zhì),從而將其用于制備乳液飲料等[11]。
廣泛的應(yīng)用方向?yàn)榈鞍踪|(zhì)與多酚相互作用的研究提供了不竭的動(dòng)力。為了研究蛋白質(zhì)與多酚的相互作用對(duì)各自結(jié)構(gòu)、功能和營(yíng)養(yǎng)性質(zhì)的影響,首先需要了解二者相互作用的可能機(jī)理及其分析方法。蛋白質(zhì)與多酚的相互作用可以分為共價(jià)作用和非共價(jià)作用,其中非共價(jià)作用可逆,其作用力主要包括疏水相互作用、氫鍵、靜電相互作用和范德華力等。共價(jià)作用主要是源于多酚的氧化和親核加成過程,其作用力是共價(jià)鍵且反應(yīng)不可逆。但多數(shù)情況下,共價(jià)和非共價(jià)作用可能同時(shí)發(fā)生,例如綠原酸與蛋白質(zhì)的結(jié)合[12]。本文主要從多酚與蛋白質(zhì)的相互作用機(jī)理、分析方法、影響因素和對(duì)蛋白與多酚的影響幾個(gè)方面進(jìn)行綜述。
1 蛋白質(zhì)與多酚的相互作用機(jī)理
1.1 非共價(jià)相互作用機(jī)理
蛋白質(zhì)與多酚非共價(jià)作用包括疏水相互作用、氫鍵、范德華力、靜電相互作用等,如圖1所示。其中疏水相互作用被認(rèn)為是蛋白質(zhì)與多酚非共價(jià)相互作用最主要的驅(qū)動(dòng)力,氫鍵次之。疏水相互作用主要表現(xiàn)在蛋白質(zhì)脂肪族、芳香族氨基酸與多酚的苯環(huán)之間。Wei等[13]研究了花色苷與β-酪蛋白的非共價(jià)相互作用機(jī)理發(fā)現(xiàn)其主要由疏水相互作用驅(qū)動(dòng)。氫鍵則主要通過多酚化合物中氫原子與蛋白質(zhì)中N、O或S原子等電負(fù)性原子的相互作用形成。Wang等[14]研究了富含多酚物質(zhì)的烏飯樹葉色素與大米蛋白的相互作用,發(fā)現(xiàn)其作用力主要包括疏水相互作用和氫鍵。

圖1 多酚與蛋白質(zhì)非共價(jià)作用機(jī)制[17]
有假說提出蛋白質(zhì)與多酚的非共價(jià)作用可以分為三個(gè)階段:第一階段,形成小的蛋白質(zhì)-酚類復(fù)合物,多酚物質(zhì)可以結(jié)合到蛋白質(zhì)分子疏水性基團(tuán)等多個(gè)作用位點(diǎn)上,使得蛋白質(zhì)結(jié)構(gòu)從隨機(jī)卷曲轉(zhuǎn)變?yōu)榕c酚類化合物結(jié)合更緊密的結(jié)構(gòu),疏水相互作用被認(rèn)為是第一階段的主要作用力;第二階段,由蛋白質(zhì)-酚類復(fù)合物通過交聯(lián)自結(jié)合形成小聚集體,導(dǎo)致復(fù)合聚集體的形成,氫鍵起到穩(wěn)定和加強(qiáng)復(fù)合物的作用;第三階段,大尺寸復(fù)合物由于聚結(jié)而沉淀。此外,各階段主要驅(qū)動(dòng)力還取決于蛋白質(zhì)的結(jié)構(gòu)、酚類化合物結(jié)構(gòu)、濃度和化學(xué)性質(zhì)[15]。
雖然非共價(jià)相互作用很弱,一般比通常共價(jià)鍵能小1~2 個(gè)數(shù)量級(jí),但這些分子間弱相互作用力可在一定條件下起協(xié)同作用,形成具有一定方向性和選擇性的強(qiáng)作用力[16]。例如啤酒、葡萄酒、茶飲料等在銷售期間容易形成渾濁,其最常見、最重要的原因之一就是蛋白質(zhì)與多酚的非共價(jià)相互作用。
1.2 共價(jià)相互作用的機(jī)理
酚類化合物具有較高的反應(yīng)活性,容易被氧化成相應(yīng)的醌,它們能與親核試劑發(fā)生共價(jià)反應(yīng),例如蛋白質(zhì)的游離氨基、賴氨酸、半胱氨酸和色氨酸等。
圖2為鄰醌與氨基或巰基的親核加成示意圖,反應(yīng)后酚環(huán)與蛋白質(zhì)上的氨基或巰基反應(yīng)形成共價(jià)的C—N鍵或C—S鍵,鄰醌被還原成酚類。故該加成產(chǎn)物可以再次被氧化成醌類,進(jìn)一步形成二聚體或繼續(xù)被還原,如圖3所示。鄰醌類物質(zhì)由于其親電性,易在后續(xù)反應(yīng)中形成二聚體或多聚體,導(dǎo)致形成蛋白質(zhì)聚合物。關(guān)于鄰醌與蛋白質(zhì)形成共價(jià)鍵的作用位點(diǎn)說法不一,圖2、圖3中分別示意蛋白質(zhì)在酚羥基間位和鄰位取代形成共價(jià)鍵,但Tran等[1]則示意蛋白質(zhì)會(huì)取代苯環(huán)上的一個(gè)酚羥基從而使二者共價(jià)交聯(lián)。推測(cè)蛋白質(zhì)與多酚的種類不同會(huì)導(dǎo)致其共價(jià)交聯(lián)作用位點(diǎn)出現(xiàn)變化。
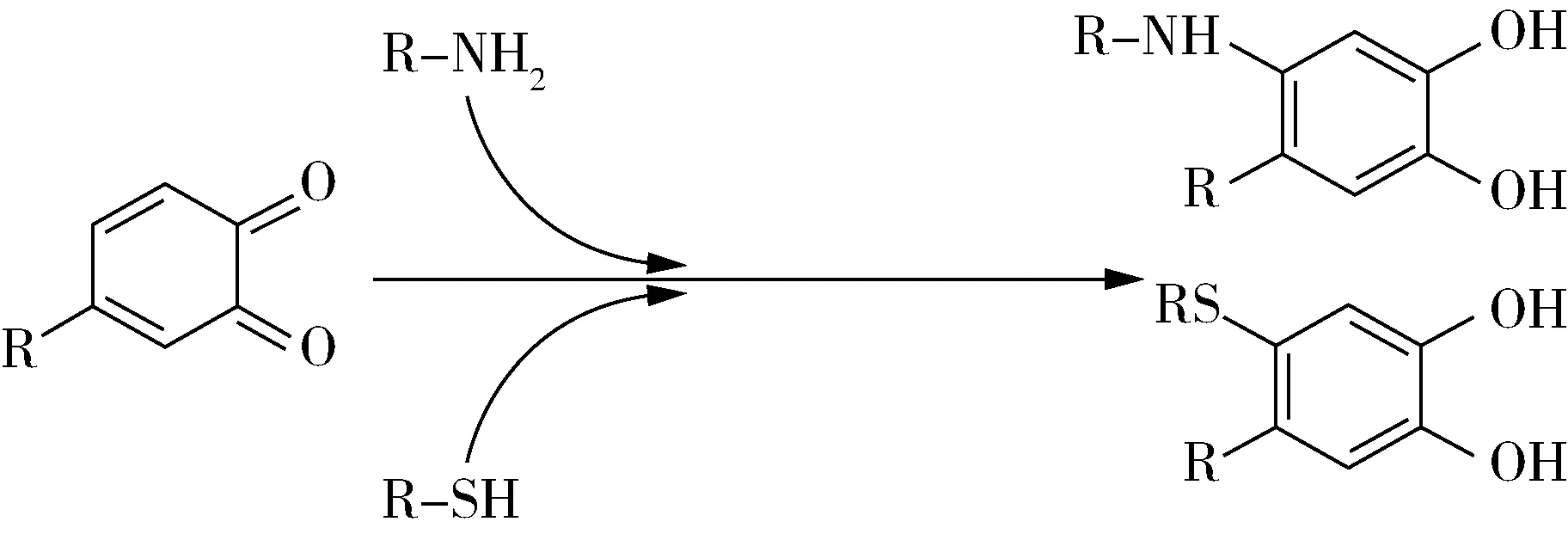
圖2 鄰醌與氨基、巰基的1,4-親核加成反應(yīng)示意圖[17]
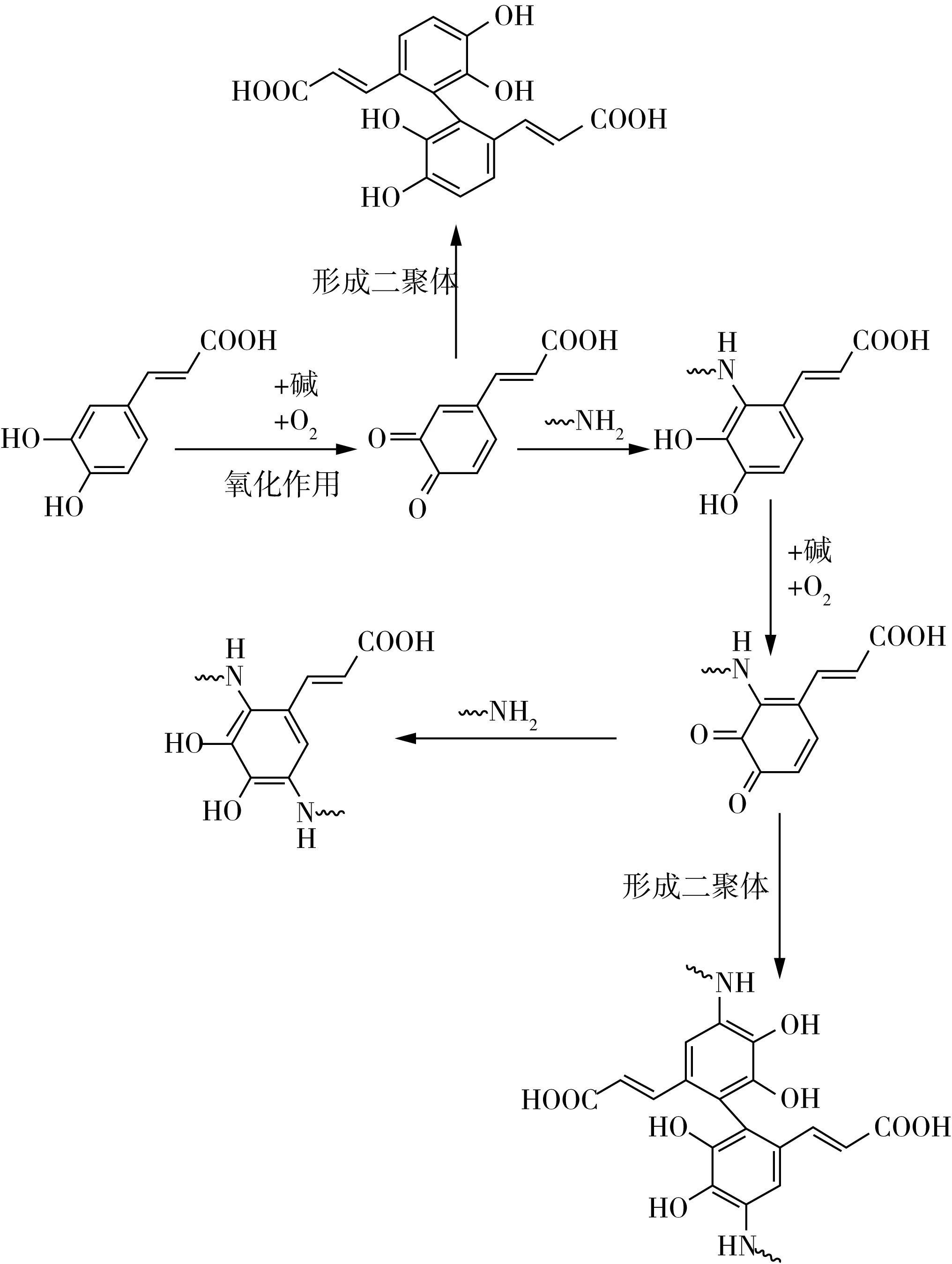
圖3 堿處理形成蛋白質(zhì)-多酚偶聯(lián)物的機(jī)理[18]
2 研究蛋白質(zhì)與多酚相互作用的分析方法
由于蛋白質(zhì)-多酚的相互作用較為復(fù)雜,沒有單一的技術(shù)能提供全面的信息,一般通過多種技術(shù)進(jìn)行表征。這些技術(shù)包括熒光色譜、圓二色光譜、傅里葉變換紅外光譜、等溫滴定量熱法、差示掃描量熱法、核磁共振光譜等。本文對(duì)部分分析方法進(jìn)行簡(jiǎn)單闡述。
2.1 熒光光譜法
熒光光譜法又稱熒光猝滅法,是研究多酚與蛋白質(zhì)間相互作用的重要手段。熒光猝滅法又分為動(dòng)態(tài)猝滅和靜態(tài)猝滅。此方法可以測(cè)得多酚與蛋白質(zhì)的結(jié)合點(diǎn)數(shù)和結(jié)合常數(shù),分析多酚與蛋白質(zhì)間作用力類型,還可計(jì)算結(jié)合距離和能量轉(zhuǎn)移效率。Zou等[19]用熒光光譜法表征葡萄籽原花青素(GSP)與大豆分離蛋白(SPI)的相互作用,發(fā)現(xiàn)隨著GSP濃度的增加,GSP對(duì)SPI的熒光猝滅作用更加明顯且主要是靜態(tài)猝滅,即證明了二者確實(shí)形成了復(fù)合物。Ren等[20]的研究表明,相比β-伴大豆球蛋白,與氰基-3-O-葡萄糖苷(C3G)結(jié)合能力更強(qiáng)的大豆球蛋白在熒光猝滅中有更大的結(jié)合常數(shù)。
熒光猝滅法能得到較可靠的表征參數(shù),但其也有對(duì)環(huán)境敏感,易受干擾,無(wú)法確定多酚與蛋白質(zhì)相互作用的結(jié)合位點(diǎn)等缺點(diǎn)。
2.2 圓二色譜法(CD)
蛋白質(zhì)的遠(yuǎn)、近紫外圓二色譜可分別用于觀測(cè)蛋白質(zhì)的二、三級(jí)結(jié)構(gòu)變化,也常被用于表征多酚與蛋白質(zhì)相互作用。如Al-Hanish等[21]通過圓二色譜發(fā)現(xiàn)EGCG與牛α-乳蛋白相互作用誘導(dǎo)了α-螺旋向β-結(jié)構(gòu)的轉(zhuǎn)變;相反,Ren等[22]則通過圓二色譜發(fā)現(xiàn)大豆蛋白與C3G結(jié)合會(huì)誘導(dǎo)大豆蛋白的β-折疊結(jié)構(gòu)轉(zhuǎn)變?yōu)棣?螺旋和無(wú)規(guī)卷曲。可以發(fā)現(xiàn),不同的蛋白質(zhì)與多酚相互作用導(dǎo)致其二級(jí)結(jié)構(gòu)的變化也不盡相同。
2.3 等溫滴定量熱法(ITC)
等溫滴定量熱法主要用于檢測(cè)多酚與蛋白質(zhì)相互作用過程中的熱力學(xué)變化,可得到如親和力、熵、焓、比熱容以及化學(xué)計(jì)量學(xué)的信息,因此可以直接和定量測(cè)量多酚與蛋白質(zhì)之間的相互作用及其對(duì)多酚或蛋白質(zhì)結(jié)構(gòu)的影響。例如C3G與SPI的相互作用結(jié)合常數(shù)Ka較大,熵值為負(fù)值,焓值相對(duì)較低,即可分別說明二者相互作用親和力較高,反應(yīng)為焓驅(qū)動(dòng)且作用力為非共價(jià)作用[20]。
等溫滴定量熱法靈敏度高、重復(fù)性好,可一次性測(cè)定多個(gè)結(jié)合參數(shù),受沉淀影響小,但也有加熱效應(yīng)弱、測(cè)試耗時(shí)等缺點(diǎn)。
2.4 核磁共振光譜法(NMR)
核磁共振光譜法通過檢測(cè)分子結(jié)構(gòu)中標(biāo)記的碳元素的化學(xué)位移,來(lái)表明多酚與蛋白質(zhì)是否發(fā)生結(jié)合作用或構(gòu)象的改變。多酚-蛋白質(zhì)相互作用的所有結(jié)合位點(diǎn)都與特定NMR峰相關(guān)。Faurie等[23]采用NMR成功表征了糖通過螯合部分多酚,降低其與唾液蛋白結(jié)合的有效濃度,間接起到抑制澀味的過程。Lucarini等[24]也通過此技術(shù)發(fā)現(xiàn)兒茶素與膠原蛋白的結(jié)合位點(diǎn)在兒茶素B環(huán)與膠原蛋白的脯氨酸(Pro)或羥脯氨酸(Hyp)之間。
NMR可精確識(shí)別結(jié)合位點(diǎn)信息,解釋相互作用機(jī)理,但也存在需樣量大、對(duì)樣品濃度和穩(wěn)定性要求較高、圖譜解析復(fù)雜等問題。
3 蛋白質(zhì)與多酚相互作用的影響因素
3.1 溫度
在蛋白質(zhì)與多酚的體系中,溫度主要會(huì)影響氫鍵和疏水相互作用。當(dāng)溫度升高時(shí),氫鍵作用力減弱甚至消失,疏水相互作用力增強(qiáng)。大部分研究報(bào)道指出,蛋白質(zhì)對(duì)多酚的親和力隨溫度升高而降低[12]。Kaspchak等[25]研究指出,溫度升高不利于BSA與單寧酸的相互作用,并解釋可能是溫度升高使蛋白質(zhì)空間結(jié)構(gòu)改變所致。
溫度持續(xù)升高會(huì)還導(dǎo)致蛋白質(zhì)與多酚的作用形式發(fā)生改變,如Condict在[26]超高溫至140 ℃瞬時(shí)條件下研究了β-酪蛋白與阿魏酸之間的溫度誘導(dǎo)相互作用,發(fā)現(xiàn)阿魏酸在熱處理后與蛋白質(zhì)共價(jià)結(jié)合。即溫度過高會(huì)誘導(dǎo)蛋白質(zhì)與多酚之間共價(jià)鍵的產(chǎn)生。此外,溫度也會(huì)影響多酚的穩(wěn)定性,例如,紅酒和葡萄皮中的花青素在溫度升高時(shí)會(huì)發(fā)生降解[27]。
3.2 pH
pH對(duì)蛋白質(zhì)和多酚相互作用的影響較為復(fù)雜,其不僅能影響多酚與蛋白質(zhì)的結(jié)合程度;還能通過影響多酚在溶液中的化學(xué)結(jié)構(gòu)進(jìn)而影響相互作用力的種類,例如使多酚在堿性pH下產(chǎn)生自由基和醌式結(jié)構(gòu)。
在酸性條件下,多酚與蛋白質(zhì)之間的相互作用主要為非共價(jià)相互作用。這種作用在稍低于蛋白質(zhì)等電點(diǎn)時(shí)的pH環(huán)境中最強(qiáng),因?yàn)榇藭r(shí)蛋白質(zhì)與多酚的靜電排斥力最弱[1]。在堿性條件下,多酚易被氧化,從而與蛋白質(zhì)生成共價(jià)鍵,且共價(jià)結(jié)合程度隨 pH的增加而加強(qiáng)。
pH的影響效果在具體反應(yīng)中也有所差異,如Rawel等[12]發(fā)現(xiàn)在非堿性pH范圍內(nèi),當(dāng)pH升高時(shí),BSA與槲皮黃酮和沒食子酸的結(jié)合常數(shù)增加,而BSA與阿魏酸、綠原酸的結(jié)合常數(shù)減小,結(jié)合量增大。
pH還可以在一定程度上決定蛋白與多酚結(jié)合的影響因素,例如Engstrom等[28]研究了BSA與7種水解單寧或表沒食子兒茶素沒食子酸酯(EGCG)的相互作用。當(dāng)pH為7.6時(shí),單寧的氧化性是影響單寧-牛血清白蛋白絡(luò)合物形成的主要因素。然而,在稍低的pH即6.7左右,其他單寧特征,如單寧的大小和彈性,決定了高度穩(wěn)定的單寧-蛋白質(zhì)復(fù)合物的形成。
3.3 多酚化合物種類和結(jié)構(gòu)
多酚化合物自身的分子大小、形狀和所帶沒食子酰基基團(tuán)和羥基數(shù)量都會(huì)影響其與蛋白質(zhì)的反應(yīng)。Dobreva等[29]研究了不同分子量和分子形狀的鞣花單寧與BSA的相互作用,結(jié)果發(fā)現(xiàn),鞣花單寧的分子柔性越高、自由沒食子酰基越多時(shí),其與BSA的結(jié)合常數(shù)越大,結(jié)合位點(diǎn)越多。相似的,Liu等[9]發(fā)現(xiàn)玉米醇溶蛋白與EGCG和槲皮素的相互作用比與綠原酸強(qiáng)。EGCG和槲皮素的酚羥基數(shù)量多于綠原酸可能是這種現(xiàn)象發(fā)生的原因。
即使是結(jié)構(gòu)上微小的差異也會(huì)導(dǎo)致酚類與蛋白質(zhì)相互作用發(fā)生改變[30],例如Rezende等[31]研究人血清白蛋白(HSA)與白藜蘆醇(RES)及其類似物RESAn1結(jié)合的熱力學(xué)和動(dòng)力學(xué)。結(jié)果表明RES和RESAn1的結(jié)構(gòu)上的微小差異顯著影響了與HSA形成復(fù)合物的熱力學(xué)和動(dòng)力學(xué)。
此外,酚類物質(zhì)羥基的位置和甲基化也會(huì)導(dǎo)致其與蛋白質(zhì)結(jié)合親和力的改變,例如Wu等[32]用71種酚酸及其衍生物來(lái)研究其與β-乳球蛋白結(jié)合的親和性關(guān)系,研究發(fā)現(xiàn)在3位上的羥基化增加了酚酸對(duì)β-乳球蛋白的親和力,而在2位或4位上的羥基化產(chǎn)生了負(fù)面影響。用2位甲基取代羥基對(duì)結(jié)合也具有積極作用。
3.4 蛋白質(zhì)結(jié)構(gòu)和性質(zhì)
蛋白質(zhì)與多酚間的相互作用也受蛋白質(zhì)分子量、疏水性、等電點(diǎn)和氨基酸組成等因素影響。未折疊蛋白質(zhì)比致密和球形蛋白質(zhì)對(duì)多酚有更強(qiáng)的親和力[33,34]。Girard等[35]用縮合單寧(PA)與不同分子量的面筋蛋白反應(yīng)發(fā)現(xiàn)PA優(yōu)先結(jié)合更大的蛋白質(zhì)組分。這進(jìn)一步表明了多酚更傾向于與分子量大的蛋白組分反應(yīng)。
此外,蛋白質(zhì)表面的脯氨酸含量也決定了蛋白質(zhì)和多酚之間的結(jié)合能力。富含脯氨酸的蛋白質(zhì)通常分子柔性好,例如明膠的特殊結(jié)構(gòu)大大增加了肽鍵與多酚形成氫鍵的幾率[36]。Chanphai等[37]的研究成果也證明了這一點(diǎn),即三種蛋白質(zhì)對(duì)多酚的親和力順序?yàn)棣?酪蛋白>α-酪蛋白>β-乳球蛋白,其中β-酪蛋白脯氨酸含量最高。
3.5 其他因素
溶劑中鹽濃度、超聲輻射、高壓條件等因素也可以影響多酚與蛋白的相互作用。例如Kaspchak等[38]研究發(fā)現(xiàn)離子強(qiáng)度會(huì)影響B(tài)SA與單寧酸的相互作用,即高離子強(qiáng)度可使單寧酸與牛血清白蛋白之間的親和力更大。研究發(fā)現(xiàn)二價(jià)陽(yáng)離子可以增加蛋白質(zhì)與單寧結(jié)合的親和力,影響蛋白質(zhì)與單寧結(jié)合的焓和熵的變化[39]。
其他方面,Chen等[40]研究發(fā)現(xiàn)高靜水壓(HHP)可以通過改變大豆蛋白的二級(jí)結(jié)構(gòu)來(lái)影響其與茶多酚的相互作用。在HHP處理下,茶多酚使蛋白質(zhì)溶解度提高,乳化活性提高近3倍,最高可達(dá)43.5%。Zhang等[41]研究發(fā)現(xiàn),超聲處理可以有規(guī)律地影響EGCG與BSA的相互作用,并能誘導(dǎo)BSA的構(gòu)象變化。
4 多酚與蛋白質(zhì)相互作用對(duì)其性質(zhì)的影響
4.1 對(duì)加工性質(zhì)的影響
蛋白質(zhì)與多酚的相互作用會(huì)引起蛋白質(zhì)結(jié)構(gòu)的改變,包括其親-疏水性,熱穩(wěn)定性和溶解度等,從而進(jìn)一步影響蛋白質(zhì)的功能性質(zhì),包括其乳化性、起泡性等。同時(shí),蛋白質(zhì)-多酚結(jié)合物的功能性質(zhì)受蛋白質(zhì)類型、多酚類型和它們發(fā)生相互作用的環(huán)境的影響很大。
多酚和蛋白質(zhì)之間的反應(yīng)既可能促進(jìn)蛋白質(zhì)溶解[7],也可能降低它們的水溶性[10]。例如Jiang等[42]研究乳清分離蛋白和酪蛋白與綠原酸在pH 7.0的室溫下的非共價(jià)相互作用,發(fā)現(xiàn)其蛋白質(zhì)-多酚復(fù)合物的溶解性相比原蛋白得到了提高,這一發(fā)現(xiàn)可以使綠原酸應(yīng)用于乳制品中,從而改善其中蛋白質(zhì)的溶解性和起泡性,提高產(chǎn)品的氧化穩(wěn)定性。當(dāng)非極性多酚與蛋白質(zhì)發(fā)生非共價(jià)相互作用時(shí),結(jié)果則可能相反,例如縮合單寧與絲素蛋白在中性條件下形成非共價(jià)相互作用會(huì)顯著導(dǎo)致其溶解度顯著降低[10]。但由于其抗溶性提高,也增加了其在生物醫(yī)藥、食品包裝和其他領(lǐng)域的應(yīng)用價(jià)值。共價(jià)作用方面,在pH≥8.0時(shí),溶菌酶在綠原酸存在下的溶解度下降,是由于綠原酸堿性條件下氧化形成醌[43]。故蛋白質(zhì)與多酚相互作用一般會(huì)使溶解度降低,但影響也存在一定差異性。另一方面,蛋白質(zhì)與多酚的相互作用形成復(fù)合物,也有助于提高多酚的溶解性和穩(wěn)定性。Xu等[30]研究指出β-LG與蒽酮類物質(zhì)的絡(luò)合可顯著提高蒽醌類化合物的水溶性。類似地,Liu等[44]研究發(fā)現(xiàn)卵清蛋白作為載體能顯著提高姜黃素的水溶性和光穩(wěn)定性,姜黃素的溶解度比游離姜黃素提高了370倍,光穩(wěn)定性也顯著提高。
乳化性質(zhì)方面則表現(xiàn)為極性多酚與蛋白質(zhì)反應(yīng)常常能夠改善原蛋白質(zhì)的乳化性質(zhì),如Sui等[45]研究花青素與SPI的相互作用發(fā)現(xiàn)二者傾向于發(fā)生共價(jià)結(jié)合。與花青素絡(luò)合后,SPI的乳化和發(fā)泡性能得到改善,這一發(fā)現(xiàn)為花青素在豆奶飲品中的添加應(yīng)用提供了理論基礎(chǔ)。Karefyllakis等[11]也發(fā)現(xiàn)綠原酸和向日葵分離蛋白(SFPI)形成復(fù)合物對(duì)SFPI界面和乳化性質(zhì)有利,這種作用除了使乳化性質(zhì)增強(qiáng)外,還能在油水界面處增強(qiáng)其抗氧化能力,故復(fù)合物有作為胃腸道中的載體系統(tǒng)的潛力。
相互作用也會(huì)導(dǎo)致產(chǎn)物的熱穩(wěn)定性發(fā)生變化,例如Yan等[46]研究發(fā)現(xiàn)鞣花酸可以改善了卵清蛋白的熱穩(wěn)定性。此外,EGCG與SPI結(jié)合得到的共價(jià)復(fù)合物有更高的熱穩(wěn)定性,即熱變性溫度提高[47]。可以看出,蛋白質(zhì)與多酚相互作用是一種潛在的提高蛋白質(zhì)熱穩(wěn)定性的方法。
4.2 對(duì)營(yíng)養(yǎng)價(jià)值的影響
蛋白與多酚的相互作用也會(huì)影響蛋白質(zhì)的營(yíng)養(yǎng)價(jià)值和消化率,且產(chǎn)生的主要是不利影響。這主要是由于相互作用對(duì)必需氨基酸的破壞和酚類成分對(duì)消化酶活性的抑制。Zhou等[47]研究EGCG與SPI的相互作用發(fā)現(xiàn)其產(chǎn)生共價(jià)復(fù)合物的相應(yīng)抗消化能力更強(qiáng),因此在腸道消化率降低。另一方面,Sun等[48]研究多種多酚對(duì)豬胰腺α-淀粉酶(PPA)的體外活性抑制作用發(fā)現(xiàn)單寧酸、綠原酸和咖啡酸對(duì)PPA的抑制作用較強(qiáng)。證實(shí)了多酚類物質(zhì)對(duì)消化酶活性的抑制能力。Rawel等[12]通過研究類黃酮、黃酮、芹菜素、山奈酚、槲皮素和楊梅素與大豆蛋白的相互作用會(huì)導(dǎo)致大豆蛋白中的賴氨酸、半胱氨酸和色氨酸殘基的減少。由此看出多酚與蛋白質(zhì)相互作用可影響必需氨基酸的生物利用率從而改變蛋白質(zhì)的營(yíng)養(yǎng)價(jià)值。
除此之外,蛋白與多酚的相互作用也能在一定條件下起到有益作用,如Wu等[49]通過將β-LG與EGCG和綠原酸共價(jià)結(jié)合成功降低了β-LG的致敏性。
4.3 對(duì)抗氧化活性的影響
抗氧化活性也是蛋白質(zhì)多酚復(fù)合物的重要性質(zhì)之一。大量研究表明,不論形成共價(jià)或非共價(jià)復(fù)合物,其抗氧化活性都顯著高于對(duì)照蛋白。Jiang等[42]研究發(fā)現(xiàn),高濃度綠原酸和兩種蛋白質(zhì)在中性條件下形成的非共價(jià)復(fù)合物均表現(xiàn)出相較于對(duì)照蛋白更強(qiáng)的清除自由基活性。Zhou等[47]則用SPI與EGCG堿性條件下共價(jià)結(jié)合,生成的復(fù)合物抗氧化活性更高。同樣的,Ma等[10]的研究也有相似的結(jié)論,絲素蛋白-單寧復(fù)合膜展現(xiàn)出了絲素蛋白本身不存在的抗氧化活性,且其活性與單寧濃度呈正相關(guān)。蛋白質(zhì)與多酚復(fù)合物的抗氧化活性由于多酚中的羥基引入蛋白質(zhì)中而增加。Wu等[32]研究酚酸與β-乳球蛋白相互作用發(fā)現(xiàn)酚酸-β-乳球蛋白復(fù)合物的抗氧化活性高于單獨(dú)的酚酸,推測(cè)是β-乳球蛋白與酚酸的抗氧化活性產(chǎn)生的協(xié)同作用。因此,蛋白質(zhì)多酚復(fù)合物可以用來(lái)增強(qiáng)抗氧化性能,改善食品的氧化穩(wěn)定性。
5 結(jié)論與展望
蛋白質(zhì)和多酚都有其獨(dú)特的功能特性和營(yíng)養(yǎng)價(jià)值。蛋白質(zhì)除了作為營(yíng)養(yǎng)物質(zhì)外還擁有乳化性和起泡性等加工特性;多酚具有生物活性,與蛋白質(zhì)有較高親和度的同時(shí)還對(duì)人體健康有利。蛋白質(zhì)與多酚的相互作用受到環(huán)境條件以及蛋白質(zhì)和多酚的類型或結(jié)構(gòu)的影響,并且會(huì)引起其加工性質(zhì)、營(yíng)養(yǎng)價(jià)值、抗氧化活性等方面的變化。蛋白質(zhì)與多酚的相互作用能夠拓寬蛋白和多酚的應(yīng)用領(lǐng)域,賦予其新的價(jià)值,并可能進(jìn)一步影響其所在食品體系,如增強(qiáng)食品的抗氧化活性、改善乳化性、改變營(yíng)養(yǎng)價(jià)值等。因此,可通過研究來(lái)自不同食物來(lái)源的蛋白質(zhì)和多酚的結(jié)合,以開發(fā)具有更好的營(yíng)養(yǎng)、功能、感官質(zhì)量以及生物活性的新食物成分或產(chǎn)品。

