γ-聚谷氨酸對大豆分離蛋白熱穩定性的影響
齊 蕾 仵心軍 徐 超,2 張波波 沈 玥 艾志錄,2 謝新華,2
(河南農業大學食品科學技術學院1,鄭州 450002) (農業農村部大宗糧食加工重點實驗室2,鄭州 450002) (鄭州市食品藥品檢驗所3,鄭州 450006)
大豆分離蛋白(soybean protein isolate,SPI)是大豆中主要的蛋白成分,與大多數谷物蛋白相比,含有人體必需的八種氨基酸,是一種優質的植物蛋白,在食品工業中應用廣泛[1]。在實際生產中,干熱處理會使蛋白發生一定程度的變性,不利于蛋白功能性質的保持[2,3]。有很多研究通過蛋白質與聚電解質的靜電復合來抑制蛋白受熱后變性聚集的現象,提高蛋白的熱穩定性。Jones等[4]研究發現,熱處理后β-乳球蛋白與果膠的復合物在廣泛的pH內均具有良好的穩定性;Xiong等[5]通過對卵白蛋白-羧甲基纖維素熱誘導的凝膠行為分析,發現隨著羧甲基纖維素添加量的增大,熱處理后的卵白蛋白的聚集體逐漸消失;Chang等[6]的研究結果也表明,添加殼聚糖提高了油菜分離蛋白的峰值變性溫度和變性焓值,提高了蛋白的熱穩定性。
γ-聚谷氨酸(γ-polyglutamic acid, γ-PGA)是一種由D-或L-谷氨酸通過α-氨基和γ-羧基形成γ-酰胺鍵結合而成的陰離子聚電解質,具有良好的水溶性、增稠性、保水性及可食用性,在食品工業中應用廣泛[7,8]。在pH 3.5時SPI與γ-PGA帶有相反的電荷,可形成較多靜電復合物,為提高大豆分離蛋白的熱穩定性,本文在此條件下對不同濃度及不同水浴加熱時間下復合物的濁度值、粒徑、ζ-電位以及蛋白表面疏水性進行測定,分析γ-聚谷氨酸對大豆分離蛋白熱穩定性的影響,為γ-聚谷氨酸在酸性大豆分離蛋白溶液中的應用提供理論依據。
1 材料與方法
1.1 實驗材料
大豆分離蛋白(蛋白質量分數為90%)、γ-聚谷氨酸(食品級)、8-苯氨基-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid, ANS);鹽酸(HCl)和氫氧化鈉(NaOH)均為分析純。
1.2 儀器與設備
5430R型高速冷凍離心機,752型紫外可見光分光光度計,LS 13 320型激光衍射粒度分析儀,Zetasizer Nano S90型電位儀,Lumina型熒光分光光度計。
1.3 方法
1.3.1 SPI溶液與γ-PGA復合體系的制備
將SPI和γ-PGA粉末分別溶于蒸餾水中,在室溫下攪拌2 h,得到質量濃度為10 g/L 的SPI溶液和γ-PGA溶液作為儲液[9]。分別取合適體積的SPI和γ-PGA儲液混合,用蒸餾水稀釋至所需濃度,使大豆分離蛋白的質量濃度恒定為5.0 g/L,γ-PGA的質量濃度分別為0.5、2.0、5.0 g/L,制備完成后用2 mol/L的HCl以及NaOH調節復合溶液的pH值至3.5。
1.3.2 水浴加熱過程
將復合溶液于80 ℃下進行水浴加熱,加熱時間分別為1 min(T1),2 min(T2),3 min(T3)和 4 min(T4)。將未經加熱的復合物(T0)作為對比[10]。
1.3.3 濁度的測定
將制備好的不同濃度的樣品搖勻,取2 mL樣品倒入比色皿中,用蒸餾水作為空白對照,使用分光光度計于600 nm處測定其吸光度值,測定溫度為25 ℃[11]。
1.3.4 粒徑的測定
復合物的粒徑大小使用Beckman Coulter激光粒度分析儀在室溫下進行測定,采用通用液體模塊,設置運行長度為60 s,由3個獨立樣品的3次進樣計算出體積加權平均直徑D[4,3][12]。
1.3.5 ζ-電位的測定
采用Malvern Nano ZS 90對復合體系的ζ-電位進行測定,選擇電位測量模式,將復合溶液放入測量池中進行測定,分散介質選擇為水,樣品平衡時間為120 s,測定溫度為25 ℃[13]。
1.3.6 表面疏水性的測定
使用ANS熒光探針法測定蛋白表面疏水性。將制備好的不同濃度的樣品在4 000 r/min的速度下離心20 min,其上清液用pH 3.5的蒸餾水稀釋,并使用Lowry法測定稀釋后上清液中蛋白質的質量濃度,使之達到0.07~0.67 mg/mL之間。取稀釋后的樣品4 mL,加入50 μL 8 mmol/L 的ANS溶液,將其充分混勻后靜置10 min,在330 nm的激發波長和490 nm的發射波長下測定其熒光強度,狹縫設置為5 nm。以蛋白質質量濃度為橫坐標,熒光強度為縱坐標作圖,曲線初始階段的斜率即為蛋白質分子的表面疏水性[14]。
1.4 數據分析
每組樣品重復3次測量,使用SPSS16.0對所得數據進行統計分析,用Origin8.0進行繪圖。
2 結果與分析
2.1 SPI-γ-PGA復合物的濁度分析
由圖1可知,水浴加熱前隨γ-PGA質量濃度從0.5 g/L提高至5.0 g/L,復合物濁度值由1.91顯著增加至2.43,但結合圖2中復合物粒徑變化情況可知,隨著γ-PGA的增加,復合物的粒徑在γ-PGA質量濃度為2.0 g/L時達到峰值,而當質量濃度比為5.0 g/L時粒徑減小至1.68μm。其原因可能是隨著γ-PGA的增加, SPI分子可以結合越來越多的γ-PGA分子,并使之形成復合物,其濁度值及粒徑增大,但當帶有大量負電荷的γ-PGA持續增加時,復合體系中靜電斥力增大,形成了相當數量粒徑較小的復合物,因此復合物的粒徑減小但濁度值并未降低[15]。
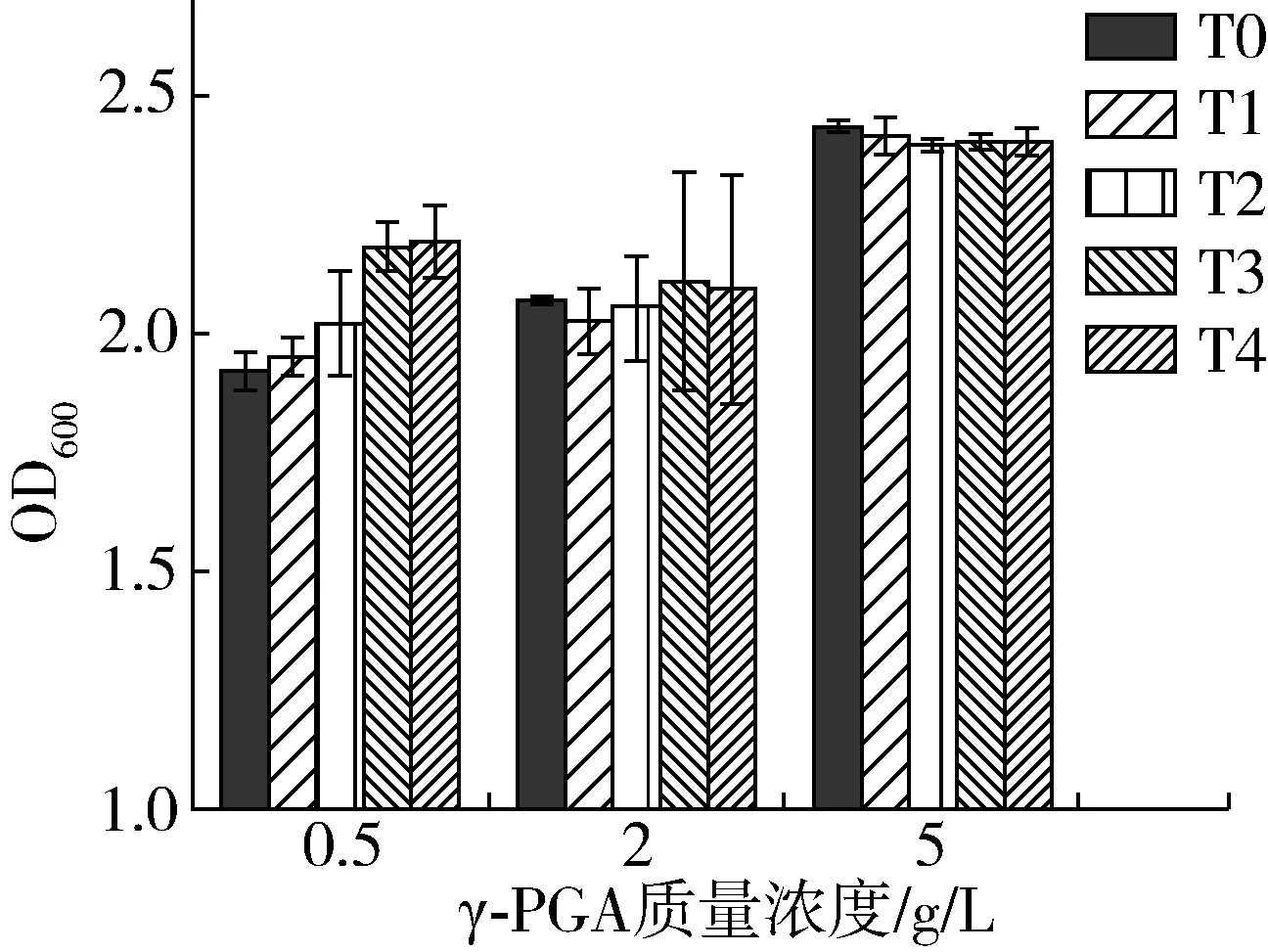
圖1 SPI-γ-PGA復合物在水浴加熱前后的濁度
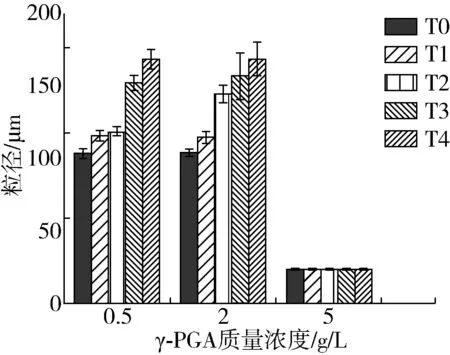
圖2 SPI-γ-PGA復合物在水浴加熱前后的粒徑
隨著水浴加熱時間的增加,γ-PGA質量濃度為0.5 g/L時復合物濁度值由1.91逐步增加至2.20,γ-PGA質量濃度增加為2.0 g/L時,其濁度值的增長趨于平緩,當γ-PGA持續增加至5.0 g/L時,復合物的濁度值略有降低。這是因為加熱使蛋白分子空間結構發生改變,分子間互相靠近聚集,引起復合體系濁度值增高[16],隨γ-PGA加入后與SPI形成大量靜電復合物,提高了蛋白的溶解度從而抑制了濁度值的顯著升高,當γ-PGA持續添加至5.0 g/L時,體系中具有較強的靜電排斥力,抑制了蛋白分子間的熱聚集,提高了SPI分子熱穩定性[17]。
2.2 SPI-γ-PGA復合物的粒徑分析
蛋白分子的粒徑大小直接影響其聚集程度,粒徑越小,蛋白分子分散越均勻,體系越穩定[17]。由圖2可知,水浴加熱前,隨著γ-PGA的增加,SPI-γ-PGA復合物的粒徑在γ-PGA質量濃度為2.0 g/L時達到最大值為92.33 μm,而當其質量濃度達到5.0 g/L時顯著減小至1.68 μm,這是由于γ-PGA加入后與SPI分子結合形成了尺寸較大的復合物,復合物的粒徑增大,但當γ-PGA持續增加至5.0 g/L時,高濃度的γ-PGA使復合體系中有較多的負電荷,靜電斥力增強,引起復合物的粒徑減小[18]。
隨著水浴加熱時間的增加,γ-PGA質量濃度為0.5 g/L時復合物粒徑由90.54 μm增至163.66 μm,當其質量濃度為2.0 g/L時復合物粒徑從92.34 μm增大至164.08 μm,而在5.0 g/L下,復合物粒徑從1.68 μm降低至1.38 μm,綜合圖1中復合物濁度值隨水浴加熱時間的變化情況可知,當γ-PGA濃度較低時,蛋白分子過量,加熱使較多的蛋白分子發生了熱聚集,粒徑增大;隨著γ-PGA的增加,熱處理使SPI與γ-PGA形成的靜電復合物進一步聚集,因此當γ-PGA質量濃度為2.0 g/L時復合物濁度并未發生明顯變化但粒徑卻有顯著增長;但當γ-PGA質量濃度達到至5.0 g/L時,分子間靜電斥力較強,導致聚集物發生一定程度的解離,其粒徑減小[19]。
2.3 SPI-γ-PGA復合物的ζ-電位分析
SPI與γ-PGA之間的相互作用力主要是靜電相互作用力,復合物的表面電荷對于體系的穩定性具有重要意義,當溶液體系的ζ-電位絕對值升高時,溶液的斥力位能增加,分子熱運動所需要克服的能壘加大,體系因此變得更加穩定[20]。由圖3可知,隨著γ-PGA添加量的增大,SPI-γ-PGA復合物的ζ-電位由4.51 mV逐步降低至-27.53 mV。這是因為隨著γ-PGA濃度的提高,大豆分離蛋白攜帶的正電荷被部分γ-PGA的負電荷所中和,其余的γ-PGA分子分散在體系中,體系中凈負電荷較多,ζ-電位的絕對值增大,復合體系分散性更好,更為穩定[21]。
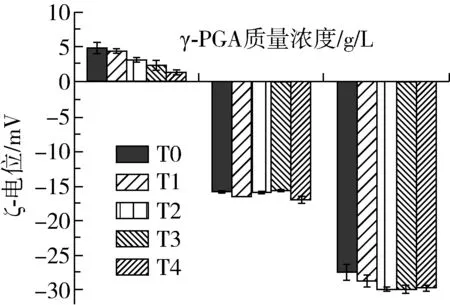
圖3 SPI-γ-PGA復合物在水浴加熱前后的ζ-電位
水浴加熱處理后,復合體系的ζ-電位隨著加熱時間的增加而逐步降低,在γ-PGA質量濃度為5.0 g/L時,這種降低趨勢得到了抑制。其原因可能是加熱使蛋白分子發生了一定程度的展開,γ-PGA的陰離子基團以及蛋白分子的疏水性氨基酸在熱處理后暴露,使復合物表面電勢降低[22],γ-PGA加入后可與SPI形成靜電復合物,對蛋白分子具有保護作用,有助于抑制SPI分子因受熱發生變性,γ-PGA添加至5.0 g/L時,較多的凈負電荷使體系中靜電斥力增強,更有利于體系的穩定。
2.4 大豆分離蛋白的表面疏水性分析
由圖4可知,水浴加熱之前,添加γ-PGA顯著降低了大豆分離蛋白的表面疏水性,且當γ-PGA質量濃度增大至5.0 g/L時蛋白表面疏水性降至最低,這是因為γ-PGA攜帶有負電荷,它與蛋白分子通過靜電相互作用形成復合物,減少了SPI分子表面疏水基團的暴露,且當γ-PGA濃度較高時,SPI分子表面的疏水位點也會被γ-PGA分子掩蓋,從而減弱了疏水作用力,使蛋白分子表現出更加親水的特性,抑制了蛋白分子的聚集[23]。
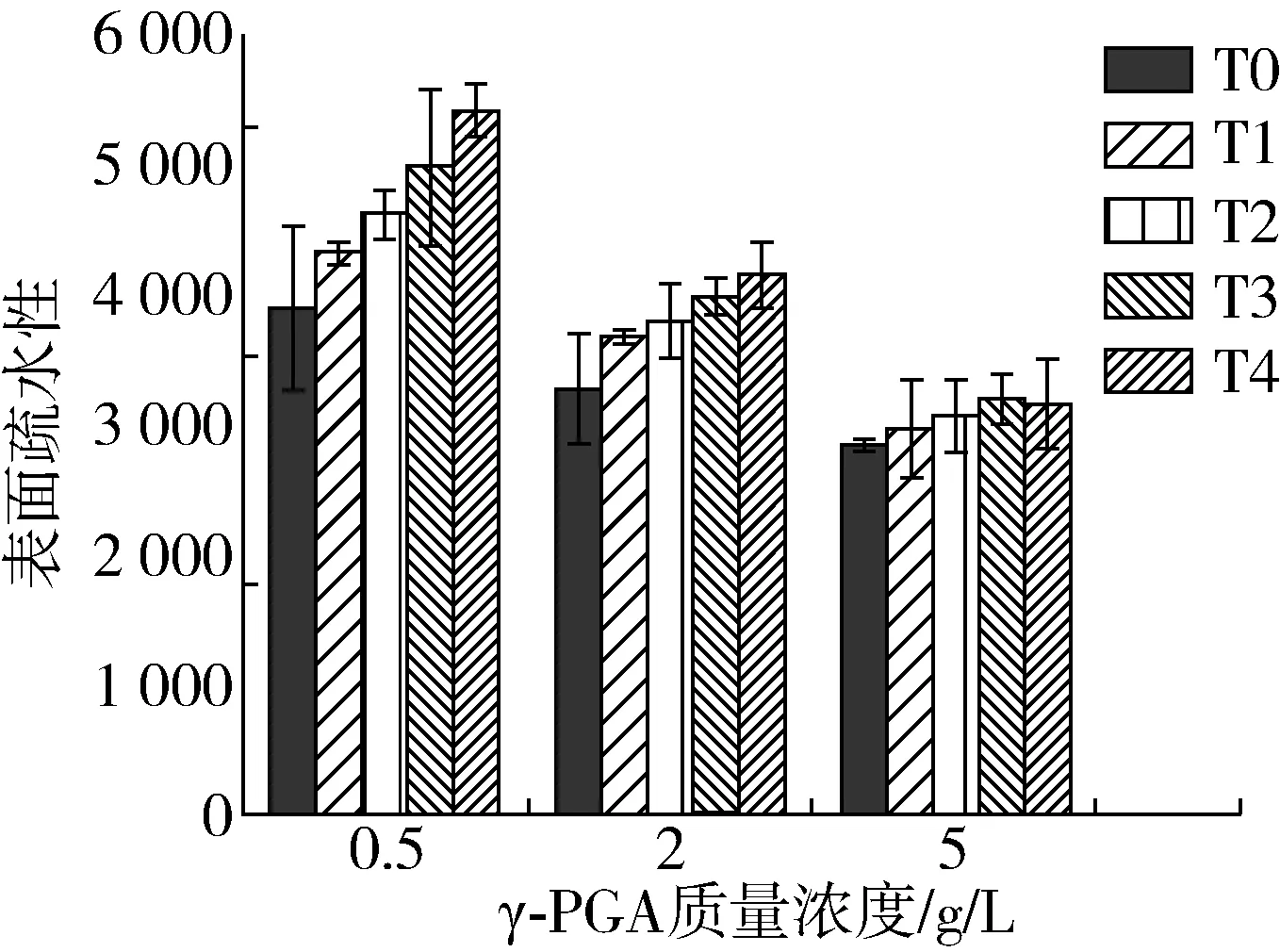
圖4 大豆分離蛋白在水浴加熱前后的表面疏水性
水浴加熱后,隨著加熱時間的增加,γ-PGA質量濃度為0.5 g/L時蛋白表面疏水性數值由3 907.62升高至5 419.39,當γ-PGA質量濃度增加至5.0 g/L時,其表面疏水性數值升高的趨勢趨于平緩,這可能是水浴加熱導致蛋白發生解折疊,埋藏在內部的疏水性殘基暴露到分子外部,表面疏水性升高[24],當γ-PGA加入后與蛋白相互作用形成了靜電復合物,減少了SPI疏水基團的暴露,且較多的γ-PGA分子也起到了掩蓋蛋白分子表面疏水位點的作用,從而減弱了疏水作用力,有利于抑制蛋白受熱后結構的變化。
3 結論
隨γ-PGA濃度的增加,SPI-γ-PGA復合物的濁度值增大,但在γ-PGA質量濃度達到5.0 g/L時其粒徑顯著降低,且復合體系中ζ-電位及蛋白表面疏水性均降至最低,表明添加γ-PGA提高了復合體系的穩定性。水浴加熱處理后復合物的濁度值和粒徑增大,其表面電勢降低,蛋白表面的疏水基團暴露,蛋白分子易變性發生聚集,隨加熱時間的增加這種變化更為明顯,當γ-PGA質量濃度增加至5.0 g/L時,復合體系中具有較強的靜電斥力,有效抑制了SPI分子因熱處理發生的凝聚,提高了大豆分離蛋白的熱穩定性。

