基于LIN28A/NF-κB信號通路研究狗肝菜多糖緩解肝纖維化的作用機制
鄭董璇,張可鋒,晉 玲,鐘明利,趙唐蓮,曹后康,段小群*,高 雅*
1桂林醫學院藥學院,桂林 541004;2甘肅中醫藥大學藥學院,蘭州 730000
肝纖維化(hepatic fibrosis,HF)是由各種有害刺激,包括病毒感染、藥物毒性、酒精和自身免疫性肝病的持續傷口愈合反應對肝臟損傷所致[1]。它是慢性肝病的重要病理標志,是肝硬化發生的關鍵事件,也是終末期肝細胞癌和晚期肝硬化的主要病因[2,3]。秋水仙素作為肝纖維化和肝硬化的臨床用藥,主要抑制肝星狀細胞早期的活化與增殖,促進肝星狀細胞凋亡,干擾膠原代謝,針對不同病因導致的HF秋水仙素治療效果不一,并且秋水仙素會引起許多副作用,例如腹痛、惡心、食欲不振等,高劑量服用后還會導致肝腎功能衰竭[4],因此仍需研究并開發新的安全有效的治療藥物。狗肝菜(Diclipterachinensis(L.) Juss)作為中國傳統中藥材,味甘性涼,具有清熱,涼血,利尿,解毒平肝等功效,對CCl4、D-氨基半乳糖鹽酸和脂多糖等多種類型的肝損傷模型具有緩解作用[5];本課題組在先前研究中發現,狗肝菜多糖(DCP)對肝臟脂質代謝紊亂尚有良好的抑制作用,其機理主要與緩解炎癥反應和抑制氧化應激有關[6]。LIN28A是一種高度保守的RNA結合蛋白,在誘導多能干細胞、調節發育、細胞生長和代謝等方面發揮著重要作用,在諸如食道癌[7]、卵巢癌[8]等多種癌細胞中,均發現存在LIN28A的過表達現象。有研究表明,肝臟特異性缺失LIN28A可緩解小鼠肝細胞癌并有效延長患癌小鼠壽命[9],這提示LIN28A可能成為治療肝細胞癌或肝臟疾病的潛在靶點。但目前尚無文獻報道其與HF的關聯性,此文章旨在探索LIN28A與HF的關聯性并研究DCP能否通過抑制LIN28A起到保護肝臟的作用。
1 材料與試劑
1.1 試驗藥物與試劑
狗肝菜多糖(由本課題組所在實驗室提取制備[6]);分析純CCl4(廣東汕頭市西隴化工廠);SDS-PAGE蛋白上樣緩沖液(南通市碧云天生物技術研究所);秋水仙素(上海如吉生物科技發展有限公司,純度>99%);PVDF膜(Bio-Rad公司,美國);LIN28A抗體、核因子-κB p65(NF-κBp65)抗體、轉化生長子-β1(TGF-β1)、抗體基質金屬蛋白酶-9(MMP9)抗體、α-平滑肌肌動蛋白(α-SMA)抗體、環氧化酶-2(COX-2)抗體和誘導型一氧化氮合酶(iNOS)抗體(Abcam,英國);GAPDH抗體(Abcam,英國);辣根標記的山羊抗兔二抗、辣根標記的山羊抗鼠二抗(Bioworld,美國);Super ECL Plus超敏發光液(上海雅酶生物科技有限公司);PCR檢測試劑盒(EZbioscience,美國);透明質酸(HA)ELISA試劑盒(上海江萊生物科技有限公司);Ⅳ型膠原蛋白(Ⅳ-C)、Ⅲ型前膠原(PC Ⅲ)ELISA試劑盒(上海賽默生物科技發展有限公司);層粘連蛋白(LN)ELISA試劑盒(武漢伊萊瑞特生物科技有限公司);RIPA裂解液(上海碧云天生物技術有限公司);PMSF(北京索萊寶科技有限公司)、BCA蛋白濃度測定試劑盒(上海碧云天生物技術有限公司)。
1.2 動物
60只SPF級SD大鼠,雄性,體重180~220 g,購買于湖南斯萊克景達實驗動物有限公司,許可證號SCXK(湘)2016-0002。
1.3 儀器
ZD-9550臺式振蕩器(海門市其林貝爾儀器制造有限公司);Centrifuge 5424R臺式高速冷凍離心機(Eppendorf公司,德國);O1ympus BX51顯微鏡(奧林巴斯公司,日本);SpectraMax i3X酶標儀(美谷分子儀器(上海)有限公司);電泳基礎電源(Bio-Rad公司,美國);7500 RT-PCR system(ThermoFisher公司,美國);CLINX化學發光成像系統(上海勤翔科學儀器有限公司)。
2 方法
2.1 造模與給藥
60只雄性SD大鼠適應性喂食1周后,隨機分成6組,即正常組、模型組、秋水仙素(0.12 mg/kg)組、DCP低劑量(DCP low dose,DCP-L;50 mg/kg)組、DCP中劑量(DCP medium dose,DCP-M;100 mg/kg)組和DCP高劑量(DCP high dose,DCP-H;200 mg/kg)組,每組10只。除正常組外,其余大鼠均每周腹腔注射2次40%的CCl4橄欖油溶液(1 mL/kg),建立HF大鼠模型,正常組大鼠以相同劑量腹腔注射純橄欖油。每日根據體重,給予秋水仙素組和DCP低中高劑量組大鼠相應的藥物治療,正常組與模型組大鼠按照相同計算方式灌胃蒸餾水,持續6周。末次給藥后,所有大鼠禁食不禁水16 h,乙醚麻醉后腹腔靜脈取血,收集肝臟。
2.2 檢測肝臟病理學
取各組大鼠相同位置1 cm正方大小的肝臟,浸泡于4%多聚甲醛組織固定液中48 h,進行包埋切片后,攤片烘片,脫蠟至水,蘇木精-伊紅(hematoxylin and eosin,H&E)染色和Masson染色后在O1ympus BX51光學顯微鏡下觀察組織病理變化。
2.3 DCP對HF大鼠血清HA、LN、PC Ⅲ和Ⅳ-C的影響
大鼠血液室溫靜置2 h后,于4 ℃條件下,4 500 rpm離心10 min后取上層血清。采用酶聯免疫吸附測定法(ELISA),嚴格按照檢測試劑盒說明書測定血清中HA、LN、PC Ⅲ和Ⅳ-C含量。
2.4 檢測肝臟炎癥因子
采用酶聯免疫吸附測定法(ELISA),嚴格按照檢測試劑盒說明書(武漢伊萊瑞特生物科技有限公司)測定大鼠肝臟中IL-1β、IL-6和TNF-α含量。稱取肝臟組織(80~100 mg),按質量體積比1∶9加入裂解液,冰水浴中電動勻漿機破碎,于4 ℃條件下,12 000 rpm離心15 min后取上清保存作為檢測樣品。嚴格按照試劑盒說明書進行肝臟組織中IL-1β、IL-6和TNF-α的含量測定。
2.5 測定mRNA相對含量
采用聚合酶鏈式反應(PCR)測定肝臟組織中α-SMA、TGF-β1、LIN28A、NF-κBp65、MMP9、COX-2和iNOS的相對含量。取各組大鼠肝臟組織約100 mg,準確加入1 mL Trizol(ThermoFisher公司,美國),冰上研磨。加入0.2 mL氯仿劇烈震蕩后靜置5 min,4 ℃下10 000 rpm離心15 min,取上層水相加入等體積的異丙醇,靜置10 min后4 ℃下10 000 rpm離心10 min,棄上清并用預冷75%乙醇洗滌RNA沉淀,4 ℃下5 000 rpm離心5 min,棄上清。離心管干燥5 min后加入0.2 mL去酶水,置于55 ℃水浴鍋中10 min,制備RNA樣品。上機逆轉錄制備cDNA樣品,嚴格按照試劑盒要求,以GAPDH作為內參,進行肝臟組織中α-SMA、TGF-β1、LIN28A、NF-κBp65、MMP9、COX-2和iNOS的相對含量測定。各基因的引物序列見表1。
2.6 測定大鼠肝臟蛋白表達
采用蛋白免疫印跡法(Western blot)測定肝組織中LIN28A、α-SMA、TGF-β1、NF-κBp65、MMP9、COX-2和iNOS蛋白的表達水平。取各組大鼠肝組織約60 mg,加入含1%PMSF的RIPA裂解液1 mL冰上研磨至無肉眼可見組織,4 ℃條件下12 000 rpm離心10 min后收集上清液。另取少量上清,按照試劑盒說明書通過BCA法測定蛋白含量。按相應比例加入Loading buffer,沸水浴10 min后備用。
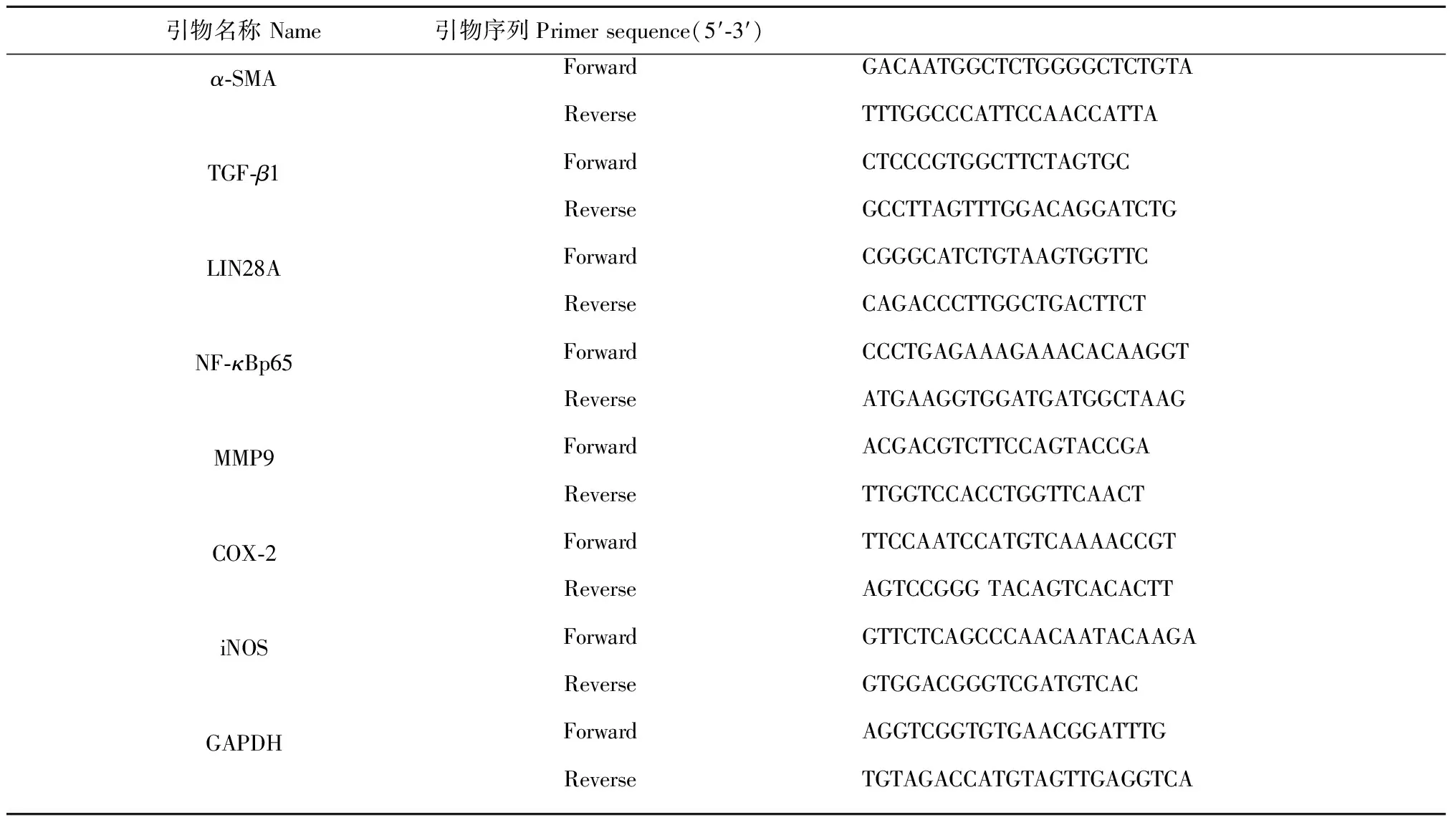
表1 引物序列
根據蛋白含量測定結果,調整蛋白樣品上樣量后進行10% SDS-PAGE凝膠電泳。于200 mA冰水浴轉膜2 h,5%封閉液封閉2 h。加入相應一抗(稀釋比例均為1∶1 000),4 ℃下搖床過夜;次日,TBST洗滌,條件同上,根據一抗基源動物加入山羊抗兔或山羊抗鼠二抗(稀釋比例為1∶5 000),室溫下孵育2 h,TBST洗滌3次,滴加顯色液,使用CLINX化學發光成像系統顯影,使用Quantity One對條帶進行灰度分析并計算蛋白相對表達量。
2.7 數據統計學分析

3 結果與分析
3.1 DCP對HF大鼠肝臟形態的影響
H&E染色結果顯示,正常組大鼠肝小葉結構完整,肝細胞排列整齊且飽滿。模型組大鼠肝小葉結構受損,且伴大量炎性細胞浸潤。相較于模型組,秋水仙素組和DCP低中高劑量大鼠肝小葉清晰,肝細胞變性現象有所改善,表明DCP可改善CCl4造成的大鼠肝臟損傷進而減緩纖維化進程(見圖1)。
Masson染色結果顯示,正常組大鼠肝臟肝細胞致密排列,無明顯藍色膠原沉積。模型組大鼠肝組織出現大量膠原沉積,有嚴重的纖維化現象。相較于模型組,秋水仙素組和DCP低中高劑量組肝臟病變有不同程度的減輕,且DCP高劑量組減輕程度明顯(見圖2)。
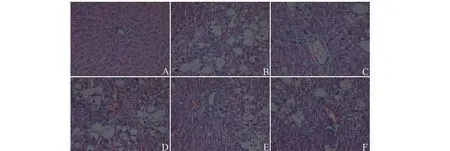
圖1 大鼠肝臟切片的HE染色(×200)Fig.1 Photomicrograph of rats liver sections stained with H&E (×200)注:A:正常組;B:模型組;C:秋水仙素組;D:DCP-L;E:DCP-M;F:DCP-H;下同。Note:A:Normal group;B:Model group;C:Colchicine group;D:DCP-L;E:DCP-M;F:DCP-H;The same below.
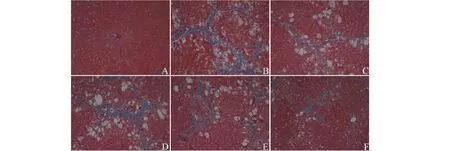
圖2 大鼠肝臟切片的Masson染色(×100)Fig.2 Photomicrograph of rats liver sections stained with Masson (×100)
3.2 DCP對HF大鼠血清HA、LN、PC Ⅲ和Ⅳ-C的影響
相較于正常組,模型組大鼠血清中HA、LN、PC Ⅲ和Ⅳ-C含量均有顯著升高,差異均有統計學意義(P< 0.01),說明肝細胞通透性改變,提示造模成功。相較于模型組大鼠,DCP低中高劑量組大鼠血清中上述指標均有不同程度的降低,且DCP高劑量組各指標均有明顯下降,差異具有統計學意義(P< 0.05),提示DCP可緩解由CCl4造成的大鼠肝細胞損傷(見表2)。
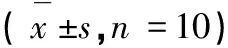
表2 DCP對血清中HA、LN、PC Ⅲ和Ⅳ-C的影響
3.3 DCP對HF大鼠肝臟中IL-1β、IL-6和TNF-α的影響
模型組大鼠肝臟中IL-1β、IL-6和TNF-α含量較正常組大鼠均有顯著升高,差異均有統計學意義(P< 0.01)。DCP低中高劑量組大鼠肝臟中IL-1β、IL-6和TNF-α的含量較模型組大鼠均有不同程度的降低,且DCP高劑量組各指標均有明顯下降,差異具有統計學意義(P< 0.05),此結果表示DCP可緩解CCl4引起的肝臟炎癥反應和炎癥介質的釋放(見表3)。
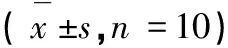
表3 DCP對肝臟中IL-1β、IL-6和TNF-α的影響
3.4 PCR檢測LIN28A、α-SMA、TGF-β1、NF-κBp65、MMP9、COX-2和iNOS
相較于正常組,模型組大鼠肝組織中α-SMA、TGF-β1、LIN28A、NF-κBp65、MMP9、COX-2和iNOS的mRNA相對含量均顯著升高,差異均具有統計學意義(P< 0.01);相較于模型組大鼠,DCP低中高劑量組均可明顯抑制上述蛋白的mRNA相對含量,差異均具有統計學意義(P< 0.01),此結果表明DCP抗肝纖維化可能與LIN28A/NF-κBp65信號通路有關(見表4、5)。
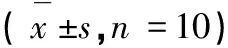
表4 DCP對肝臟中α-SMA和TGF-β1mRNA相對含量的影響
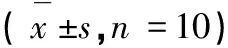
表5 DCP對肝臟中LIN28A、NF-κBp65、MMP9、COX-2和iNOSmRNA相對含量的影響
3.5 Western blot檢測LIN28A、α-SMA、TGF-β1、NF-κBp65、MMP9、COX-2和iNOS
相較于正常組,模型組大鼠肝組織中LIN28A、α-SMA、TGF-β1、NF-κBp65、MMP9、COX-2和iNOS蛋白表達量均顯著升高,差異均具有統計學意義(P< 0.01);DCP低中高劑量組較模型組大鼠均可不同程度抑制上述蛋白的表達,差異均具有統計學意義(P< 0.01),此結果再次驗證DCP可能通過LIN28A/NF-κB信號通路起到抗肝纖維化作用(見圖3)。
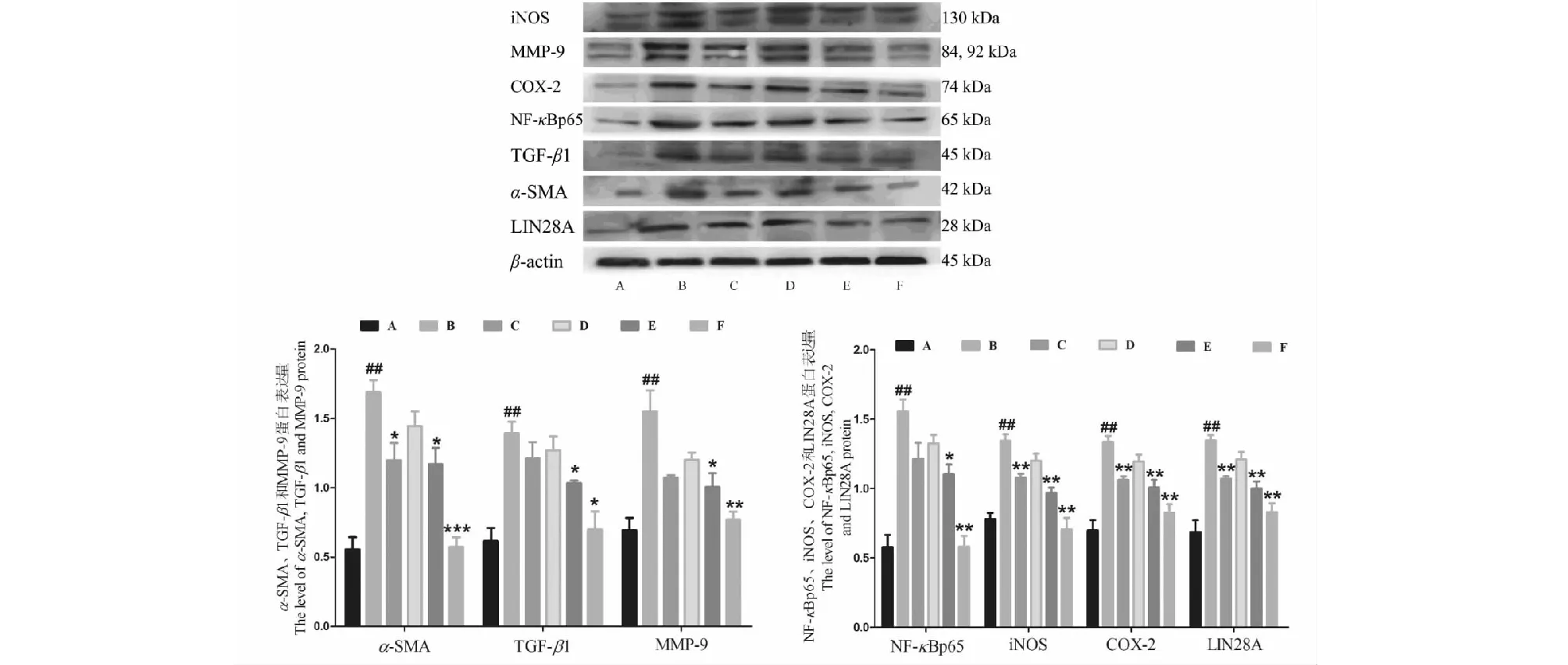
圖3 DCP對TGF-β1、α-SMA、LIN28A、NF-κBp65、MMP9、COX-2和iNOS蛋白表達的影響Fig.3 Effect on the TGF-β1, α-SMA, LIN28A, NF-κBp65, MMP9, COX-2 and iNOS protein of DCP
4 討論
肝纖維化是一種病理病變,以細胞外基質(ECM)在肝周隙的進行性積聚為特征,是慢性肝病的主要問題[10]。由于其最終會導致肝硬化,成為世界范圍內發病和死亡的主要原因,據估計全球2%的人口會受到肝硬化的影響[11]。因此,研究DCP對肝臟的保護作用具有重要意義。
該實驗采用CCl4誘導肝纖維化,其造成的病理改變與人體臨床HF極為相似[12,13]。HA、LN、PC Ⅲ和Ⅳ-C是肝細胞外基質的主要成分,在肝纖維化中由于細胞外基質合成增多、降解不足,故其指標水平升高程度與肝纖維化程度呈現正相關[14]。本研究中,模型組大鼠HA、LN、PC Ⅲ和Ⅳ-C含量明顯上升,H&E染色與Masson染色結果顯示模型組大鼠肝臟組織脂肪變性和膠原沉積現象明顯,提示造模成功。DCP給藥后,大鼠血清中HA、LN、PC Ⅲ和Ⅳ-C含量顯著下降,H&E染色病理改變有所緩解,顯示DCP對肝臟以及肝細胞具有保護作用。
NF-κB是一種核轉錄因子,調控大量對細胞凋亡和炎癥的調節有重要作用的基因[15]。當肝臟發生炎癥反應時,NF-κB被激活并釋放TNF-α、IL-6和IL-1β等炎癥因子,導致肝組織炎癥反應加劇[16]。在炎癥部位誘導酶COX-2和iNOS表達也會提高,產生過度的炎癥反應,也作為炎癥標志物。實驗結果顯示,模型組大鼠肝組織NF-κBp65、COX-2和iNOS的mRNA相對含量和蛋白表達水平顯著提高,并且TNF-α、IL-6和IL-1β的mRNA相對含量也有明顯升高;相較于模型組,DCP低中高劑量各組大鼠肝組織NF-κBp65、COX-2和iNOS的mRNA相對含量和蛋白表達水平顯著降低,炎癥因子TNF-α、IL-6和IL-1β的mRNA相對含量也有不同程度下降。此結果表明DCP可通過抑制NF-κBp65蛋白表達,減少下游炎癥因子的釋放而發揮抗炎作用。
TGF-β1是一種多效細胞因子(促纖維化和炎癥因子),參與免疫反應和肝纖維化的發展。TGF-β1可導致肝星狀細胞(HSCs)的活化、增殖和纖維化過程[17]。α-SMA可反映HSC的活化情況,作為HSC激活的標志性蛋白,同時也可用于評估肝纖維化程度。基質金屬蛋白酶(MMPs)是細胞外基質降解和重構的關鍵因素。MMP9是降解正常肝基質最相關的MMPs之一,可促進肝纖維化的發展[18]。Western Blot分析顯示,模型組大鼠肝組織TGF-β1、α-SMA和MMP9的蛋白表達水平顯著提高;相較于模型組,DCP低中高劑量各組大鼠肝組織TGF-β1、α-SMA和MMP9的蛋白表達水平顯著降低。此結果表明DCP可通過減少CCl4引起的肝組織TGF-β1和MMP9蛋白表達,減緩肝臟內膠原沉積的速度,從而起到緩解HF的作用。
LIN28A基因可以通過其獨特的冷休克結構域(CSD)和半胱氨酸半胱氨酸組氨酸半胱氨酸鋅指節結構域的配對被識別,在序列特異性mRNA結合、miRNA結合、miRNA前處理以及miRNA調控基因沉默中起著重要的作用[19]。已有研究證明LIN28A通過NF-κBp65信號通路參與炎癥反應[19],并且降低NF-κBp65的表達有助于緩解HF。在實驗中,相較于正常組,模型組大鼠肝臟中LIN28A和NF-κBp65的蛋白表達水平和mRNA相對含量顯著提高,且DCP低中高劑量各組大鼠肝組織中LIN28A和NF-κBp65的蛋白表達水平和mRNA相對含量顯著降低且呈現出濃度依賴性。以上結果表明HF炎癥產生的過程可能與LIN28A的激活有關,結合DCP可以抑制LIN28A和NF-κBp65的表達,并抑制NF-κBp65下游COX-2、iNOS、TNF-α、IL-6和IL-1β等炎癥因子的表達,推測DCP抗炎和治療HF的機制可能與通過抑制LIN28A/NF-κB信號通路有關。
綜上所述,DCP對大鼠HF具有明顯改善作用,其藥效作用機制可能通過調控LIN28A/NF-κB信號通路,阻止炎癥反應實現。

