潰瘍性結腸炎合并非酒精性脂肪肝的臨床特征及危險因素分析
王琛 潘鵬 賀濤 宗蕾 孫善明
潰瘍性結腸炎(Ulcerative colitis,UC)是一種以慢性、復發性為特征,免疫異常介導的結腸疾病,其病變主要限于大腸黏膜與黏膜下層,呈連續性彌漫性分布,其病因目前尚不明確,可能與免疫反應、感染、遺傳因素、腸道菌群改變等有關。非酒精性脂肪肝(Non-alcoholic fatty liver disease,NAFLD)為最常見的慢性肝病之一,發病可從單純性脂肪變性到非酒精性脂肪性肝炎(NASH),再到NASH 相關性肝硬化,進而發展為肝細胞癌。除代謝綜合征外,UC 特有的危險因素包括營養不良、腸道炎癥、腸道微生物群的改變、類固醇的暴露和藥物所致的肝毒性,也可能是NAFLD 的發病機制之一[1]。NAFLD作為UC 相關肝病之一,與亞臨床全身性炎癥狀態和胰島素抵抗的發展密切相關[2]。UC 通常被認為是一種以吸收不良和消瘦為特征的消耗性疾病,但最近研究表明,UC 患者的NAFLD 患病率相比普通人群高[3]。腸道炎癥活動、疾病持續時間、長期使用激素、應用免疫抑制劑、應用生物制劑、腸道手術史可能與UC 發生NAFLD 有關[4]。目前,UC 與NAFLD 的關系尚不明確,本研究采用回顧性調查方法,探討UC 合并NAFLD 患者的臨床特征及UC 發生NAFLD 的危險因素,現報道如下。
1 材料與方法
1.1 一般資料選擇2018年10月~2020年3月于濰坊市人民醫院住院治療的 UC 患者,根據是否合并NAFLD 分為NAFLD 組與對照組。共入選159例患者,其中男82 例,女77 例;NAFLD 組42 例,對照組117 例。患者均自愿參與調查研究,并簽署知情同意書,本研究經我院倫理委員會審批通過。
1.2 納入與排除標準納入標準:①入組患者均完善結腸鏡檢查,符合《炎癥性腸病診斷與治療的共識意見(2018年,北京)》[5]中對UC 的診斷標準,確診為UC;②NAFLD 組患者符合《中國非酒精性脂肪性肝病診療指南(2010年修訂版)》[6]中NAFLD 的診斷標準,確診為NAFLD;③年齡>18 歲。排除標準:①肝炎病毒標志物陽性;②既往診斷為自身免疫性、膽汁淤積性、遺傳性、藥物性肝病等慢性肝病;③乙醇攝入量女性>70g/周,男性>140g/周;④腸內營養;⑤妊娠與哺乳者。
1.3 方法收集患者入院時性別、年齡、吸煙史、糖尿病史、高血壓史、冠心病史、激素應用史、結腸鏡表現等一般資料,并抽取晨起空腹靜脈血,應用全自動生化分析儀分析谷草轉氨酶(AST)、谷丙轉氨酶(ALT)、谷氨酰轉肽酶(GGT)、白細胞(WBC)、血紅蛋白(Hb)、血小板(PLT)、C 反應蛋白(CRP)、血沉(ESR)、高密度脂蛋白(HDL)、甘油三酯(TG)、總膽固醇(CHOL)。UC 病變范圍采用蒙特利爾分型,UC活動性采用改良Mayo 評分系統。
1.4 統計學方法采用SPSS 21.0 統計學軟件處理數據。呈正態分布的計量資料以±s表示,兩組間比較采用t檢驗;非正態分布的計量資料以M(P25,P75)表示,兩組間比較采用秩和檢驗;計數資料以率(%)表示,采用χ2檢驗;多因素分析采用二元Logistic 回歸分析。P<0.05 表示差異有統計學意義。
2 結果
2.1 一般資料比較UC 患者NAFLD 的發生率為26.42%。在年齡、性別、吸煙史、冠心病、激素應用史、病變范圍、Mayo 評分、GGT、WBC、PLT、Hb、CRP、HDL、TG 方面,NAFLD 組與對照組比較差異均無統計學意義(P>0.05);在糖尿病、高血壓、AST、ALT、ESR、CHOL 方面,NAFLD 組與對照組比較差異有統計學意義(P<0.05)。見表1。

表1 兩組一般資料比較
2.2 Logistic 回歸分析結果對糖尿病、高血壓、AST、ALT、ESR、CHOL 進一步行多因素Logistic 回歸分析,結果顯示合并糖尿病、高AST、高ALT 是UC 發生NAFLD 的危險因素。見表2。
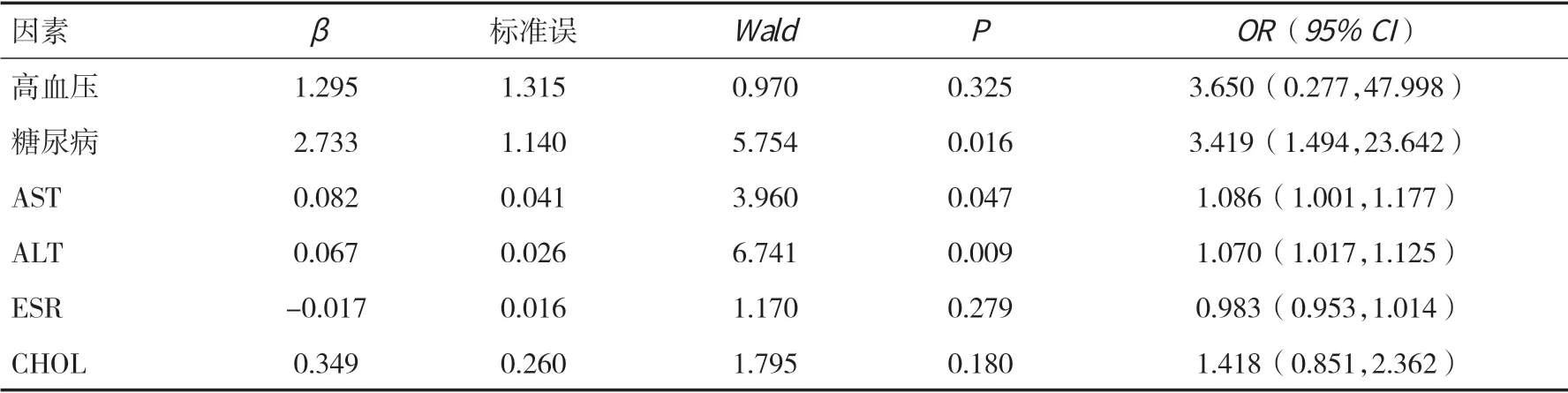
表2 UC 發生NAFLD 的Logistic 回歸分析
3 討論
全球UC 的患病率為5.50/10 萬~24.30/10 萬,其中北美和歐洲等發達地區UC 的患病率較高,約24.30/10 萬和19.20/10 萬,亞洲和中東地區的UC患病率較低,約為6.30/10 萬,而中國大陸地區UC的患病率約為11.60/10 萬[7,8]。隨著人們生活水平的提高,NAFLD 發病率逐年上升,由于人群和地域的不同,NAFLD 的發病率也存在較大差異[9]。一項來自我國的研究表明,隨著年齡的增高NAFLD的發病率逐漸升高, 而<60 歲男性的發病率明顯高于女性[8]。全球NAFLD 的平均患病率已經達到25%[10]。橫斷面研究表明,UC 患者中NAFLD 的患病率為6.2%~40%[11]。
目前,UC 與NAFLD 的關系尚不明確,結合現有研究可知兩者存在一定的相關性。1998年馬歇爾首次提出了“腸-肝軸”的概念,表明了腸道與肝臟的密切相互作用[12]。有研究表明,NAFLD 的發生與腸道菌群紊亂有關,如高脂飲食會降低菌群多樣性,使普氏菌屬數量減少,厚壁菌門與擬桿菌門的比率增加,使腸道吸收能力提高。腸道微生物通過參與難消化食物的發酵,與腸黏膜免疫系統相互作用,影響腸道屏障功能,導致信號改變,參與NAFLD 的發生。同時,微生物代謝產物不僅影響腸道內的信號轉導途徑,而且影響肝臟的代謝[12]。而腸道微生物的改變,可能影響自身免疫反應,UC 作為自身免疫性疾病,與NAFLD 患者均存在腸道菌群紊亂,從而使兩者存在一定相關性。UC 較長的病程增加了患NAFLD 的風險,活性氧的氧化應激也可能是NAFLD 和UC 的共同致病因素[11]。
本研究通過分析發現,UC 合并NAFLD 患者同時合并糖尿病、高血壓的發病率較單純UC 患者高,并且AST、ALT、CHOL 水平也較單純UC 患者高,ESR 水平較單純UC 患者低,這些因素可能與NAFLD 的發生有潛在的聯系。NAFLD 已經被證明是在沒有血清轉氨酶升高的情況下發展起來的,所以UC 患者轉氨酶升高應高度重視是否合并NAFLD。Mariabeatrice 等[13]研究表明,代謝綜合征、糖尿病、空腹血糖和腹圍是UC 合并NAFLD 的危險因素。Iannone 等[14]研究表明,在UC 患者中,合并NAFLD 與胰島素抵抗、腰圍、BMI、GGT、空腹血糖直接相關。有研究闡述UC 患者應用生物制劑,特別是腫瘤壞死因子抑制劑在NAFLD 發展中的作用,有不同結果。Glassner 等[15]研究表明,應用生物制劑,如腫瘤壞死因子抑制劑、皮質類固醇、免疫調節劑與NAFLD 的發展無明顯關系,但UC 合并NAFLD 患者的生物制劑應用減少。而有研究表明腫瘤壞死因子抑制劑通過減輕UC患者的炎癥狀態,促進粘膜愈合,使營養吸收增加和食欲增強,從而導致體重增加,出現肥胖相關炎癥和代謝綜合征[16]。來自活性氧的氧化應激也可能是導致NAFLD 和IBD 共存的常見致病因素,手術史或許也與NAFLD的發生獨立相關[17]。Verdugo-Meza 等[18]認為,UC患者腸道屏障的破壞增加了微生物在腸粘膜下的浸潤,從而增加了腸源性代謝物從腸道轉移到肝臟和胰腺的可能性。Jovanovic 等[19]的一項橫斷面研究表明,合并代謝綜合征的UC 患者其臨床與組織學表現較輕,在代謝綜合征患者中,促炎癥介質Gal-3和IL-10 水平較高,這可能是限制UC 炎癥過程和組織損傷的機制之一。本研究表明,合并糖尿病、高AST、高ALT 是UC 發生NAFLD 的危險因素,其中糖尿病作為危險因素,與上述研究結果一致。
綜上所述,本研究發現有糖尿病、高AST、高ALT 為UC 發生NAFLD 的危險因素,因此,對于UC 患者應注意監測血糖及AST、ALT 水平,及時篩查患者是否有NAFLD,為疾病預防、診斷、治療提供一定依據。但本研究樣本量小,納入指標不全面,對患者的病程、治療過程、腸外表現、飲食等未分析,存在一定局限性,仍需進一步研究。

