未產卵雌性黃鱔的性轉變
范 淼 楊 威 孫 數 李 忠 張利紅* 張為民*
(1.中山大學生命科學學院水生經濟動物研究所, 廣州 510275; 2.仙桃市忠善黃鱔工廠化繁育基地, 仙桃 433012;3.中國水產科學研究院長江水產研究所, 武漢 430223)
脊椎動物性別決定和分化發育機制一直是生物學研究熱點。目前研究表明, 脊椎動物性別決定方式包括基因決定性別和環境因素決定性別, 性別分化方向呈現可塑性[1]。魚類具有雌雄異體和雌雄同體等多種性別表現形式, 性別分化可塑性高, 是研究脊椎動物性別決定和分化發育的良好模型。同時, 很多魚類在生長和體型等方面呈現性別二態型, 通過性控育種實現單性化養殖將產生重大的經濟效益[2,3], 而魚類性別決定和分化機制研究是實現魚類性控育種的基礎。
黃鱔(Monopterus albusZuiew)隸屬合鰓魚目,合鰓魚科, 黃鱔屬, 是目前我國重要的特色淡水養殖魚類, 在湖北、安徽和湖南等地廣泛養殖。但是,黃鱔養殖的苗種仍主要是人工捕獲的野生黃鱔。由于過度捕撈, 近年來黃鱔自然資源日益減少, 嚴重影響黃鱔規模化人工養殖業的可持續發展。早在1944年, 我國脊椎動物性別決定研究先驅劉建康先生發現黃鱔是一種雌性先熟的性轉變魚類[3]。由于幼體階段性腺分化發育的單向性(雌性)和成體階段性腺自然可塑性(雌性轉變為雄性), 黃鱔已成為研究脊椎動物性別分化發育機制的重要魚類模型[4]。黃鱔自然性轉變規律和調控機制的闡明不僅具有很高的理論價值, 也將為其規模化人工繁育技術研發提供重要的支撐。
Liu[5]通過分析在重慶北碚野外采集的黃鱔性腺組織學結構及其性別比例, 首次提出黃鱔具有自然性轉變現象。隨后, Liem[6]分析了印度尼西亞萬隆地區野外捕獲和實驗室養殖的黃鱔性腺組織學結構和性別比例, Chan和Phillips[7]分析了中國香港和廣東地區的黃鱔性腺組織學結構和性別比例, 這些研究都證實了黃鱔存在自然性轉變。Chan等[8]通過活體解剖技術跟蹤同一條黃鱔性腺組織學變化, 進一步直接證實了黃鱔存在自然性轉變。雄性黃鱔都是從雌性黃鱔通過間性階段轉變而來, 沒有發現雄魚再轉變為間性或雌性的現象[6,8]。
在黃鱔卵巢向精巢轉變時, 最早出現的組織結構變化是生殖褶增厚, 并在生殖褶內圍出現零星的雄性生殖細胞; 隨著雄性生殖細胞的增殖和雌性生殖細胞的退化, 最終卵巢被精巢所取代, 雌性黃鱔轉變為雄性黃鱔[9]。關于雌性黃鱔在什么發育階段開始性轉變, 有些學者認為是在雌鱔性成熟產卵后發生[5,7,10—12]。通過分析年齡、體長和體重等與黃鱔性轉變的相關性, 發現黃鱔性別與年齡和體長關系較密切[13]。有研究表明, 雌性黃鱔2齡后開始性轉變[6,13]。由于生存環境和/或地理位置的不同, 不同地區的黃鱔發生性轉變時體長不同, 印度尼西亞萬隆地區黃鱔在體長為16 cm左右時開始性轉變[6],中國香港和廣東地區的黃鱔在體長為20 cm左右時開始性轉變[7], 中國天津地區的黃鱔在體長為40 cm左右時發生性轉變[14]。
增殖細胞核抗原(Proliferating cell nuclear antigen, 簡稱PCNA)是真核細胞DNA合成所必需的一種核蛋白。在細胞增殖過程中, PCNA表達量在G1晚期開始上升, S期達到高峰, G2期下降[15,16]。PCNA作為細胞增殖的分子標記, 常用于分析魚類性腺細胞的增殖。美洲花鱔(Synbranchus marmoratusBloch)是一種先雌后雄的性轉變魚類, 其性轉變早期性腺結締組織中Leydig細胞的PCNA免疫活性很高[17]。在孵化180d的黑棘鯛(Acanthopagrus schlegeliiBleeker)早期精巢中, 發現生殖細胞中有PCNA免疫陽性信號[18]。本文分析了實驗室內從受精卵或幼苗開始養殖至不同時段的黃鱔性腺發育狀況, 并對性腺進行了PCNA免疫組織化學分析, 旨在闡明黃鱔性轉變的基本規律, 以及間性性腺中各種細胞增殖與性轉變的關聯。
1 材料與方法
1.1 實驗黃鱔及其飼養
5月齡黃鱔為仙桃市忠善黃鱔工廠化繁育基地(湖北仙桃)2019年7月孵出的黃鱔苗, 于2019年9月運回本實驗室(廣東廣州)飼養; 12月齡和34月齡黃鱔分別為本實驗室于2018年5—6月和2016年5—6月孵化的黃鱔苗養成。在自然光照和溫度條件下, 參照何智等[19]報道的方法, 實驗室內黃鱔飼養于直徑為 80 cm 的塑料盆中, 投喂生物餌料(先期為水蚯蚓, 5月齡后為黃粉蟲), 投喂量約為體重的5%。養殖盆中放置1—2條灰色塑料管(直徑6.5 cm,長度37 cm), 以便黃鱔藏匿, 模仿其生態習性。每天換水, 并根據生長情況適時分盆, 控制養殖密度[20]。5月齡和12月齡黃鱔一直飼養在實驗室內, 34月齡黃鱔在性腺活檢手術前1個月轉移至室外水泥池(1 m×1 m×1 m)中飼養。在整個飼養和實驗過程中,每天上、下午觀察和記錄黃鱔生存狀態。
1.2 黃鱔性腺樣品的采集和分析
通過性腺活檢手術[8]獲得黃鱔性腺樣品。黃鱔腸道位于腹腔的腹面, 腎臟位于腹腔的背面, 緊貼背壁, 性腺位于腸道與腎臟之間, 呈管狀, 以腸系膜與腸道相連。黃鱔性腺活檢手術基本操作如下: 使用麻醉劑MS-222(500 mg/L; Sigma, A5040, MO,USA)麻醉實驗黃鱔。將麻醉后的黃鱔置于實驗臺,腹面朝上, 用碳鋼手術刀片(11號; 上海浦東金環醫療用品股份有限公司, 中國上海)于麻醉黃鱔泄殖孔前0.3—0.5 cm處腹中線偏右上方縱向開口0.5—1 cm, 小心把性腺與腸系膜剝離, 剪取適量性腺樣品后, 于腹腔內埋植經75%酒精消毒的電子標簽(廣州市洪騰條碼技術有限公司, 中國廣州), 然后用Δ1/2醫用縫合針(6×14; 巢湖市賓雄醫療器械有限公司, 中國安徽)和非吸收型外科縫合線(4-0; 揚州源康醫療器械有限公司, 中國江蘇)縫合傷口, 一般縫合3—5針即可。在縫合處涂抹紅霉素藥膏(廣東恒建制藥有限公司, 中國廣東)后, 將術后黃鱔置于曝氣水中蘇醒。如要對同一條黃鱔個體進行多次活檢手術, 下一次手術是在上一次手術位置前(頭部方向)1—2 mm處實施。
30條5月齡黃鱔[體重(15.3±2.9) g, 體長(25.7±1.2) cm]于2019年12月間進行性腺活檢手術; 17條12月齡黃鱔[體重(9.1±3.1) g, 體長(20.3±2.5) cm]和94條34月齡黃鱔[體重(25.5±9.1) g, 體長(30.5±3.7) cm]于2019年3—5月間進行性腺活檢手術。于2019年3—4月間, 對94條34月齡黃鱔中的36條雌魚[體重(20.8±6.7) g, 體長(29.2±3.4) cm]性腺發育進行了為期1個月的跟蹤研究。
通過性腺活檢手術剪取長約0.5 cm黃鱔性腺組織, 置于波恩氏液中固定24h, 然后按常規石蠟組織學切片流程處理。切片厚度為 4—5 μm, 蘇木精-伊紅(HE)染色, 中性樹膠封片, 使用Nikon顯微鏡(E800, Nikon, Japan)進行觀察和拍照。
1.3 PCNA免疫組織化學定位
黃鱔性腺組織石蠟切片經脫蠟和水化后, 用3%過氧化氫(無水甲醇∶30%過氧化氫∶ddH2O=8∶1∶1, 現配現用)在室溫下處理15min, 滅活內源性過氧化物酶; 用PBS(137 mmol/L NaCl, 2.7 mmol/L KCl, 10 mmol/L Na2HPO4, 2 mmol/L KH2PO4; pH=7.4)浸洗3次(每次5min)后, 組織切片放入預熱(95℃)的0.01 mol/L檸檬酸鹽緩沖液(pH= 6.0)處理15min, 進行抗原修復; 取出玻片放涼至室溫后, PBS浸洗3次(每次5min), 滴加適量的正常山羊血清, 在室溫濕潤的條件下孵育30min, 封閉非特異性結合位點; 在封閉后的切片上滴加PCNA即用型抗體(MAB-0145鼠單抗, 克隆號PC10, 福州邁新生物科技有限公司, 中國), 4℃過夜孵育, 再于室溫下孵育3h。在一抗孵育完后, 用PBS浸洗切片3次(每次5min), 滴加適量免疫組化信號放大劑(EliVisionTMSuper, KIT-9922,福州邁新生物科技有限公司), 室溫孵育15min, 經PBS浸洗3次(每次5min), 再滴加適量高敏型酶標抗鼠/兔聚合物(EliVisionTMSuper, KIT-9922, 福州邁新生物科技有限公司), 室溫孵育15min后, PBS浸洗3次(每次5min), DAB(DAB-1031, 福州邁新生物科技有限公司, 中國)顯色。陰性對照以PBS代替PCNA抗體, 其余操作一致。用Nikon顯微鏡(E800,Nikon, Japan)觀察切片和拍照。
1.4 數據處理
實驗黃鱔體重和體長等生物學參數采用SPSS統計軟件進行分析。數據表示為平均值±標準差(Mean±SD)。
2 結果
2.1 未經產卵過程的間性和雄性黃鱔
實驗所用黃鱔是從幼魚(指5月齡魚)或受精卵(指12月齡和34月齡魚)開始飼養, 每天記錄生活狀況。在飼養過程中, 未發現有任何雌鱔發育至腹部膨大呈半透明狀態, 也未觀察到養殖盆中有黃鱔卵粒或吐泡筑巢行為, 因此判斷實驗黃鱔沒有經歷產卵過程。
用石蠟組織切片和HE染色技術, 分析30條5月齡、17條12月齡和94條34月齡黃鱔的性腺發育狀況。結果表明, 在5月齡黃鱔中, 雌性占比66.7%, 間性占比13.3%, 雄性占比20.0%(圖1和表1); 在12月齡黃鱔中, 雌性占比82.4%, 雄魚占比17.6%(圖2和表1); 在34月齡黃鱔中, 雌性占比78.7%, 間性占比12.8%, 雄性占比8.5%(圖3和表1)。
不同年齡段黃鱔的性別與其個體大小關系分析表明, 在5月齡和34月齡的黃鱔中, 間性和雄性個體較雌性偏大(圖4A和4C), 但12月齡黃鱔中雄性個體較雌性偏小(圖4B)。
2.2 三齡雌鱔不經產卵過程發生性轉變現象
對94條34月齡黃鱔中的36條雌性黃鱔性腺發育進行了跟蹤研究。結果表明, 在1個月的跟蹤實驗過程中, 30條雌鱔依舊為雌性(圖5A2和A2’), 但有6條雌鱔變成為間性(圖5B2和B2’), 性轉變發生比例為16.7%。在黃鱔間性性腺中, 生殖褶增厚, 出現間質細胞, 及早期雄性生殖細胞包括精原細胞和精母細胞(圖5B2’)。
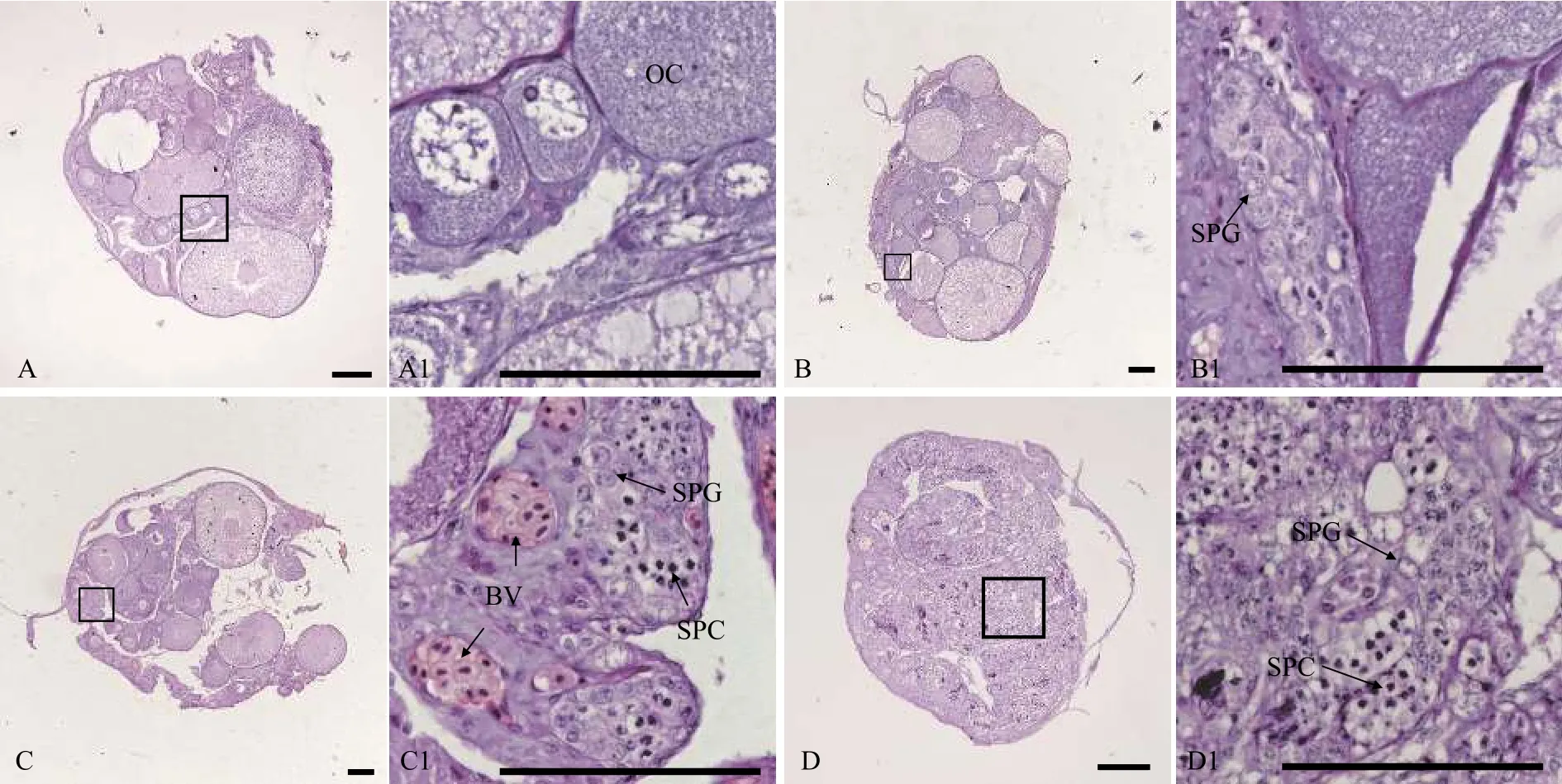
圖1 五月齡黃鱔的不同性別狀態性腺組織結構Fig.1 Gonadal histology of 5-month-old ricefield eels of different sexual stages

表1 不同年齡段黃鱔的性別比例Tab.1 Sex ratios of ricefield eels at different ages
2.3 黃鱔性轉變過程中性腺PCNA免疫組織化學分析
對同一黃鱔個體的不同發育階段的性腺進行PCNA免疫組織化學分析, 結果表明, 在卵黃發生期黃鱔卵巢中, 卵母細胞的細胞核及其外周部分濾泡層細胞核具有明顯的PCNA免疫陽性信號(圖6A1);卵巢中生殖褶很薄, 僅見個別細胞的細胞核具有PCNA免疫陽性信號(圖6A2)。
在間性早期黃鱔性腺中, 除卵母細胞的細胞核及其外周部分濾泡層細胞核可觀察到明顯的PCNA免疫活性信號(圖6B1)外, 增厚的生殖褶中也出現明顯的PCNA免疫信號。這些PCNA免疫信號主要分布在生殖褶兩類細胞, 其中一類為間質細胞, 另一類為雄性生殖細胞, 包括精原細胞和初級精母細胞(圖6B2)。
在間性晚期黃鱔性腺中, 退化卵母細胞上未見PCNA免疫信號(圖6C1), 增厚的生殖褶中可見不同發育階段的雄性生殖細胞, 其中精原細胞和初級精母細胞有明顯的PCNA免疫信號(圖6C2), 部分間質細胞上也有PCNA免疫信號, 但次級精母細胞上未觀察到PCNA免疫信號(圖6C1和C2)。
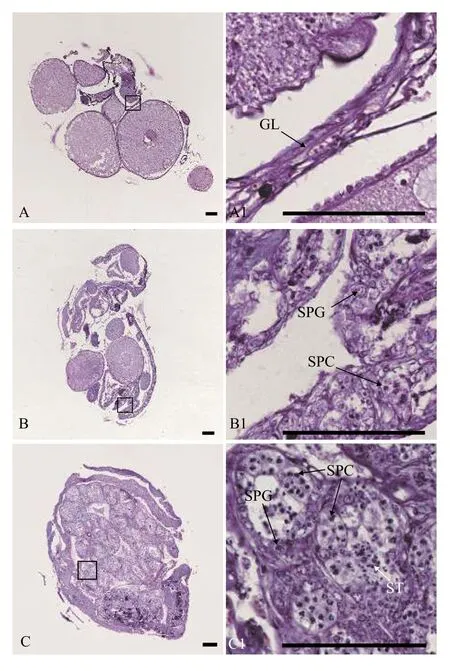
圖3 34月齡黃鱔的不同性別狀態性腺組織結構Fig.3 Gonadal histology of 34-month-old ricefield eels of different sexual stages
以PBS代替PCNA抗體, 免疫組織化學分析結果表明, 黃鱔性腺切片中未呈現任何免疫陽性信號(圖6D1和D2), 提示上述黃鱔性腺切片中PCNA免疫信號具有特異性。
3 討論
3.1 黃鱔性轉變與年齡、體長、體重的關系
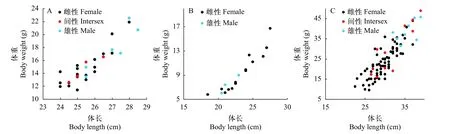
圖4 不同年齡段黃鱔的性別與體重和體長的關系Fig.4 The relationship between sex, body weight, and body length of ricefield eels at different ages

圖5 兩條34月齡黃鱔的性腺組織結構在跟蹤1個月前后的對比Fig.5 Tracing for gonadal changes of two 34-month-old ricefield eels in a one-month period
已有研究表明, 黃鱔在2齡之前都為雌性, 2齡后開始性轉變[6,13]。本文分析了實驗室內從受精卵或幼苗養殖至不同年齡黃鱔的性腺發育狀況, 發現在5月齡黃鱔中就存在有間性和雄性個體, 提示實驗室內養殖的黃鱔在5月齡之前就已經開始性轉變,比之前的報道至少提前了1.5年。

圖6 黃鱔性轉變過程中性腺PCNA免疫組織化學分析Fig.6 PCNA immunohistochemistry in gonads of ricefield eels during sex change
在實驗室養殖的5月齡、12月齡和34月齡的黃鱔中, 都有一定比例的不同性別的個體, 表明在同一個群體中黃鱔性轉變年齡存在個體差異。劉修業等[13]也發現3—5齡黃鱔性別處于過渡期, 性別過渡期達2年之久。那么, 黃鱔在什么年齡完成性轉變, 即在什么年齡全部變為雄性? 對于這個問題, 目前仍沒有定論。王良臣等[14]在野外采集的6齡和7齡黃鱔樣品中沒有發現雌性和間性個體, 全部為雄性。但是, 本實驗室有3條養殖8年的黃鱔, 其性腺仍處于間性階段(數據未顯示)。這些不同研究之間黃鱔性別與年齡關系的差異可能是因為實驗黃鱔生存環境不同所致, 而同一群體中黃鱔個體性轉變年齡的差異可能是由遺傳因素所決定的[8]。
除年齡外, 黃鱔性別與體長關系也比較密切[13]。與其他研究類似, 本研究表明, 在5月齡和34月齡黃鱔中, 間性和雄性個體較雌性個體偏大。在5月齡和34月齡黃鱔中, 間性黃鱔最小個體體長分別為24.5和26.5 cm, 比較接近鄱陽湖和洞庭湖黃鱔性轉變的臨界體長30 cm[21,22]和粵港地區黃鱔性轉變臨界體長20 cm[7], 而與天津[14]和信陽地區[23]黃鱔性轉變臨界體長(40.0 cm 左右)差異較大。與萬隆地區黃鱔性轉變臨界體長(16 cm左右)[6]也差異較大。這些不同地區黃鱔性轉變臨界體長差異可能與所在區域的緯度和氣候條件相關, 低緯度地區, 黃鱔生長發育較快, 性成熟早, 發生性轉變也早, 性轉變時體長也較小[11]。
本研究所觀察的12月齡黃鱔的體重和體長比5月齡偏小, 這可能是由于這批黃鱔在7月齡時發生疾病, 出現大規模死亡現象, 攝食和生長都受到嚴重影響。與5月齡和34月齡雄性黃鱔不同, 12月齡黃鱔的雄性個體較雌性偏小, 導致這些12月齡雄性黃鱔個體偏小的原因目前仍不清楚。Chan和 Phillips[7]曾報道有一些小個體的雌性黃鱔卵巢中卵母細胞數量少, 并有明顯的精巢組織出現, 推測它們的雌性階段很短。因此, 由這些小個體的雌魚性轉變產生的雄魚, 其個體也應該偏小。
3.2 產卵并非雌鱔性轉變的必經事件
研究者通常認為, 雌性黃鱔的性轉變是在經過一次或多次性成熟產卵后發生的[7,11,24,25]。本研究分析了實驗室內從受精卵或幼苗養殖至不同年齡黃鱔的性腺發育狀況。在養殖過程中, 沒有發現黃鱔有產卵現象或繁殖行為。前期研究表明, 實驗室內養殖的雌性黃鱔1齡時可發育至性成熟[19]。這些實驗室內養殖的雌性黃鱔之所以不產卵, 可能是由于室內養殖條件不適合其產卵和繁殖。性腺組織切片結果表明, 在94條34月齡黃鱔中, 有12條間性個體, 占比12.8%; 30條5月齡黃鱔中, 有4條間性個體, 占比13.3%, 這些結果提示, 雌性黃鱔不經過產卵過程也可以發生性轉變。另外, 本研究對36條34月齡雌性黃鱔的性腺發育進行了跟蹤觀察, 發現16.7%的黃鱔在這一跟蹤過程中發生性轉變, 進一步表明, 產卵并不是雌性黃鱔性轉變必須要經歷的事件。
就目前所掌握的資料來看, “黃鱔產卵后性轉變”的觀點最早由Chan和Phillips[7]于1967年提出的。但是, 早在1963年, Liem[6]從黃鱔受精卵孵化出黃鱔幼苗后養殖, 第30個月取樣時發現有雌性和間性黃鱔個體, 第36個月時取樣發現有雌性、間性和雄性黃鱔個體。但是, 該論文沒有說明這些30月齡的間性黃鱔是否在實驗室內經歷了產卵過程, 因此, 不能判斷產卵過程是否是黃鱔性轉變必經事件。在2004年, 周秋白等[21]報道, 懷卵未產雌鱔經過1周年飼養后有11%的個體轉變為間性。這些結果似乎與“黃鱔產卵后性轉變”的觀點不一致。但是, 該論文并沒有提供這些懷卵未產雌鱔的生物學參數和年齡等信息, 也沒有提及這些懷卵未產雌鱔是否初次性成熟, 之前的年份是否曾經歷產卵過程,因此, 論文的討論部分并沒有對“黃鱔產卵后性轉變”的觀點提出質疑[21]。
那么, 雌性黃鱔產卵后是否就進入間性階段發育? 答案是否定的。周秋白等[21]發現, 已產卵黃鱔在第二年的雌性比例仍占51.1%。因此, 雌性黃鱔產卵過程與性轉變啟動并沒有必然的因果關聯。
黃鱔性轉變的誘因目前仍不清楚。研究表明,環境因素如溫度和社會等級變化等影響魚類性別決定和分化[26,27]。應激激素皮質醇可能介導了溫度誘導魚類雄性化和社會行為誘導雌雄同體魚類性轉變的過程[28]。在雌性先熟的性轉變魚類斜帶石斑魚中, 腹腔注射皮質醇可誘導其從雌性轉變為雄性[29]。因此, 有關環境因素和皮質醇等與黃鱔性轉變的關聯值得進一步探討。
3.3 黃鱔是否有原發性雄性
研究發現, 同屬合鰓目的美洲花鱔也具有先雌后雄的性轉變現象, 這種魚的雄性有2種來源, 即原發性雄性(不經雌性階段直接發育為雄性)和次發性雄性(雌魚經性轉變發育成雄魚)[17,30]。次發性雄魚精巢是在卵巢結構基礎上改造而來, 因此精巢為單個, 但是原發性雄魚精巢是成對存在的[17]。
在黃鱔種群中, 是否存在原發性的雄性可能因地理位置而異。Liem[30]報道, 在泰國、馬來西亞沙撈越、馬來半島和日本沖繩的黃鱔樣品中發現原發性雄性, 而在印度尼西亞萬隆、日本Uda River和中國北碚的黃鱔樣品中沒有發現原發性雄性。與美洲花鱔原發性雄性一樣, 黃鱔原發性雄性的精巢也是成對存在, 由兩個精巢葉和連接兩者的結締組織構成, 結締組織中央有一條精巢靜脈, 兩側各有一條輸精管, 分別與兩側的精巢葉對應; 而次發性雄性黃鱔的精巢保留了卵巢的解剖結構, 原來的卵巢腔轉變為精巢的輸精管, 原來的輸卵管的空間仍存在, 但可能在精巢中不行使功能。
Chan和Phillips[7]報道了香港和廣東地區的黃鱔精巢有2種結構類型, 一種為full-cord, 另一種為half-cord。前者整個生殖褶充滿精巢小葉, 而后者精巢小葉僅分布在生殖褶內側。盡管Liem[30]推測含full-cord精巢的黃鱔為原發性雄性, 但是這種推測似乎缺乏證據, 因為Chan和Phillips[7]在文中并沒有提出half-cord和full-cord兩種精巢在解剖結構上有任何差異。
本研究在5月齡和12月齡黃鱔中都發現雄性個體, 占比分別為17.6%和20.0%, 比例較接近。組織切片分析表明, 這些雄性個體精巢中沒有任何退化的卵母細胞, 但解剖結構上與卵巢類似, 即有2條生殖褶, 2個性腺內腔及一個性腺外腔[8], 這與Liem[30]所描述的黃鱔原發性雄性精巢結構不同。因此, 本研究推測這些5月齡和12月齡雄性黃鱔也可能是通過性轉變所產生的, 其性轉變發生在卵巢發育早期階段。當然, 另一種可能性也不能完全排除, 即這些5月齡和12月齡雄性黃鱔是原發性的雄性, 特別是12月齡的雄性黃鱔, 其個體較雌性黃鱔偏小, 與雌性轉化為雄性的自然性轉變過程中個體大小變化趨勢存在矛盾。如果這些雄性黃鱔是原發性雄性, 那么其精巢的早期發生與卵巢類似, 而與Liem[30]所描述的黃鱔原發性雄性不同。因此, 中國本土黃鱔是否存在原發性雄性仍需進一步探討。
3.4 黃鱔性轉變過程中精巢組織細胞的發生
黃鱔從雌性轉變為雄性的過程是性腺中的卵巢組織不斷被精巢組織所取代的過程[7], 因此性轉變過程伴隨著精巢組織體細胞和生殖細胞的增殖。黃鱔精巢體細胞和生殖細胞發生于性腺生殖褶內側, 其中的性原細胞(Gonocyte)在雌性階段就已存在, 性轉變開始時, 這些性原細胞增殖, 產生精原細胞, 同時間質細胞也分化發育, 形成Leydig細胞[7,8]。在黃鱔間性早期性腺增厚的生殖褶中, 本研究也觀察到早期雄性生殖細胞包括精原細胞和精母細胞, 及精巢間質細胞。這些間質細胞呈卵圓形, 染色質濃縮, 與核膜相鄰, 存在于精小囊之間[31]。但是, 由于缺乏相應細胞的分子標記, 黃鱔間性性腺中性原細胞、精原細胞和間質細胞等的鑒定主要依據細胞形態和細胞在組織中所處的位置, 黃鱔性逆轉初期性腺組織細胞學變化仍很不清晰。
增殖細胞核抗原(Proliferating Cell Nuclear Antigen, 簡稱PCNA)是真核細胞DNA合成所必需的一種核蛋白, 在不同物種間具有高度的保守性, 已被用作多種組織中細胞增殖的生物標志物[32—34]。本研究應用免疫組織化學方法, 分析了卵巢、間性早期和間性晚期黃鱔性腺中PCNA免疫活性分布。發現PCNA免疫活性信號分布在黃鱔卵巢和間性早期性腺的卵母細胞, 間性晚期性腺的精原細胞和初級精母細胞等生殖細胞, 及卵巢中部分顆粒細胞中,這與上述這些性腺細胞具有較強的增殖能力相一致, 進一步提示商品化的PCNA抗體可用于分析黃鱔性腺細胞增殖。
在間性早期黃鱔性腺的生殖褶中, 除精原細胞和初級精母細胞為PCNA免疫陽性外, 精巢間質細胞也含有PCNA免疫陽性信號。在美洲花鱔性轉變早期的性腺結締組織中, 精巢間質細胞也呈現很強的PCNA免疫信號[17]。這些結果提示, 精巢間質細胞和精原細胞的增殖可能與黃鱔性轉變的啟動密切相關。但是, 這些間質細胞和精原細胞的起源仍有待進一步研究。因此, 黃鱔性轉變早期性腺中精巢體細胞和生殖細胞相關分子標記的開發, 結合PCNA免疫組化分析, 將能更好地揭示這些精巢體細胞和生殖細胞的動態變化, 有助于闡明黃鱔性轉變調控機制。
致謝:
感謝中山大學生命科學學院崔鑫、李曦、張瀾馨、劉敏琦、何智、許星和張有為同學協助實驗黃鱔飼養管理。

