小鼠皮膚/肌肉切口牽拉模型建立及右美托咪定對其疼痛行為學的影響
吳緒才 高子軍 肖莉 董補懷
(西安交通大學附屬紅會醫院麻醉科,陜西 西安 710054)
持續性術后疼痛是術后常見的一類疼痛綜合征,發生率為10%~50%,其中重度疼痛占2%~20%[1-3]。皮膚/肌肉切口牽拉模型是模擬臨床切口牽拉手術的一種新型持續性術后疼痛模型[4]。作為臨床常用的一種新型高選擇性α2腎上腺素能受體激動劑,右美托咪定可誘發模型動物的條件性位置范式中的條件性位置偏愛,進而可用于模型自發痛的實驗研究[5]。因此,本研究通過制備皮膚/肌肉切口牽拉模型,誘發持續性術后疼痛,進而探討右美托咪定對模型小鼠疼痛行為學的影響。
1 材料與方法
1.1 實驗動物 70只健康清潔級雄性C57BL/6小鼠,體質量20~32 g,6~8周齡,購自南京君科生物工程有限公司。
1.2 實驗方法
1.2.1 動物模型的建立及分組 小鼠隨機分為假手術組(皮膚/肌肉只切開不牽拉)和實驗組(皮膚/肌肉切口牽拉),每組各11只。實驗組:腹腔注射戊巴比妥鈉(上海新亞藥業有限公司)40 mg/kg常規麻醉,仰臥位固定于手術臺上,除去術區(右側后肢中部)鼠毛,75%乙醇擦拭術區,于隱靜脈內側3 mm作一皮膚切口(長約1 cm),顯露淺層股薄肌,鈍性分離淺層肌肉,置入顯微牽開器。皮膚肌肉拉開后持續牽開1 h,用無菌生理鹽水紗布保濕切口,縫合皮膚肌肉。假手術組:僅分離暴露肌肉1 h,不牽拉,其余步驟與實驗組一致。另選取48只健康雄性C57BL/6小鼠,隨機分為假手術組和實驗組,每組各24只,造模方法與上述相同,于術前1 d時行機械痛閾值測試,隨后實驗組均于腹腔注射0.9%氯化鈉注射液(安徽天禾藥業有限責任公司)和不同劑量的右美托咪定(四川百利藥業有限責任公司)(0.50、2.00、10.00 μg/kg),每亞組各6只,給藥時間均為30 min,給藥周期均為1次。
1.2.2 機械痛閾值測試 小鼠置于有機玻璃隔間,間距1 cm,在距離桌面孔徑為40 cm的金屬網格平臺上進行測試。測試前3~5 d適應實驗環境,提前30 min適應行為學測試環境。采用“up and down”法[6]進行測試,使50%小鼠出現縮足反射的強度為機械縮足反射閾值。
1.2.3 熱縮足潛伏期測試 采用熱痛刺激儀(天津伯爾尼科技有限公司)照射小鼠足底,以照射開始至小鼠出現抬腿回避時為熱縮足潛伏期。實驗中熱刺激強度始終一致,在環境安靜條件下進行測試,每只小鼠均測試3次,每次間隔5 min,取均值為最終結果。
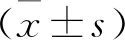
2 結果
2.1 小鼠皮膚/肌肉切口牽拉模型疼痛行為學檢測 兩組小鼠術前1 d機械痛閾值的比較差異無統計學意義(P>0.05);假手術組術后不同時間點同側足底術后機械痛閾值與術前比較差異無統計學意義(均P>0.05)。與術前比較,實驗組術后1~14 d機械痛閾值均顯著降低(均P<0.05);實驗組術后21 d時機械痛閾值與術前比較,差異無統計學意義(P>0.05)。與假手術組,實驗組術后1 d開始機械痛閾值顯著降低,且持續至術后10 d,隨后升高(均P<0.05),直至術后21 d時恢復術前水平(P>0.05),見表1。兩組手術前后不同時間點熱縮足潛伏期的組內和組間比較差異均無統計學意義(均P>0.05),見表2。

表1 兩組小鼠手術前后不同時間點機械痛閾值的比較
2.2 兩組小鼠腹腔注射不同劑量右美托咪定后機械痛閾值的比較 兩組小鼠給予0.9%氯化鈉注射液后機械痛閾值與給藥前比較,差異無統計學意義(均P>0.05)。假手術組腹腔注射不同劑量右美托咪定前后機械痛閾值比較,差異均無統計學意義(均P>0.05)。實驗組給予右美托咪定(0.50、2 μg/kg)30 min后機械痛閾值與給藥前比較,差異無統計學意義(均P>0.05);實驗組給予右美托咪定(10 μg/kg)30 min后機械痛閾值明顯高于給藥前(P<0.05)。實驗組給予0.9%氯化鈉注射液、右美托咪定(0.50、2、10 μg/kg)前后機械痛閾值均明顯低于假手術組(均P<0.05)。見表3。

表2 兩組小鼠手術前后不同時間點熱縮足潛伏期比較

表3 兩組小鼠腹腔注射不同劑量右美托咪定后機械痛閾值的比較
3 討論
足底切口模型是既往探究術后疼痛的常用模型[7-9],但該模型引起的疼痛持續時間相對較短(僅約5 d),而臨床中腹股溝疝氣手術和胸科手術等類型的患者可發生數月甚至數年的慢性疼痛[10-11]。臨床中持續性術后疼痛的發病人數較多,但目前有關其具體發生機制并未完全闡明,因此需進一步深入研究。臨床中持續性術后疼痛多為自發性、無外界刺激、持續性[12],而既往的慢性疼痛模型多為冷或熱觸、機械性誘發痛,因此難以準確測試并評價模型動物的自發痛行為狀況[13]。皮膚/肌肉切口牽拉模型是以大鼠為造模動物,其基因敲除大鼠較少,在基因層面的深入研究難度較大。因此,本實驗以成年雄性C57BL/6小鼠為造模對象,制備皮膚/肌肉切口牽拉小鼠模型,并測定該造模方法的穩定性和可行性,有助于今后從基因水平探究持續性術后疼痛的具體發生機制。
右美托咪定具有抗焦慮、阻滯交感神經、鎮靜和鎮痛等多種作用[14-19]。此外,有研究[18-20]發現,右美托咪定對持久性、隨機性、自發性疼痛具有良好的鎮痛作用,且經靜脈給藥對阿片類鎮痛藥物具有一定程度的增效功能,可降低不良反應發生率,具有較強的安全性。本研究發現,假手術組術后不同時間點同側足底術后機械痛閾值與術前比較,差異并無統計學意義(P>0.05)。相比術前,實驗組術后1~14 d機械痛閾值均顯著降低(P<0.05);實驗組術后21 d時機械痛閾值與術前比較,差異并無統計學意義。相比假手術組,實驗組術后1 d開始機械痛閾值顯著降低,且持續至術后10 d,隨后升高,直至術后21 d時恢復術前水平。兩組手術前后不同時間點熱縮足潛伏期的組內和組間比較,差異并無統計學意義(P>0.05)。本研究中,假手術組腹腔注射不同劑量右美托咪定前后機械痛閾值的比較,差異無統計學意義(P<0.05)。實驗組給予右美托咪定(0.50 μg/kg、2 μg/kg)30 min后機械痛閾值與給藥前比較,差異并無統計學意義(P<0.05);實驗組給予右美托咪定(10 μg/kg)30 min后機械痛閾值明顯高于給藥前(P<0.05)。實驗組給予0.9%氯化鈉注射液、右美托咪定前后機械痛閾值均明顯低于假手術組(P<0.05)。結果表明,相比0.9%氯化鈉注射液,給予右美托咪定(10 μg/kg)干預可提高小鼠機械痛閾值。但本實驗僅從行為學的角度探討右美托咪定對模型小鼠持續性術后疼痛的鎮痛效果,可能需要進一步排除其對小鼠血腦屏障和記憶力等方面的影響。另外,持續性術后疼痛的發生機制較復雜,有關右美托咪定的細胞內機制、分子生物學機制和電生理學機制等目前尚未明確,仍需今后進一步實驗以深入分析。
4 結論
通過小鼠皮膚/肌肉切口牽拉構建持續性術后疼痛模型的方法簡單方便、安全有效、穩定可行,且通過右美托咪定干預可有效減輕模型小鼠觸誘發痛。

