大黃酚對缺氧誘導的心肌細胞損傷保護作用及機制*
盧玉潤 李英 胡濤 唐宇帆 何秋蓉
(1.四川省醫學科學院·四川省人民醫院老年內科,四川 成都 610072;2.四川大學華西公共衛生學院·四川大學華西第四醫院檢驗科,四川 成都 610041)
缺血性心臟病是一種高發病率和高死亡率的臨床常見疾病,心肌供氧不足所導致的心肌損傷是缺血性心臟病發生的重要因素之一,降低心肌耗氧量和/或增加心肌供氧的抗缺血療法被證實是治療缺血性心臟病的重要策略[1-4]。因此,尋找和開發有效的保護心肌細胞免受缺氧損傷藥物對缺血性心臟病的治療和預防具有重要意義。蒽醌類化合物大黃酚提取自中藥大黃,具有抗炎、抗氧化和抗癌的藥理作用[5-7]。研究[8-9]顯示,大黃酚對缺血再灌注損傷的小鼠腦組織和缺血缺氧刺激的海馬神經元等具有保護作用。然而,大黃酚在缺氧誘導的心肌細胞中是否具有保護作用及其機制并不清楚。氯化鈷(CoCl2)是體外模擬心肌缺氧損傷常用的誘導劑[10-11]。本研究構建CoCl2誘導的心肌細胞系H9c2缺氧損傷模型,旨在闡述大黃酚對缺氧誘導的心肌細胞損傷的保護作用及其機制。
1 材料與方法
1.1 主要材料 大鼠心肌細胞系H9c2(上海美軒生物科技有限公司),大黃酚(四川省維克奇生物科技有限公司,純度≥98%)。DMEM/F12培養基(美國Gibco公司),MTT試劑和二甲基亞砜(美國Sigma公司),LDH試劑盒(南京建成生物工程研究所),Annexin V-FITC細胞凋亡檢測試劑盒(碧云天生物技術研究所)。兔抗鼠Bax、Bcl-2和GAPDH抗體(美國Santa Cruz公司),兔抗鼠Cleaved caspase-3抗體(英國Abcam公司),HRP標記的山羊抗兔IgG抗體(北京中杉金橋生物公司)。
1.2 細胞培養 采用含10%胎牛血清和100 U/mL青鏈霉素雙抗的DMEM/F12培養基在37 ℃、濕度飽和的5%CO2培養箱中常規培養H9c2細胞。待細胞貼壁80%左右時,以0.25%胰蛋白酶消化傳代。
1.3 缺氧細胞模型的構建、分組與處理 參照文獻[1]以 1200 μmol/L CoCl2處理H9c2細胞24 h,構建缺氧細胞模型。將長勢良好的對數生長期H9c2細胞分為對照組(正常培養)、缺氧組(建立缺氧細胞模型)及1、10和20 μmol/L大黃酚處理組(分別加入終濃度為1、10和20 μmol/L大黃酚預處理細胞后,再給予缺氧處理)。其中,大黃酚濃度的選取參照文獻[12]。每組設置3個復孔。
1.4 LDH試劑盒檢測細胞上清液中LDH釋放量 取處理結束后的各組細胞上清液100 μL,參照LDH試劑盒說明書檢測各組細胞上清液中LDH釋放量。實驗重復3次。
1.5 MTT法檢測細胞活力 將處理結束后的各組細胞以每孔104個接種至6孔細胞板上,并將不含細胞的培養基作為空白對照,置于37 ℃、濕度飽和的5%CO2培養箱中常規培養過夜。次日,棄培養液,加入20 μL MTT溶液(5 mg/mL)。孵育4 h后,棄上清液,再以150 μL二甲基亞楓震蕩反應10 min。采用酶標儀檢測各組細胞在490 nm處的OD值,并按照存活率=(實驗組OD-空白組OD)/(對照組OD-空白組OD)×100%計算各組細胞存活率。實驗重復3次。
1.6 流式細胞儀檢測細胞凋亡 胰蛋白酶消化收集處理結束后的各組細胞,以預冷的磷酸緩沖液洗滌細胞后,參照Annexin V-FITC凋亡檢測試劑盒說明書步驟檢測各組細胞的存活率。實驗重復3次。
1.7 Western blot檢測Bcl-2、Bax和Cleaved caspase-3蛋白水平 胰酶消化收集各組細胞后加入細胞裂解液抽提細胞總蛋白,采用BCA法檢測總蛋白的濃度。將蛋白樣品與等體積的上樣緩沖液混勻后,置于沸水浴中煮沸5 min。采用12% SDS-PAGE凝膠將熱變性后的蛋白樣品以每孔60 μg電泳分離后,半干法轉膜。經5%脫脂奶粉封膜2 h后,浸入Bcl-2(1∶500)、Bax(1∶1000)、Cleaved caspase-3(1∶1000)和GAPDH(1∶1000)一抗工作液中在4 ℃下孵育過夜。次日,再轉入HRP標記的山羊抗兔IgG二抗(1∶2000)工作液室溫孵育1 h。暗室內顯影曝光后,以GAPDH為內參,采用凝膠成像系統掃描分析各組細胞中Bcl-2、Bax和Cleaved caspase-3蛋白水平。實驗重復3次。
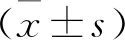
2 結果
2.1 大黃酚對缺氧心肌細胞上清液中LDH釋放量的影響 與對照組相比,缺氧組細胞上清液中LDH釋放量明顯增多(P<0.05);與缺氧組相比,1 μmol/L 大黃酚組LDH釋放量差異無統計學意義(P>0.05);但10、20 μmol/L大黃酚處理組中LDH釋放量較缺氧組或1 μmol/L 大黃酚組明顯減少(P<0.05),且20 μmol/L大黃酚組LDH釋放量明顯低于10 μmol/L大黃酚組(P<0.05),見表1。
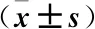
表1 各組細胞上清液中LDH含量的比較
2.2 大黃酚對缺氧心肌細胞活力的影響 與對照組相比,缺氧組細胞存活率明顯降低(P<0.05);與缺氧組相比,1 μmol/L大黃酚處理組細胞活力差異無統計學意義(P>0.05),但給予10、20μmol/L大黃酚處理后細胞活力較缺氧組或1μmol/L大黃酚處理組明顯升高(P<0.05),且大黃酚濃度越高作用效果越顯著(P>0.05),見表2。
2.3 大黃酚對缺氧心肌細胞凋亡的影響 與對照組相比,缺氧組細胞凋亡率明顯升高(P<0.05);與缺氧組相比,10、20 μmol/L大黃酚處理組細胞凋亡率明顯降低(P<0.05),且有一定的濃度依賴性;但1 μmol/L大黃酚處理組細胞凋亡與缺氧組心肌細胞凋亡比較差異無統計學意義(P>0.05),見圖1和表2。
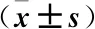
表2 各組細胞存活率和凋亡率的比較

圖1 流式細胞儀檢測各組細胞凋亡
2.4 大黃酚對缺氧心肌細胞凋亡相關蛋白表達的影響 與對照組相比,缺氧組細胞中Bcl-2/Bax水平明顯降低,而Cleaved caspase-3蛋白水平明顯升高(P<0.05);與缺氧組相比,1 μmol/L大黃酚組細胞中Bcl-2/Bax升高,Cleaved caspase-3蛋白水平差異無統計學意義(P>0.05),但10、20 μmol/L大黃酚處理組細胞中Bcl-2/Bax明顯高于缺氧組或1 μmol/L大黃酚組,而Cleaved caspase-3蛋白水平明顯低于缺氧組或1μmol/L大黃酚組(P<0.05)。同時,20 μmol/L大黃酚處理組的作用效果明顯大于10 μmol/L大黃酚處理組(P>0.05),見圖2和表3。

圖2 各組細胞中Bcl-2、Bax和Cleaved caspase-3蛋白的表達
3 討論
心肌缺血損傷的分子機制十分復雜,涉及炎癥反應、氧化應激、能量代謝異常等,而這些最終會導致心肌細胞凋亡[13-15]。CoCl2是一種非常重要的低氧誘導因子,可通過促進LDH釋放、降低細胞存活率和誘導心肌細胞凋亡等使心肌細胞發生缺氧損傷[16]。LDH是一種重要的糖酵解酶,其水平的升高常常被作為心肌細胞損傷的重要指標[17]。
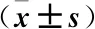
表3 各組細胞中Bcl-2/Bax和Cleaved caspase-3蛋白相對表達水平比較
大黃酚又名大黃根酸、1,8-二羥基-3-甲基-蒽醌,主要來自蓼科植物掌葉大黃的干燥根,對肝、腎和腦等多種組織損傷具有重要的保護作用[18-20]。現代藥理研究[21]表明,大黃酚具有廣泛的藥理作用,包括抗癌,抗氧化,神經保護,抗菌和抗病毒以及調節血脂。在小鼠腦缺血/再灌注損傷的研究中發現,大黃酚可通過抗缺氧作用和抗凋亡作用發揮保護效應[22]。有研究[12,23]指出大黃酚可通過減輕阿霉素誘導的心肌細胞凋亡、線粒體損傷和心臟功能障礙發揮心肌保護作用;還能夠改善異丙腎上腺素注射誘導的心肌肥大大鼠心臟結構和功能,進而發揮心肌保護作用。然而大黃酚對缺氧誘導的心肌細胞損傷的作用和機制尚不明確。本研究以CoCl2模擬心肌細胞缺氧損傷,發現大黃酚對缺氧誘導的心肌細胞損傷具有一定的保護作用。
Xue等[24]研究顯示大黃酚治療可顯著抑制糖尿病小鼠血清中LDH的活性,減輕糖尿病小鼠的心臟損傷。李俊杰等[9]報告指出,大黃酚可抑制缺血缺氧引起的大鼠海馬組織細胞凋亡,保護缺氧誘導的神經細胞損傷。這與本研究結果相吻合,提示大黃酚可通過拮抗缺氧誘導的心肌細胞凋亡,提高細胞存活率,進而保護缺氧誘導的心肌細胞損傷。但本研究僅對大黃酚的心肌保護作用與機制進行初步探索,將來有必要在分子水平上進一步研究大黃酚的心肌損傷保護機制。
4 結論
大黃酚對缺氧誘導的心肌細胞損傷具有保護作用,其作用機制與拮抗缺氧誘導的心肌細胞凋亡有關;這為改善缺氧誘導的心肌細胞損傷及缺血性心臟病的防治提供了新線索。

