氟西汀對抑郁模型大鼠腸道菌群代謝多樣性的影響*
李 宇 蔡蕭君# 陸振華 頡彥鵬 王 濤 王 欽 吳圓圓
黑龍江省中醫醫院內分泌科1(150036) 消化內科2
抑郁癥是臨床常見的精神心理性疾病之一[1],已成為全球非正常死亡和致殘的主要原因之一[2]。目前選擇性5-羥色胺再攝取抑制劑(SSRI)仍為抑郁癥的一線用藥,其中氟西汀因其神經保護特性、抗炎、抗腫瘤[3]效果而廣為人知,但其對腸道微生物的潛在作用迄今被低估。Zheng等[4]在無菌小鼠腸道內定植抑郁癥的患者腸道微生物而建立的人源化小鼠可誘導抑郁癥表型;Hsiao等[5]的研究發現,脆弱擬桿菌可通過改變腸黏膜通透性影響小鼠抑郁相關行為的發生。而抗抑郁藥物對腸道菌群的調控機制目前尚不明確。本研究采用Biolog-ECO技術[6],結合《保健食品檢驗與評價技術規范》判定標準[7],選取6種常見菌屬進行選擇性培養,旨在探討SSRI類抗抑郁藥氟西汀對抑郁模型大鼠腸道菌群結構和代謝多樣性的影響,從而為闡明其抗抑郁機制提供科學依據。
材料與方法
一、實驗動物與主要試劑
8周齡SPF級SD雄性大鼠30只,體質量200~220 g,購自哈爾濱醫科大學實驗動物學部。于清潔級動物實驗室飼養1周,環境溫度21 ℃,相對濕度55%,12 h明暗交替,自由攝食飲水。鹽酸氟西汀分散片購自法國禮來公司。
二、實驗方法
1. 動物分組和模型建立:適應性飼養1周后,將30只大鼠隨機分為空白組(n=10)、模型組(n=10)、氟西汀組(n=10)。模型組和氟西汀組均接受連續6周的慢性不可預知溫和應激(CUMS),包括以下7種[8]:①電擊足底1 min;②4 ℃冰水游泳5 min;③行為束縛2 h;④夾尾1 min;⑤禁食24 h;⑥禁水24 h;⑦夜間光照12 h。根據隨機數字法每天定時隨機選擇1種刺激方法處理大鼠。每只大鼠單獨1籠,每籠之間用不透光擋板遮擋。
2. 模型驗證和藥物干預:造模6周后,氟西汀組給予鹽酸氟西汀分散片3.17 mg·kg-1·d-1灌胃,空白組和模型組給予6.3 mg·kg-1·d-1蒸餾水灌胃。連續灌胃8周后,進行行為學實驗評估,包括懸尾實驗、強迫游泳實驗和曠場實驗[9]。
3. 糞便收集和處理:將大鼠尾部提起固定,輕壓下腹部,將新鮮糞便收集于無菌EP管中。4 ℃運回實驗室,無菌條件下稱取1 g糞便樣品,加入10 mL 0.9% NaCl溶液,渦旋混勻,1 000 r/min離心5 min,去除食物殘渣,取上清液,稀釋為濃度10-2~10-5g/mL菌懸液,-20 ℃保存備用。取10-3g/mL菌懸液均勻涂抹于選擇性培養基表層,倒置后恒溫培養,采用稀釋平板菌落計數法統計數量。8通道移液器吸取150 μL濃度為10-3g/mL的菌懸液至Biolog-ECO微平板,接種后放入37 °C恒溫厭氧箱培養。運用Biolog系統每間隔24 h進行讀數測定,檢測碳源代謝過程中顏色和吸光度變化。平均顏色變化率(AWCD)表征微生物群落對單一碳源的利用能力和代謝總體活性。聚類分析對微平板中具有相同代謝特征的碳源進行親疏度判別和重新分類,比較不同組別大鼠腸道菌群碳源代謝的差異。主成分分析使變量簡化降維,對吸光度相關矩陣進行線性變換,提取對組間差異貢獻大的因子。
三、統計學分析
結 果
一、大鼠行為學變化
與空白組相比,模型組大鼠懸尾掙扎時間、自主游泳時間和曠場內移動總距離顯著減少(P<0.05);氟西汀組大鼠懸尾掙扎時間、自主游泳時間和移動總距離較模型組顯著增加(P<0.05;圖1)。
二、大鼠腸道6種常見菌屬豐度變化
與空白組相比,模型組大鼠腸道內脆弱擬桿菌、腸球菌、腸桿菌和產氣莢膜梭菌數量顯著增加(P<0.05),雙歧桿菌、乳桿菌數量顯著減少(P<0.05)。與模型組相比,氟西汀組大鼠腸道內脆弱擬桿菌、腸球菌、腸桿菌和產氣莢膜梭菌數量顯著降低(P<0.05),雙歧桿菌數量顯著增加(P<0.05),乳桿菌數量無明顯差異。與空白組相比,氟西汀組大鼠腸道內脆弱擬桿菌、雙歧桿菌、乳桿菌數量顯著降低(P<0.05),腸桿菌數量顯著增加(P<0.05;圖2)。
三、大鼠AWCD值和多樣性指數變化
厭氧培養72 h內,各組AWCD值均隨培養時間延長而逐漸增加,表明腸道微生物群的總體代謝活性隨培養時間延長而逐漸增加。培養72 h后,各組AWCD值逐漸趨于平穩。模型組大鼠Shannon指數、Shannon均勻度、Simpson指數和Mclntosh指數均顯著低于空白組(P<0.01);與模型組相比,氟西汀組大鼠Shannon指數和Mclntosh指數明顯升高(P<0.01),而Shannon均勻度和Simpson指數無明顯差異(圖3)。
四、大鼠腸道菌群代謝聚類分析
當聚類距離≤5時,空白組和氟西汀組的碳源被聚為4類,模型組的碳源被聚為10類。說明 CUMS誘導的大鼠腸道微生物對碳源的利用比較分散,氟西汀治療后,碳源利用相對比較集中,接近于空白組。空白組和氟西汀組中糖類D-半乳糖酸γ內酯、D,L-α-磷酸甘油、D-甘露醇和氨基酸類L-天冬酰胺酸、L-絲氨酸、L-苯基丙氨酸均被聚為一類,而在模型組中這些碳源被聚在不同的類別中,空白組中羧酸類D-蘋果酸單獨被聚為一類,氟西汀組中糖類D,L-α-磷酸甘油和羧酸類D-蘋果酸、衣康酸、γ-羥基丁酸被聚為一類,說明氟西汀可使大鼠腸道微生物對D,L-α-磷酸甘油、D-蘋果酸的利用發生變化(圖4)。
五、大鼠腸道菌群代謝主成分分析
主成分分析結果顯示,空白組、模型組、氟西汀組大鼠中成分1的方差貢獻率分別為84.69%、68.61%、84.71%(圖5)。
分析載荷圖中3組大鼠腸道微生物對31種碳源的代謝特點,空白組、模型組和氟西汀組中PC1在I-赤藻糖醇、N-乙酰基-D-葡萄胺、D-纖維二糖等糖類碳源和L-苯基丙氨酸、L-絲氨酸、甘氨酸-L-谷氨酸等氨基酸類碳源上均有較高載荷,說明這兩類碳源是大鼠腸道微生物代謝的必需碳源。模型組和氟西汀組中PC1在衣康酸等羧酸類碳源均有較高載荷,這可能與CUMS造模有關。與空白組相比,模型組增加了苯乙基胺、腐胺等胺類碳源,氟西汀組增加了α-環式糊精、G-肝糖等聚合物類碳源,說明氟西汀能提高大鼠腸道微生物對復雜大分子物質的利用能力。
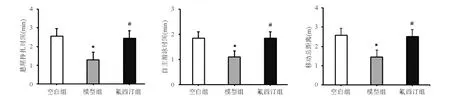
A:懸尾實驗;B:強迫游泳實驗;C:曠場實驗

*與空白組比較,P<0.05;#與模型組比較,P<0.05
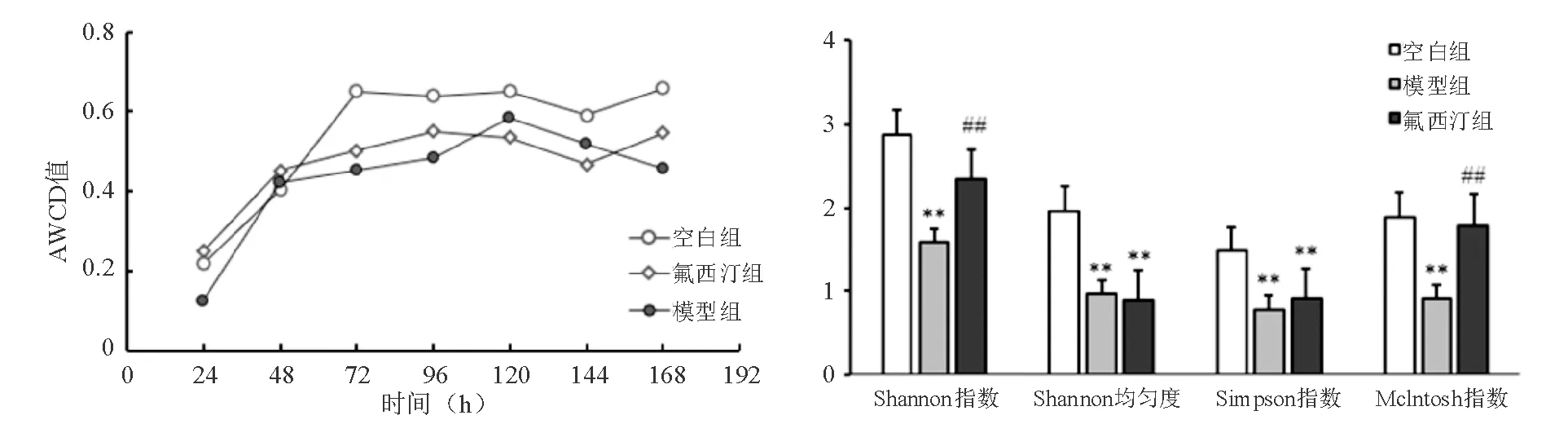
**與空白組比較,P<0.01;##與模型組比較,P<0.01

圖4 大鼠腸道菌群代謝聚類分析
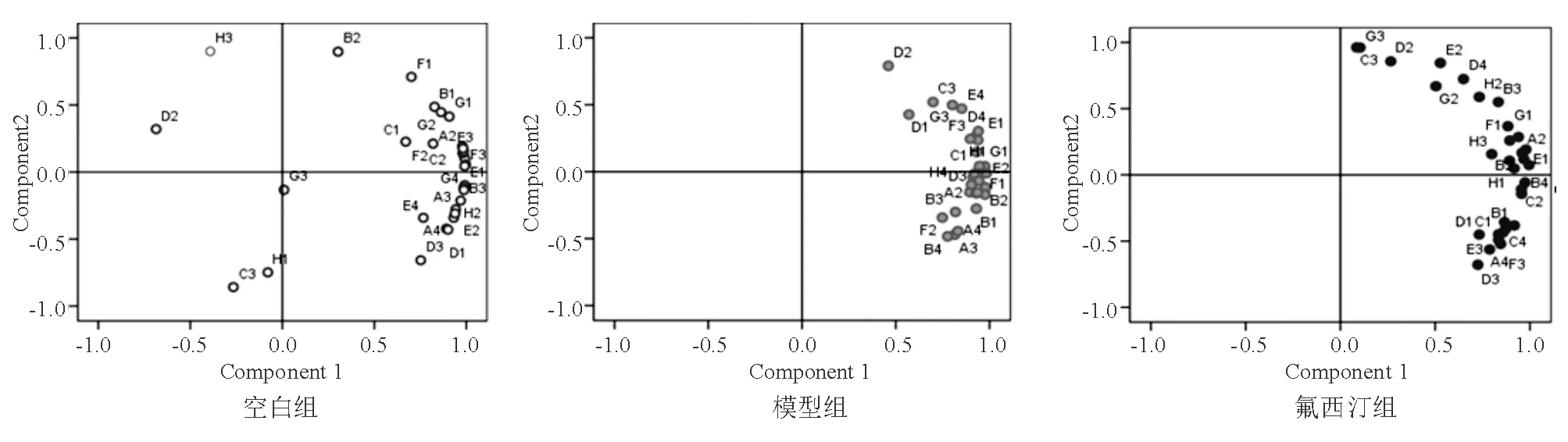
圖5 大鼠腸道菌群代謝主成分分析
空白組中PC2在4-羥基苯甲酸、D-蘋果酸等碳源上有較高的載荷,表明這些碳源對PC2貢獻率較大;模型組中PC2在葡萄糖-1-磷酸鹽、D-甘露醇、甘氨酸-L-谷氨酸、D,L-α-磷酸甘油等碳源上有較高的載荷;氟西汀組中PC2在4-羥基苯甲酸等碳源上有較高的載荷。D,L-α-磷酸甘油、D-半乳糖醛酸等糖類碳源在空白組和氟西汀組中對PC1貢獻率較大,在模型組中對PC2貢獻率較大。衣康酸等羧酸類和L-精氨酸等氨基酸類碳源在空白組和氟西汀組中對PC2貢獻率較大,而在模型組中對PC2貢獻率不大。
討 論
抑郁癥的發病機制非常復雜,包括生化、遺傳、免疫、神經內分泌、心理社會環境等多種因素,近年研究發現,微生物-腸-腦軸在抑郁癥等神經精神疾病中起有重要作用。中樞神經系統(CNS)、腸神經系統(ENS)、植物神經系統(ANS)和下丘腦-垂體-腎上腺(HPA)軸共同形成了微生物-腸-腦軸雙向信號通路[10],使大腦能夠對腸嗜鉻細胞、免疫細胞、神經膠質細胞和Cajal間質細胞等[11-12]效應細胞的功能產生影響,腸道微生物又可通過腸-腦軸神經通路、神經內分泌-HPA軸途徑、腸道免疫系統、合成神經遞質、腸黏膜屏障、血腦屏障等途徑影響大腦情感和認知行為[13-14]。
Biolog-ECO微平板鑒定和變性梯度凝膠電泳(DGGE)技術是目前微生物研究的兩種重要方法。DGGE技術不依賴傳統微生物培養,可基于PCR結果直接表征微生物遺傳特征,菌種分辨率高,但僅能分離較小DNA片段,且一個條帶可能代表多個菌種或同一菌種可能產生不同條帶[15]。Biolog-ECO微平板技術無需分離純種微生物,可通過碳源氧化快速檢測微生物群落結構和多樣性,尤其適用于快速生長型菌落,可最大限度保留微生物原有代謝特征,可重復性高,但碳源底物易受濕度、pH值等環境因素的影響[16]。
微生物Shannon指數可評估腸道微生物群落整體豐富度,Shannon均勻度是在菌群豐富度基礎上衡量微生物個體分布的均勻度,Simpson多樣性指數和Mclntosh指數均表示多樣性測度,表征某些常見菌落的優勢度和均勻度。本研究結果顯示,氟西汀組大鼠懸尾掙扎時間、自主游泳時間和移動總距離較模型組顯著增加(P<0.05),這與Yan等[17]的實驗結果一致。Biolog-ECO結果顯示模型大鼠腸道微生物的碳源利用能力和總體代謝活性發生顯著變化,空白組大鼠AWCD值最大,表示其代謝總體活性最強,氟西汀可調節模型大鼠腸道菌群的整體代謝功能趨于正常。氟西汀還可上調模型大鼠Shannon指數和Mclntosh指數,而對整體均勻度和常見菌種優勢度無明顯調節作用。聚類和主成分分析顯示,氟西汀干預后碳源利用相對集中,對聚合物類復雜大分子的利用增加,D,L-α-磷酸甘油和D-蘋果酸代謝發生變化。D,L-α-磷酸甘油和D-蘋果酸是連接胞質糖酵解與線粒體氧化磷酸化的重要環節和穿梭機制,由于線粒體內膜具有嚴格選擇通透性,糖酵解產生的還原型煙酰胺腺嘌呤二核苷酸磷酸(NADPH)不能進入線粒體內膜,需經D,L-α-磷酸甘油和D-蘋果酸轉移還原當量才能進入線粒體呼吸鏈進行氧化供能[18]。說明氟西汀可通過調控糖酵解和線粒體氧化磷酸化途徑影響大鼠腸道菌群代謝活性。
SSRI類藥物主要通過靶向調節突觸間隙中5-HT濃度發揮抗抑郁作用。人體95%的5-HT存在于腸道中[19],主要由嗜鉻細胞產生。腸道微生物可通過調控短鏈脂肪酸(SCFA)代謝、色氨酸羥化酶1(TPH1) mRNA和5-羥色胺轉運蛋白(SERT)基因表達,進一步影響5-HT水平[20]。5-HT又可對大腸埃希菌等微生物豐度和群體感應性[21]產生影響,腸道微生物可編碼5-HT感應元件[22]。5-HT必須經由相關受體的介導才能發揮作用,其中5-HT2和5-HT3[23]被認為與抑郁癥密切相關。5-HT2A受體在海馬CA1、CA2、CA3區[24]和腸黏膜下層膽堿能神經元[25]中廣泛表達,5-HT3受體大量分布于腸道肌間神經叢和黏膜下神經叢的神經元中[26],均受外來5-HT神經遞質的調控。Lyte等[27]的研究發現,長期口服氟西汀可顯著降低雄性健康大鼠腸道中乳桿菌豐度,提示氟西汀的負面臨床效應是由腸道微生物群改變引起,口服乳桿菌制劑有助于改善氟西汀長期治療的不良反應。由此可見,氟西汀對大鼠腸道菌群結構和代謝多樣性具有顯著調控作用,腸道微生物參與SSRI類藥物抗抑郁的機制包括,一方面在5-HT與中樞、腸道神經元的受體結合后,可能通過腸-腦軸進一步引起腸道微生物結構和代謝多樣性的改變;另一方面是腸道微生物受到5-HT的影響后,可能通過微生物-腸-腦軸自下而上改變大腦的情感和認知行為。
綜上所述,本實驗采用CUMS結合孤養建立抑郁大鼠模型,Biolog系統檢測結果顯示,抑郁大鼠腸道菌群結構和代謝多樣性發生明顯變化,SSRI類抗抑郁藥氟西汀對抑郁導致的腸道菌群改變具有正向調控作用。氟西汀可使抑郁模型大鼠腸道中有益菌雙歧桿菌豐度上調,使其迅速成為優勢菌種,這與Zhang等[28]的研究結果一致;使條件致病菌脆弱擬桿菌、腸桿菌、腸球菌和有害菌產氣莢膜梭菌豐度下調,而對乳桿菌豐度無明顯調節作用。同時氟西汀可調節微生物整體豐富度和常見菌種均勻度逐漸恢復正常。
本實驗僅對抑郁模型大鼠腸道菌群的體外代謝影響進行研究,而SSRI類抗抑郁藥物與腸道微生物之間相互作用的具體機制還有待通過基因測序、糞菌移植等進一步揭示。因此,本課題組未來后續擬通過直接檢測血液、糞便的代謝物樣本來證實SSRI類抗抑郁藥物與微生物和代謝物之間存在的因果關系。

