桉葉多酚提取物體內外抗氧化活性評價
李 偉,葉嘉宜,陳運嬌,曹 庸
(華南農業大學食品學院,廣東省功能食品活性物重點實驗室,廣東省天然活性物工程技術研究中心,廣東 廣州 510642)
正常情況下,細胞內抗氧化物質和氧化物質呈動態平衡;當機體受到氧化應激后,細胞在新陳代謝的過程中會產生過量自由基,引起機體損傷。自由基與炎癥、衰老等多種疾病模型密切相關[1]。多酚作為植物體內重要的次生代謝產物,能有效清除自由基[2];此外,植物多酚被證實能有效預防高血脂、心腦血管等疾病[3],還能降低癌癥等患病風險[4],因而逐漸受到人們的重視。
桉樹是桃金娘科桉屬植物的統稱,原產于澳大利亞,現廣泛分布于熱帶和亞熱帶地區[5];我國桉樹人工種植林主要分布在廣東、廣西、云南、四川、海南等省。作為桉樹副產物,桉葉年產量大但利用率低,除了部分用于提取精油,大部分被廢棄或焚燒。有研究指出桉葉中含有酰基酚類及其衍生物、黃酮類化合物、鞣質、三萜類及其苷類以及部分未知高活性化合物[6],具有抗氧化、抗炎、抗菌等多種生物活性[7-8]。基于桉葉多酚提取物資源廣泛且活性顯著,日本已將其應用于食品添加劑和化妝品中[9]。本實驗室前期已鑒定出桉葉多酚提取物中重要的抗氧化活性物質,包括月見草素B、1,2,3,4,6-五沒食子酰基葡萄糖及特里馬素等[10];桉葉多酚提取物在體外具有良好清除自由基能力[11],體內實驗也表明其能有效提高血清中抗氧化酶[12]。桉葉多酚提取物中多酚類物質和月見草素B含量對抗氧化能力至關重要,這一推測與Amakura等[13]研究一致。因此,對桉葉多酚提取物進行分離純化,提高粗提物中多酚類物質及月見草素B含量對改善其抗氧化活性具有重要意義。然而,現有報道多是采用單一方法對桉葉多酚提取物進行功效評價,評價方法不系統且沒有純化后桉葉多酚的活性研究。為了系統準確地評價桉葉多酚提取物抗氧化活性,本實驗采用傳統的化學評價方法,并建立氧化損傷RAW264.7巨噬細胞模型,結合秀麗隱桿線蟲(以下簡稱線蟲)模型,全面評價純化后桉葉多酚抗氧化能力,為桉葉多酚提取物開發成功能性食品或食品抗氧化劑提供理論依據。
1 材料與方法
1.1 動物、材料與試劑
野生型秀麗隱桿線蟲品系(基因型N2)購于美國明尼蘇達大學線蟲種質中心。
桉葉采集于廣東省茂名市寶圩鎮;RAW264.7巨噬細胞購于中國科學院典型培養物保藏委員會昆明細胞庫。
DMEM 高糖培養基美國Hyclone 公司;胎牛血清、雙抗(青霉素和鏈霉素)、磷酸鹽緩沖液(phosphate buffered saline,PBS)美國Gibco公司;噻唑藍(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT)、抗壞血酸及H2O2美國Sigma公司;丙二醛(malondialdehyde,MDA)、還原型谷胱甘肽(glutathione,GSH)、谷胱甘肽過氧化物酶(glutathione peroxidase,GSH-Px)、總超氧化物歧化酶(total superoxide dismutase,T-SOD)及過氧化氫酶(catalase,CAT)試劑盒 南京建成生物工程研究所;其余試劑均為分析純。
1.2 儀器與設備
AL401電子天平瑞士Mettler Toledo公司;FD-1型冷凍干燥機北京博醫康技術公司;LC-15C高效液相色譜儀日本島津公司;SMZ-T4連續變倍體視顯微鏡重慶奧特光學儀器有限公司;SWCJ-A超凈工作臺上海浦東榮豐科學儀器有限公司;EnSpire酶標儀美國PerkinElmer公司。
1.3 方法
1.3.1 桉葉多酚提取物制備及純化
準確稱取100 g桉葉粉末,以體積分數70%乙醇溶液為提取溶劑,按料液比1∶7(m/V)在50 ℃條件下攪拌提取2 h,提取2 次。將兩次提取液合并后濃縮,真空冷凍干燥成粉,得桉葉多酚提取物。再將得到的桉葉提取物配制成200 mg/mL,4 ℃下冷藏8 h,除去下層沉淀;再以乙醇-乙酸乙酯體系(2∶98,V/V)萃取5 次,保留下層液;再以乙醇-乙酸乙酯(30∶70,V/V)萃取5 次后,將上清液濃縮干燥后可得純化后的桉葉多酚提取物(以福林-酚法測定總多酚含量,高效液相色譜法[7]檢測多酚組成)。參照GB 5009.5—2016《食品中蛋白質的測定》、GB 5009.6—2016《食品中脂肪的測定》、GB 5009.4—2016《食品中灰分的測定》分別檢測純化后桉葉多酚提取物粗蛋白、粗脂肪及灰分質量分數。
1.3.2 桉葉多酚提取物體外抗氧化活性測定
1.3.2.1 DPPH自由基清除能力測定
參考Kumaran等[14]的方法,評價桉葉多酚提取物DPPH自由基清除率。將桉葉多酚提取物配成不同質量濃度(0.025~0.4 mg/mL)儲備液。取0.2 mL不同質量濃度桉葉多酚提取物溶液和3.8 mL DPPH溶液(1×104mol/L)混勻,暗處反應30 min;以空白溶劑作參照,以抗壞血酸為陽性對照,在517 nm波長處測定吸光度,每個樣品3 個平行。DPPH自由基清除率按公式(1)計算。
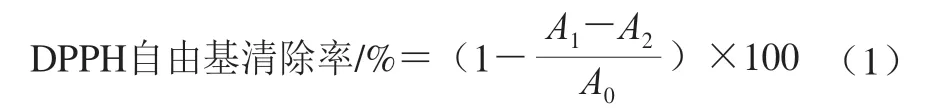
式中:A1為0.2 mL樣品溶液+3.8 mL DPPH溶液的吸光度;A2為0.2 mL樣品溶液+3.8 mL空白溶劑的吸光度;A0為0.2 mL空白溶劑+3.8 mL DPPH溶液的吸光度。
1.3.2.2 ABTS陽離子自由基清除能力測定
參照王俊亮等[11]方法,評價桉葉多酚提取物2,2’-聯氮-雙(3-乙基苯并噻唑啉-6-磺酸)(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)陽離子自由基清除率。準備ABTS儲備液,再配成ABTS工作液,現配現用,734 nm波長處吸光度為0.70±0.02。取不同質量濃度桉葉多酚提取物10 μL到96 孔板,再加200 μL ABTS工作液,振蕩混勻10 s,避光反應10 min;以空白溶劑作參照、抗壞血酸為陽性對照,在405 nm波長處測定吸光度,每個樣品3 個平行。ABTS陽離子自由基清除率按公式(2)計算。
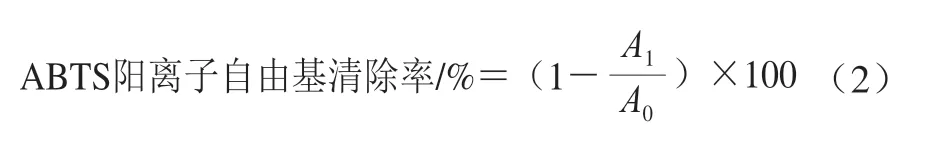
式中:A1為10 μL樣品溶液+200 μL ABTS工作液的吸光度;A0為10 μL空白溶劑+200 μL ABTS工作液的吸光度。
1.3.2.3 超氧陰離子自由基清除能力測定
參考Giese等[15]方法,評價桉葉多酚提取物超氧陰離子自由基清除率。反應體系包括1 mL不同質量濃度(0.025~0.4 mg/mL)桉葉多酚提取物儲備液、4.5 mL Tris-HCl(0.1 mol/L、25 ℃)及1 mL鄰苯三酚(3 mmol/L、25 ℃),混勻后反應4 min;加入0.5 mL HCl(8 mol/L)終止反應,在320 nm波長處測定吸光度A1;以去離子水代替樣品在320 nm波長處測定吸光度A3;以去離子水代替鄰苯三酚在320 nm波長處測定吸光度A2;以抗壞血酸為陽性對照,每個樣品3 個平行。超氧陰離子自由基清除率按公式(3)計算。
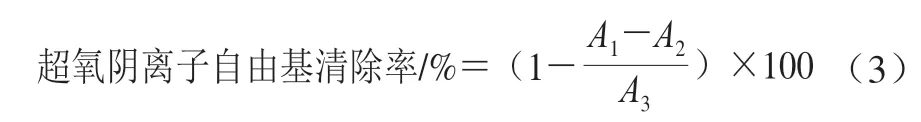
1.3.2.4 總還原能力測定
參考Shon等[16]方法,評價桉葉多酚提取物還原能力。反應體系包括2.5 mL不同質量濃度(0.025~0.4 mg/mL)桉葉多酚提取物溶液和2.5 mL鐵氰化鉀(質量分數1%),50 ℃下反應20 min,再加入2.5 mL三氯乙酸(10%)。混勻后離心(3 000 r/min、10 min),取5 mL上清液、5 mL蒸餾水及1 mL三氯化鐵(質量分數0.1%),混勻后在700 nm波長處測定吸光度。吸光度越大表明還原能力越強。
1.3.3 桉葉多酚提取物對H2O2誘導RAW264.7巨噬細胞氧化損傷的保護作用
1.3.3.1 MTT法檢測桉葉多酚提取物對RAW264.7巨噬細胞活性的影響
RAW264.7巨噬細胞培養在10%胎牛血清、5%雙抗及DMEM基礎培養基配成的完全培養基中,在37 ℃、5% CO2培養箱中培養。
將處于生長對數期RAW264.7巨噬細胞接種在96 孔板中,每孔200 μL(1×104個/孔),孵育24 h。去除上清液,以不同質量濃度桉葉多酚提取物處理細胞24 h。再將20 μL 5 mg/mL MTT溶液培養細胞4 h。去除上清液后以PBS洗3 次細胞,最后加入150 mL DMSO,振蕩溶解10 min,在570 nm波長處測定吸光度。以DMSO為空白對照,以正常細胞為對照,細胞活性按公式(4)計算。
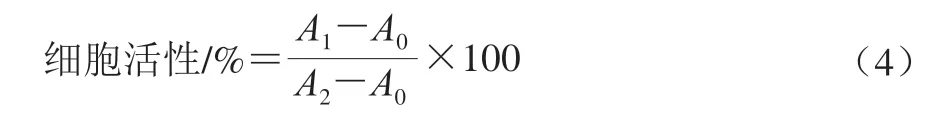
式中:A0為空白吸光度;A1為樣品吸光度;A2為對照吸光度。
1.3.3.2 MTT法檢測桉葉多酚提取物對H2O2誘導氧化損傷細胞活性的影響
將處于生長對數期RAW264.7巨噬細胞接種在96 孔板中,每孔200 μL(1×104個/孔),孵育24 h。將實驗分成5 個處理組:對照組加入完全培養基,模型組加入終濃度為400 μmol/L H2O2,實驗組細胞以不同質量濃度桉葉多酚提取物(低、中、高劑量組分別為12.5、25、50 μg/mL)預處理24 h后再加入H2O2(終濃度為400 μmol/L)誘導損傷。損傷24 h,再將20 μL 5 mg/mL MTT溶液培養細胞4 h。去除上清液后以PBS洗滌3 次細胞,最后加入150 mL DMSO,振蕩溶解10 min,在570 nm波長處測定吸光度。細胞存活率計算公式同1.3.3.1節。
1.3.3.3 氧化損傷細胞中MDA和GSH含量、T-SOD和CAT活力的測定
將處于生長對數期的RAW264.7巨噬細胞接種在6 孔板中,每孔2 mL(20×104個/孔),孵育24 h。將實驗分成6 個處理組:對照組加入完全培養基;模型組加入終濃度為400 μmol/L的H2O2;陽性對照組以25 μg/mL抗壞血酸預處理24 h后再加入H2O2(終濃度為400 μmol/L)誘導損傷;實驗組細胞以不同濃度桉葉多酚提取物(低、中、高劑量組分別為12.5、25、50 μg/mL)預處理24 h后再加入H2O2(終濃度為400 μmol/L)誘導損傷。損傷處理24 h,去除上清液后以PBS清洗3 遍,收集細胞。按照試劑盒說明書測定細胞內MDA和GSH含量、T-SOD和CAT活力。
1.3.4 桉葉多酚提取物對線蟲抗氧化能力的影響
1.3.4.1 線蟲培養
以涂有大腸桿菌OP50(E. coliOP50)的標準培養基(nematome growth medium,NGM)培養線蟲,培養溫度20 ℃,根據線蟲生長狀況定期將線蟲轉移到新的涂有E. coliOP50NGM培養基中。
1.3.4.2 ROS水平測定
將同期化后的線蟲在樣品培養基中培養96 h,將線蟲轉移到NGM 3 次。挑取50 條線蟲轉移到含有50 μL PBS的96 孔板(不透光),再加入50 μL 100 μmol/L H2DCF-DA溶液,以不含線蟲的H2DCF-DA溶液作對照。立即將96 孔板置于酶標儀中測定熒光強度:反應溫度25 ℃、發射波長528 nm、激發波長485 nm,每隔15 min測一次,反應12 h,每組實驗重復3 次。
1.3.4.3 線蟲壽命實驗
將同期化后的蟲卵孵育在樣品培養基上,20 ℃恒溫生化培養箱中培養48 h至L4期幼蟲。挑取L4期幼蟲到新的各組平板上(每組3 個平板,每個平板30 條)繼續培養。線蟲生殖期每天將線蟲轉移到新的各組平板中,其他時期每2 d轉移到新的平板中,記錄線蟲生存、死亡及剔除情況,直到實驗結束(線蟲存活天數從卵孵化第1天算起)。線蟲死亡判斷標準:用鉑絲輕觸蟲體無反應,即視為死亡。線蟲剔除標準:逃出培養基而干死的線蟲、蟲卵在體內孵化而成袋樣蟲、鉆入瓊脂中線蟲。
1.3.4.4 線蟲體內抗氧化能力測定
按照1.3.4.3節所述,培養96 h后,將各組線蟲轉移到NGM培養基上,再用1 mL PBS(pH 7.2~7.4)洗滌培養皿并分別收集成蟲。在4 000 r/min條件下離心1 min,重復3 次,保留蟲液用于勻漿。再用組織破碎儀(60 Hz、30 s)在冰浴條件下將蟲體破碎兩次,勻漿液在10 000×g、4 ℃離心10 min,上清液備用待測。參照試劑盒說明書測定抗氧化能力(MDA含量和GSH-Px、T-SOD、CAT活力)。
1.4 數據統計與分析
數據結果以平均值±標準差表示,采用SPSS 18.0軟件進行單因素方差分析并用最小顯著性差異法進行多重比較,顯著水平設置為P<0.05和P<0.01。
2 結果與分析
2.1 桉葉多酚提取物制備與純化結果
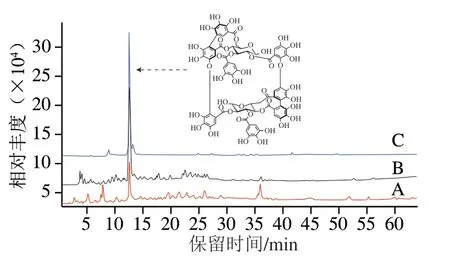
圖 1 桉葉多酚提取物純化前后高效液相色譜圖Fig. 1 High performance liquid chromatograms of PEPE before and after purification
由圖1 可知,相對于純化前桉葉多酚提取物,純化后桉葉多酚提取物中月見草素B峰面積明顯增大,純化方法起到有效分離作用。經計算,純化前桉葉多酚提取物總多酚含量為(294.36±27.32)mg/g,月見草素B 含量為(94.53±11.0 7)mg/g;純化后,桉葉多酚提取物總多酚含量為(51 3.4 9±41.25)mg/g,其中月見草素B含量為(384.90±34.73)m g/g。純化后桉葉多酚提取物中總多酚和月見草素B含量分別提高74.45%和307.17%。進一步對純化后桉葉多酚進行營養成分檢測,可得粗蛋白質、粗脂肪、灰分質量分數分別為(2.25±0.46)%、(1.37±0.24)%、(0.97±0.39)%,以純化后桉葉多酚開展后續實驗。
2.2 桉葉多酚提取物體外抗氧化活性
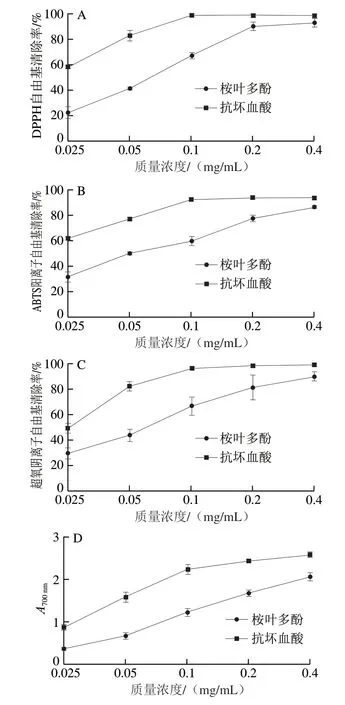
圖 2 桉葉多酚提取物體外抗氧化能力Fig. 2 Antioxidant activity in vitro of PEPE
由圖2A可知,桉葉多酚提取物和抗壞血酸的DPPH自由基清除率隨著質量濃度增大呈劑量依賴性增大;桉葉多酚提取物和抗壞血酸半抑制質量濃度(50%inhibiting concentration,IC50)分別為0.06 mg/mL和0.021 mg/mL。當桉葉多酚提取物質量濃度為0.4 mg/mL時,最大清除率為(93.09±5.38)%,這也說明桉葉多酚提取物在一定質量濃度時具有良好的DPPH自由基清除能力,此時與抗壞血酸無明顯差異。桉葉多酚提取物的清除機理可能是多酚中具有多種供氫體,能將DPPH自由基還原成黃色的DPPH—H;隨著桉葉多酚提取物質量濃度增高,供氫能力增強,表現出高效的DPPH自由基清除率和更低的IC50。這種推測與范金波等[17]研究結論一致,該研究指出咖啡酸具有良好供氫能力,能有效清除DPPH自由基。
由圖2B可知,隨著樣品質量濃度增大,桉葉多酚提取物和抗壞血酸ABTS陽離子自由基清除能力逐漸增強;其中抗壞血酸大于0.1 mg/mL時清除率達到平穩期,IC50為0.016 mg/mL,而桉葉多酚提取物IC50為0.052 mg/mL。清除ABTS陽離子自由基的原理與清除DPPH自由基不同,主要是電子轉移的過程;ABTS也更容易反應,因為它既親水也親脂。本實驗中桉葉多酚提取物表現出良好的ABTS陽離子自由基清除能力,與其供電子能力強有關;前期研究也表明不同月份桉葉多酚提取物能有效清除ABTS陽離子自由基[18]。
由圖2C可知,本實驗采用鄰苯三酚自氧化法測定桉葉多酚提取物超氧陰離子自由基清除能力,清除效果呈量效關系,多酚含量越高,清除能力越強;桉葉多酚提取物IC50為0.056 mg/mL,而抗壞血酸為0.025 mg/mL。當桉葉多酚提取物質量濃度為0.4 mg/mL,清除超氧陰離子自由基能力與抗壞血酸無明顯差異。超氧陰離子自由基是線粒體呼吸鏈過程中產生的,它能與金屬離子發生Fenton反應,生成羥自由基,進而造成細胞損傷;中和過量的超氧陰離子自由基有利于提高線粒體抗氧化能力[19]。總之,桉葉多酚提取物達到一定質量濃度時,具有良好的清除超氧陰離子自由基能力。
多酚能使反應體系中Fe3+還原成Fe2+,溶液由黃色變成不同程度的藍色[20];還原能力越強,吸光度越大。由圖2D可知,隨著樣品質量濃度增大,桉葉多酚提取物和抗壞血酸吸光度逐漸增大,表現出良好還原能力。還原能力可延緩或終止自由基反應,實驗結果提示桉葉多酚提取物的優異抗氧化活性,多酚質量濃度越高還原能力越強。
桉葉多酚是一種具有良好抗氧化活性的天然活性多酚,前期研究指出桉葉多酚提取物能有效清除DPPH自由基、ABTS陽離子自由基,提高鐵離子還原能力和抗脂質過氧化能力[21]。王俊亮等[11]指出多酚類物質是桉葉提取物中主要抗氧化成分,桉葉多酚比相同質量濃度下茶葉粗提物具有更好的抗氧化活性。本實驗通過溶劑萃取方法對桉葉多酚提取物進行分離純化,得到多酚含量較高的桉葉多酚提取物。實驗結果表明,純化后的桉葉多酚提取物具有更高的DPPH自由基、ABTS陽離子自由基、超氧陰離子自由基清除能力及鐵離子還原能力。然而僅僅采用體外抗氧化評價方法是不全面的,需要系統研究桉葉多酚提取物的抗氧化能力,因此進一步開展桉葉多酚提取物對細胞抗氧化能力的影響。
2.3 桉葉多酚提取物對H2O2誘導RAW264.7巨噬細胞氧化損傷的保護作用
2.3.1 桉葉多酚提取物對細胞活性的影響
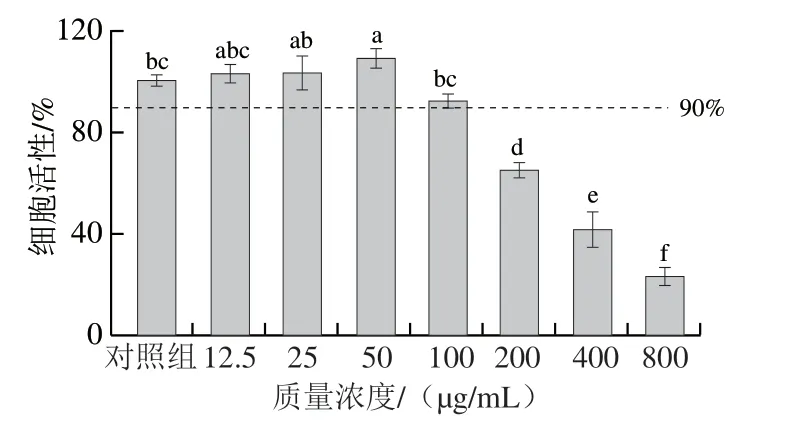
圖 3 桉葉多酚提取物對RAW264.7巨噬細胞活性的影響Fig. 3 Effect of PEPE on the viability of RAW264.7 cells
采用MTT法分析桉葉多酚提取物對RAW264.7巨噬細胞的影響。由圖3可見,相比于對照組,當桉葉多酚提取物質量濃度在12.5~100 μg/mL時,細胞活性均高于90%,且在12.5~50 μg/mL范圍內具有一定促進細胞增殖的效果;當桉葉多酚提取物質量濃度在200~800 μg/mL時,細胞活性受到顯著抑制(P<0.05)。因此選擇12.5、25、50 μg/mL作為后續實驗的桉葉多酚提取物質量濃度。
2.3.2 桉葉多酚提取物對H2O2誘導氧化損傷細胞活性的影響
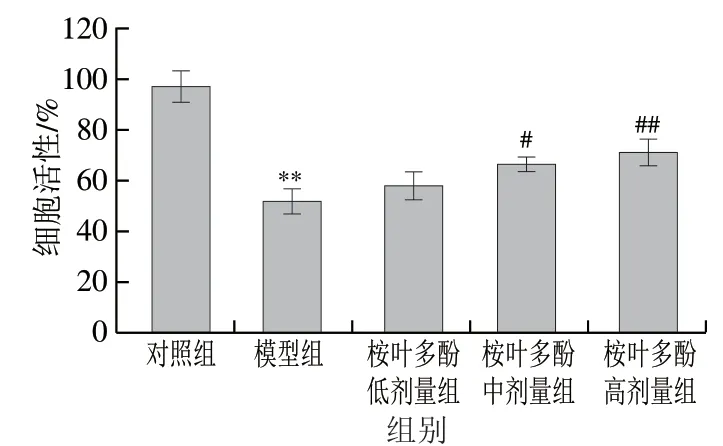
圖 4 桉葉多酚提取物對氧化損傷RAW264.7巨噬細胞活性的影響Fig. 4 Effect of PEPE on the viability of RAW264.7 cells with H2O2-induced damage
基于本實驗室前期研究,以400 μmol/L H2O2誘導RAW264.7巨噬細胞氧化損傷。由圖4可見,模型組細胞存活率極顯著低于對照組(P<0.01),此時細胞活性為(51.67±9.77)%,說明造模成功。此外,桉葉多酚提取物處理組細胞活性隨質量濃度增大呈上升趨勢,其中25 μg/mL和50 μg/mL桉葉多酚提取物組細胞活性分別顯著高于模型組27.94%和37.66%(P<0.05,P<0.01);這說明桉葉多酚提取物具有良好的抗氧化效果,能減輕細胞氧化損傷,有效保護細胞。
2.3.3 桉葉多酚提取物對細胞抗氧化能力的影響
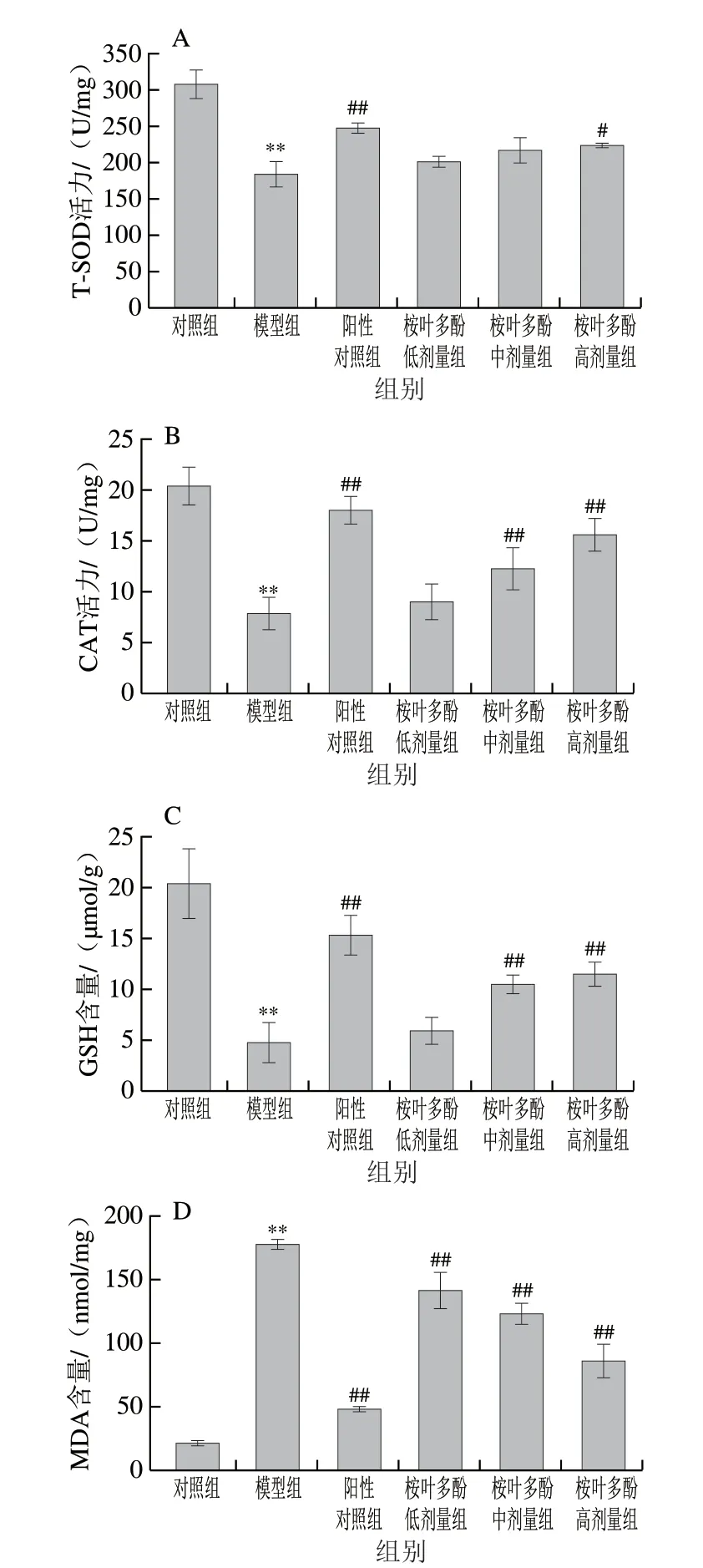
圖 5 桉葉多酚提取物對氧化損傷細胞抗氧化能力的影響Fig. 5 Protective effect of PEPE on oxidative damage in cells
以T-SOD、CAT活力、GSH及MDA水平為評價指標,探究桉葉多酚提取物對氧化損傷細胞的保護作用。細胞抗氧化防御系統包括酶類(T-SOD、GSH-Px、CAT等)和非酶物質(GSH等),它們在細胞處于氧化應激狀態時能有效清除過量的自由基,起到保護細胞的作用[22]。而MDA作為脂質氧化產物之一,直接反映細胞脂質過氧化損傷程度。由圖5可知,相比于對照組,模型組細胞中T-SOD、CAT活力及GSH含量極顯著降低(P<0.01),而MDA含量極顯著升高(P<0.01)。這說明細胞在受到外源性H2O2刺激后,細胞通過Fenton反應等方式產生過量的高活性自由基(羥自由基、單線態氧等)造成細胞氧化損傷[23]。由圖5A、B可知,相比于模型組,50 μg/mL桉葉多酚提取物能顯著提高細胞內T-SOD活性(P<0.05);且桉葉多酚提取物中高劑量組均能極顯著提高CAT活力(P<0.01),其中50 μg/mL桉葉多酚提取物組細胞CAT活力與抗壞血酸組接近,說明桉葉多酚提取物通過提高抗氧化酶活性,有效改善H2O2誘導RAW264.7巨噬細胞的氧化損傷。相似研究指出金銀花黃酮能顯著提高H2O2誘導細胞及上清液的T-SOD及CAT活力[24],這與其調節細胞氧化還原系統有關;金銀花黃酮能清除過量自由基及有害物質,維持細胞膜穩定。此外,圖5C也表明桉葉多酚提取物中、高劑量組極顯著提高細胞內GSH含量(P<0.01),呈量效關系。GSH作為細胞內重要的非酶抗氧化物質,在細胞內能有效清除超氧陰離子、H2O2等。桉葉多酚提取物通過提高GSH含量的方式一定程度上清除產生的自由基和有害物質,緩解細胞的氧化損傷,這與宋家樂等[25]報道結果一致。MDA作為細胞內脂質過氧化的副產物,常用作評價細胞氧化損傷程度。本實驗中也發現桉葉多酚提取物呈質量濃度依賴性降低氧化損傷細胞中MDA含量,最高降低51.84%。總體來說,桉葉多酚提取物能有效提高氧化損傷細胞中T-SOD、CAT活力及GSH含量,降低MDA含量,起到清除自由基以保護氧化損傷細胞的作用。
H2O2是誘導細胞氧化損傷常用的一種化學物質,能較好地模擬自由基誘導細胞凋亡。在本實驗中,桉葉多酚提取物能有效改善H2O2誘導氧化損傷RAW264.7巨噬細胞的活性,這與其抗氧化能力有關,具體表現在桉葉多酚提取物能顯著提高細胞內抗氧化酶活性和抗氧化物質含量,降低MDA含量。相似研究指出小葉薄荷黃酮提取物可降低MDA和乳酸脫氫酶水平,提高SOD、GSH-Px、CAT活性,減輕H2O2誘導的HUVEC細胞氧化損傷[26]。氧化應激常常與活性氧(reactive oxygen species,ROS)的產生有關,而ROS包括超氧陰離子自由基、H2O2及其下游過氧化物等,細胞內過量的ROS會加劇氧化損傷[27]。Wang Xu等[28]的報道支持這個理論,發現氧化損傷后的RAW264.7巨噬細胞內ROS水平顯著提高,而蝦青素能有效降低氧化損傷細胞內的ROS水平,通過提高SOD活性和降低MDA含量的方式提高細胞抗氧化狀態,達到保護氧化損傷細胞的作用。桉葉多酚提取物作為一種富含多酚類物質的提取物,同樣能起到有效減輕細胞氧化損傷的作用,這可能與其多種活性成分的綜合藥理效應有關[29]。雖然桉葉多酚在化學和細胞抗氧化中表現出良好的抗氧化能力,但其在生物體內是能否起到相當的抗氧化作用仍需要證實。多酚類物質在體內的吸收和代謝、聚合程度等都影響其在體內發揮生物學效應[30],因此,對桉葉多酚提取物體內抗氧化活性評價是必要的。
2.4 桉葉多酚提取物對線蟲抗氧化能力的影響
2.4.1 桉葉多酚提取物質量濃度篩選
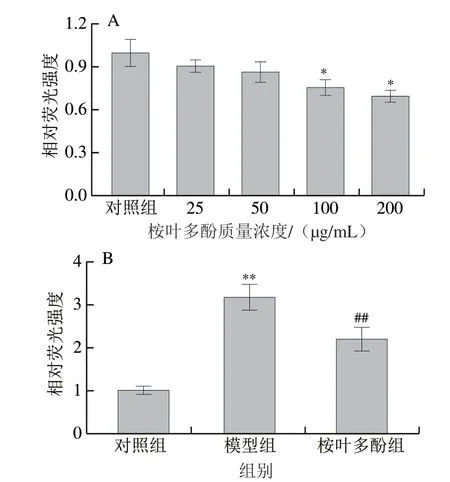
圖 6 桉葉多酚提取物對線蟲體內ROS水平的影響Fig. 6 Effect of PEPE treatment on reactive oxygen species accumulation in C. elegans
探究桉葉多酚提取物在常規培養及氧化損傷條件下對線蟲體內ROS積累量的影響。ROS作為細胞新陳代謝過程中的產物,能引起細胞內蛋白質變性、脂質氧化等[31]。本實驗首先以不同質量濃度(25~200 μg/mL)桉葉多酚提取物培養線蟲96 h,通過熒光探針檢測線蟲體內ROS積累量。圖6A表明,隨著桉葉多酚提取物質量濃度增大,線蟲體內ROS積累量逐漸降低;相比于對照組,當桉葉多酚提取物質量濃度為100 μg/mL和200 μg/mL時,ROS積累量分別下降24.61%和30.48%(P<0.05)。此時,兩個質量濃度桉葉多酚提取物組間無顯著差異(P>0.05),因此選用100 μg/mL開展后續實驗。為了進一步研究桉葉多酚提取物在線蟲氧化應激狀態下是否起作用,實驗將同期化后的線蟲(100 μg/mL桉葉多酚提取物培養96 h)在1 mmol/L H2O2下刺激24 h,測定線蟲體內ROS積累量。如圖6B所示,H2O2處理組線蟲ROS積累量極顯著高于對照組(P<0.01),說明H2O2處理后線蟲發生氧化損傷;而桉葉多酚提取物處理后的線蟲體內ROS積累量極顯著下降29.97%。綜上,100 μg/mL桉葉多酚提取物能有效降低線蟲體內ROS積累,起到保護線蟲的作用。
2.4.2 桉葉多酚提取物對線蟲壽命的影響
以100 μg/mL桉葉多酚提取物培養線蟲,評價桉葉多酚提取物對線蟲壽命的影響。由圖7可知,相比于對照組,桉葉多酚提取物組線蟲生存曲線發生高度顯著右移(P<0.01),說明桉葉多酚提取物處理后線蟲整體壽命高于對照組。表1顯示桉葉多酚提取物組線蟲最長壽命和中位壽命均顯著高于對照組(P<0.05),分別提高14.12%和14.03%。推測桉葉多酚提取物良好的抗氧化活性間接起到延長線蟲壽命的作用,這種推測與Luo Siyuan等[32]研究一致,其發現橄欖葉提取物能提高線蟲壽命,線蟲體內抗氧化酶及基因均顯著提高。總之,桉葉多酚提取物能有效延長線蟲壽命,這可能與其良好的抗氧化活性有關。
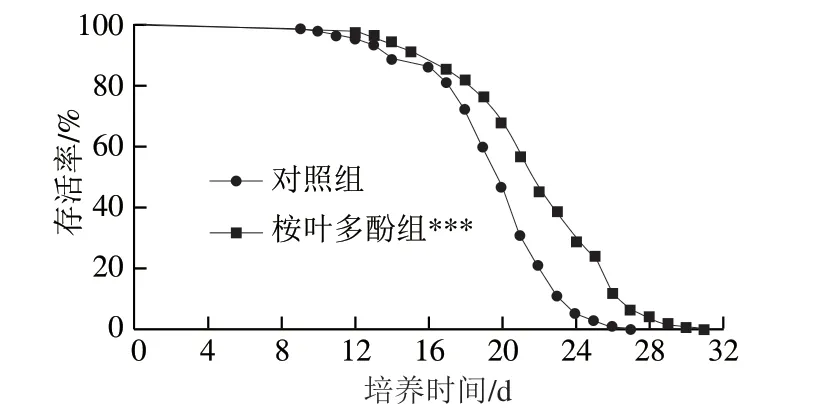
圖 7 桉葉多酚提取物對線蟲壽命的影響Fig. 7 Effect of PEPE on the lifespan of C. elegans
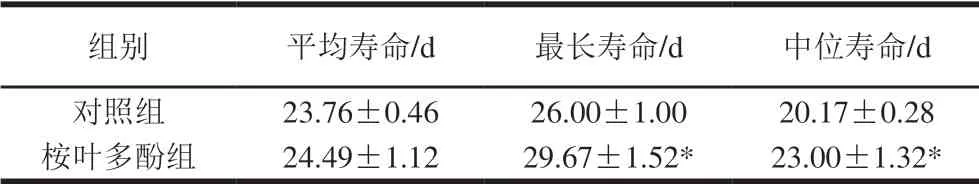
表 1 桉葉多酚提取物對線蟲壽命的影響(n=60)Table 1 Effect of PEPE on the lifespan of C. elegans (n= 60)
2.4.3 桉葉多酚提取物對線蟲抗氧化能力的影響
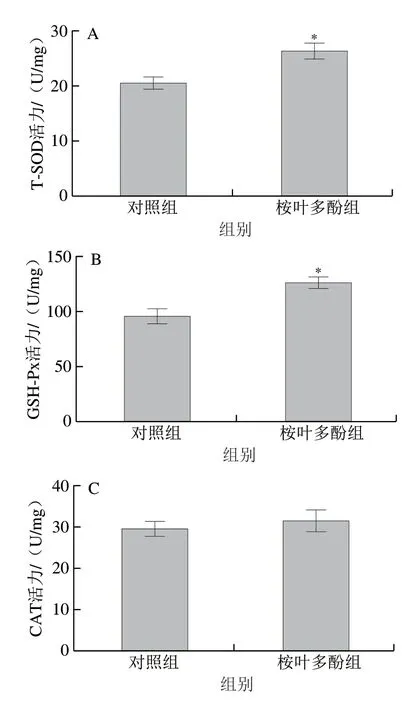
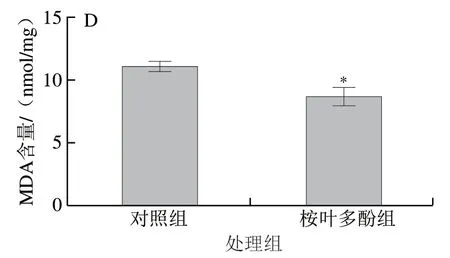
圖 8 桉葉多酚提取物對線蟲抗氧化能力的影響Fig. 8 Effect of PEPE on the antioxidant capacity of C. elegans
為了進一步驗證桉葉多酚提取物抗氧化作用與延長線蟲壽命有關,實驗測定桉葉多酚提取物處理后線蟲體內抗氧化指標。由圖8可知,相比于對照組,桉葉多酚提取物組線蟲體內T-SOD和GSH-Px活力分別顯著提高28.64%和32.45%(P<0.05),MDA含量下降21.48%(P<0.05)。這說明桉葉多酚提取物能有效提高線蟲抗氧化能力,降低新陳代謝過程中產生的自由基含量,起到延長線蟲壽命的作用。相似研究也指出鼠尾草酚能顯著提高線蟲抗氧化能力,實現提高線蟲壽命的作用[33]。綜上,桉葉多酚提取物能顯著提高線蟲抗氧化能力。
本實驗以秀麗隱桿線蟲評價桉葉多酚提取物抗氧化活性評價,該模型具有穩定性好、周期短、費用低等特點。線蟲60%~80%基因與人類相應基因具有同源性,特別地,線蟲體內存在的抗氧化酶與人體相似(SOD和CAT),也含有谷胱甘肽S轉移酶和過氧化物酶基因等[34-35]。在本實驗中,桉葉多酚提取物能降低常規和應激條件下線蟲體內的ROS積累量,表現出良好的抗氧化潛力。過量的ROS會引起線蟲氧化損傷(蛋白質損傷、脂質氧化、DNA受損等),進而造成壽命縮短。這也說明桉葉多酚提取物可能提高了線蟲的耐受能力而延長線蟲壽命。有研究指出長壽型的突變體線蟲往往具有較高抵抗應激的能力,從而延長線蟲壽命[36]。壽命實驗進一步證實桉葉多酚提取物能顯著提高線蟲最長壽命和中位壽命,這可能與其降低線蟲生長過程中ROS的積累有關。此外,桉葉多酚提取物能顯著提高線蟲體內抗氧化酶(SOD、GSH-Px、CAT)活力,降低MDA含量,推測這是其降低線蟲體內ROS水平及延長壽命的部分原因。相似研究也指出紫薯提取物顯著提高線蟲體內抗氧化酶活力(SOD、CAT)是延長線蟲壽命的作用機制之一[37]。總體而言,桉葉多酚提取物體外抗氧化作用與線蟲體內的結果一致,更能準確反映其在生物體內的抗氧化效用,為桉葉多酚提取物進一步開發成食品抗氧化劑或功能食品提供參考。
3 結 論
本研究表明桉葉多酚提取物能有效清除DPPH自由基、ABTS陽離子自由基及超氧陰離子自由基,具有良好還原能力。細胞實驗指出桉葉多酚提取物提高細胞內T-SOD活力、CAT活力及GSH含量,降低MDA含量,清除細胞內過量自由基和有害物質,起到保護氧化損傷細胞的作用。此外,體內實驗也發現桉葉多酚提取物能降低線蟲體內ROS積累,提高抗氧化酶活力(T-SOD、GSH-Px),達到延長線蟲壽命的效果。本研究仍存在不足之處,如桉葉多酚純度不夠、抗氧化作用機制研究不深等,還需要進一步實驗探究桉葉多酚中活性成分與生理功能的關系。總之,本實驗結果初步表明桉葉多酚提取物具有良好的體內外抗氧化效果,具有一定的研究價值。

