C顯帶和N顯帶技術在標記染色體和雙著絲粒染色體輔助診斷中的應用*
徐玉嬋,韋德寧,羅穎花,韋朔峰,蔡 稔,唐 寧,嚴提珍
柳州市婦幼保健院/廣西科技大學附屬婦產醫院、兒童醫院醫學遺傳科/柳州市生殖與遺傳研究所,廣西柳州 545001
C顯帶技術由ARRIGHI和HSU于1971年發明,一般認為C顯帶深染的區域是結構異染色質區域,也就是DNA高度重復序列區域。人類近端著絲粒染色體(13、14、15、21和22號染色體)的副縊痕處與核仁形成有關,故稱為核仁形成區(NOR),用N顯帶技術(硝酸銀染色法)可使染色體的隨體及核仁組織區出現特異性的黑色銀染物[1]。目前,C顯帶和N顯帶技術的相關研究很少,本實驗室在工作中發現C顯帶和N顯帶技術除了輔助診斷染色體多態性以外,對雙著絲粒染色體、標記染色體(mar)的分析也具有一定的意義,現報道如下。
1 資料與方法
1.1一般資料 選取2018年3月至2020年2月于柳州市婦幼保健院進行外周血染色體核型分析的就診者19 560例為研究對象。
1.2方法
1.2.1標本采集 取受試者外周血2 mL,置于肝素抗凝的無菌真空采血管中,輕輕顛倒混勻后運送到實驗室檢測。
1.2.2染色體核型分析(G顯帶) 將外周血標本0.5 mL接種于淋巴細胞培養液,37 ℃培養72 h后進行常規染色體制備及G顯帶。計數20個中期分裂相細胞,分析5個及以上核型,當發現嵌合體或異常細胞時,再增加計數至100個中期分裂相細胞。必要時采用C顯帶、N顯帶進行輔助診斷。染色體核型描述采用人類細胞基因組學國際命名體系(ISCN)2016年版的相關標準。
1.2.3染色體分析(C顯帶) 將制好的玻片置于0.2 mol/L氯化氫中,室溫下處理5 min,然后用60 ℃蒸餾水沖凈;浸入60 ℃的5%氫氧化鋇液中1~4 min,蒸餾水沖凈;在60 ℃的2×SSC液中處理10 min,蒸餾水沖凈;以稀釋10倍的吉姆薩染液染色5~10 min(37 ℃),沖洗、晾干。
1.2.4染色體分析(N顯帶) 將制好的玻片置于干燥培養皿并放入60 ℃水浴箱中,新鮮配制0.1%甲酸1 mL,加入0.5 g硝酸銀,充分溶解后滴在覆蓋了兩層擦鏡紙的玻片上,直至擦鏡紙呈棕黃色,取走擦鏡紙,將玻片沖洗后以吉姆薩染液染色5~10 min(37 ℃),沖洗、晾干。
1.3統計學處理 采用Excel2010進行數據分析。
2 結 果
2.1C、N顯帶技術對染色體多態性的檢出情況 19 560例外周血染色體核型分析中,經G顯帶結合C顯帶和N顯帶檢出的染色體多態共199例,檢出率為1.02%;其中涉及異染色質的有142例,占71.36%,涉及核仁區變異的有57例,占28.64%。染色體多態檢出的人群中以不孕不育、不良妊娠史、反復流產等原因就診的有126例,占63.32%,其中不孕不育為主要就診原因,占51.59%(65/126),具體的染色體多態類型及構成比見表1。
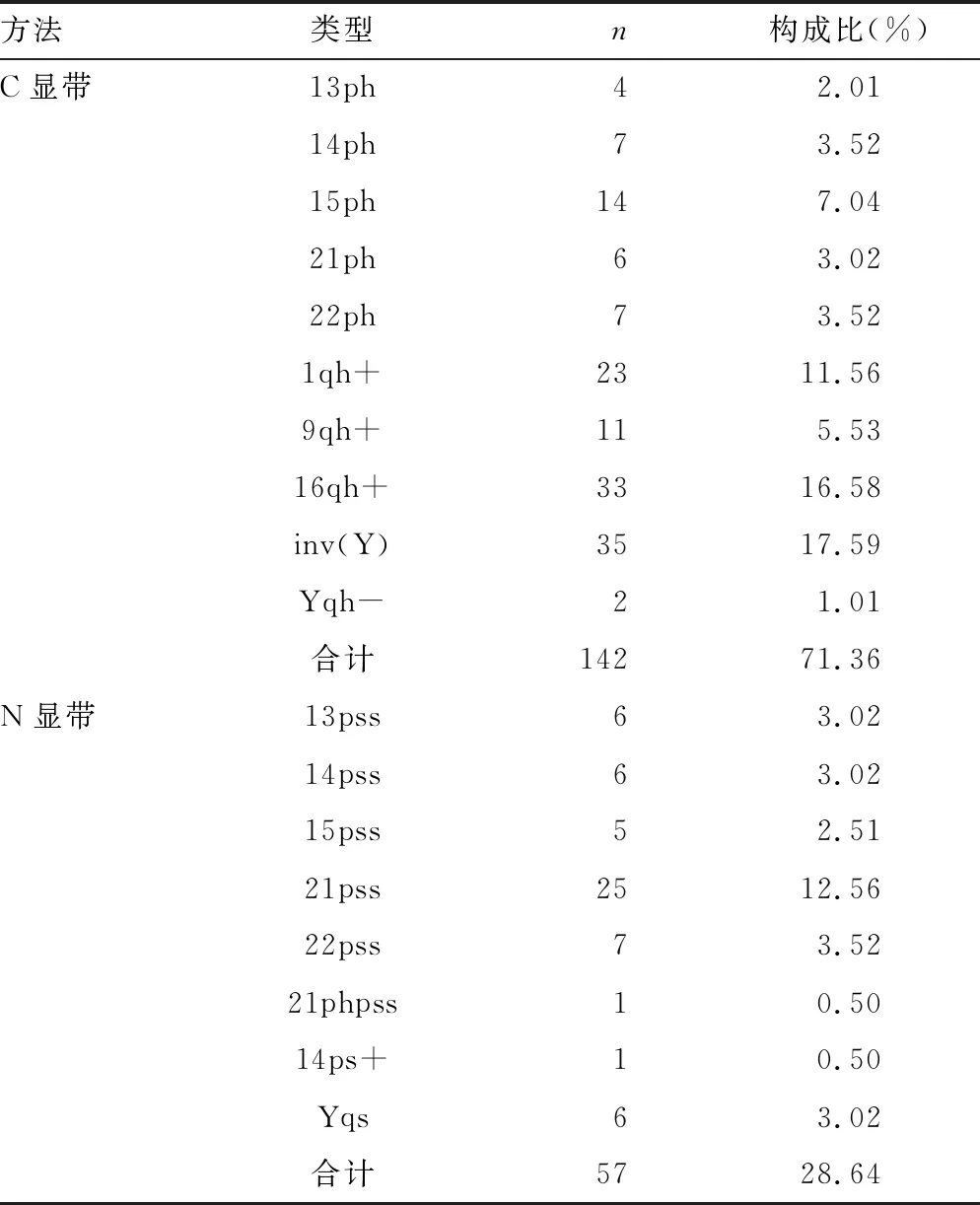
表1 199例外周血染色體多態類型和構成比
2.2C、N顯帶技術對mar的輔助診斷意義 19 560例外周血染色體核型分析中,檢出7例mar,進行C、N顯帶分析,發現其中有5例N顯帶見兩端有隨體,C顯帶見深染或部分深染的異染色質。臨床表現以不孕不育為主,3例不育,2例不孕,1例發育遲緩。其中1例36歲的不孕女性染色體核型為48,XX,+2mar,2個形態相似的mar N顯帶見頭尾兩端均有隨體(圖1),C顯帶見深染的異染色質(圖2)。另有1例智力低下的6歲患兒染色體核型為47,XX,+mar[26]/46,XX[81],其較低比例的嵌合型mar N顯帶未見隨體,C顯帶未見異染色質。

注:箭頭所示的2個mar均有雙隨體。

注:箭頭所示的2個mar均為深染的異染色質。
2.3C顯帶對雙著絲粒染色體的輔助診斷意義 G顯帶結合C顯帶確證各類型雙著絲粒染色體核型6例,其中4例涉及性染色體,2例是等臂雙著絲粒Y染色體和45,X細胞系的嵌合體。就診原因中有3例矮小癥,2例不育,1例發育遲緩。其中1例4歲女性患兒因矮小癥就診,染色體核型分析為等臂雙著絲粒X染色體,經C顯帶發現其中1個著絲粒較松散,呈細線狀,是沒有活性的假著絲粒,核型為46,X,psu idic(X)(p22.1)。另有1例11歲男性矮小癥患兒染色體核型為等臂雙著絲粒Y染色體,經C顯帶發現2個著絲粒較致密,均為有活性的真著絲粒,核型為46,X,idic(Y)(p11.3)[88]/45,X[12]。
3 討 論
染色體多態性是指不同個體之間染色體結構和染色體著色強度存在恒定的細小差別,通常指D、G組染色體隨體區變異(主要包括隨體區增大、雙隨體)及1、9、16號染色體副縊痕增加或缺失等,傳統觀點認為上述變異不會引起表型效應,但也有不少學者認為染色體多態性降低了受精率和優質胚胎率,與男性無精、少精等生育異常密切相關,也是導致女性不良妊娠的重要因素[2-4]。本研究中,染色體多態檢出率為1.02%,檢出的人群以不孕不育、不良妊娠史、反復流產等原因就診多見,又以不孕不育為主要就診原因,占51.59%。
mar是指通過常規細胞遺傳學顯帶技術可以辨認但無法確定其來源或特征的染色體。mar的發生率在新生兒中為0.044%,在不孕不育人群中為0.125%,在發育遲緩患兒中為0.288%[5]。細胞遺傳學中C顯帶和N顯帶技術與分子診斷技術相結合,可以對額外小標記染色體(sSMCs)的性質、來源和致病性進行明確診斷[6]。據文獻報道,來源于常染色體的mar約80%為D、G組染色體,30%~50% 為15號染色體重復片段[5,7]。家族遺傳性和由異染色質組成的mar臨床表型正常,而新發的包含常染色質的mar常導致異常臨床表型。人類的近端著絲粒染色體(D、G組)短臂細長易斷裂,斷裂重接后沒有與原來的染色體長臂連接,而是兩端著絲粒的短臂連接,最終形成具有雙隨體的mar,由于其斷裂處靠近著絲粒,具有著絲粒功能,所以可隨細胞分裂而穩定的向子代傳遞。近端著絲粒染色體的短臂暫未發現有致病基因,所以這類mar一般認為其臨床表型是正常的[8]。楊蘭等[9]對攜帶sSMCs的26例患者進行C、N顯帶分析,發現17例含有隨體片段,2例含有異染色質片段,1例同時含有隨體和異染色質片段,5例sSMCs可能是常染色質來源。席惠等[10]通過聯合運用多種技術鑒別4例胎兒新發mar,其中C顯帶示2例為異染色質結構,胎兒出生后生長發育均在正常范圍內;2例為非異染色質結構,進一步行單核苷酸多態芯片檢測,結果示1例未見致病性改變,1例為4號染色體部分重復。本研究發現的7例mar中,有5例N顯帶見兩端有隨體,C顯帶見深染或部分深染的異染色質,臨床表型主要為不孕不育。另有1例6歲患兒雖為較低比例的嵌合型 mar,卻表現為智力低下,其N顯帶未見隨體,C顯帶未見異染色質。由于經濟原因,該患兒并未進一步行染色體微陣列分析(CMA)或基因組拷貝數變異測序(CNV-seq)等分子診斷技術來鑒別mar的來源和致病性。
雙著絲粒染色體是由兩條非同源或同源染色體發生一次末端缺失后,兩段具有著絲粒的片段重接形成,如果是兩條同源染色體片段斷裂重接,兩臂成鏡像關系,則稱為等臂雙著絲粒染色體,其在健康人群中非常少見,多見于經染色體斷裂劑處理、白血病及骨髓增生異常患者的骨髓染色體核型[11-13]。少數雙著絲粒染色體中的1個著絲粒失活,僅存在1個具有功能活性的著絲粒,且具有穩定的結構[14],稱為假雙著絲粒染色體。鑒別雙著絲粒染色體的兩個著絲粒是否都具有活性,即判斷雙著絲粒的真假性,可初步從G顯帶結果判斷,一般有活性的著絲粒比較致密,有明顯的縮窄,無活性的著絲粒較疏松,縮窄不明顯,當G顯帶不明顯無法鑒別時可借助C顯帶。本研究中,1例4歲女性患兒因矮小癥就診,染色體核型分析G顯帶為等臂雙著絲粒X染色體,經C顯帶發現其中1個著絲粒較松散,呈細線狀,是沒有活性的假著絲粒。雙著絲粒染色體在細胞分裂時是不穩定的,因此可形成不同類型的細胞系,且多為與45,X細胞系的嵌合體。嚴芳等[15]發現,6例性別混亂患者染色體核型均為等臂雙著絲粒Y染色體,其中5例與45,X細胞系嵌合,且Y染色體斷裂點的不同及45,X在細胞系中所占比例的差異導致表型的不同。本研究發現,6例雙著絲粒染色體中有4例涉及性染色體,有2例是等臂雙著絲粒Y染色體和45,X細胞系的嵌合體,臨床表現為矮小癥、不育和發育遲緩。
綜上所述,C顯帶和N顯帶技術較常用于隨體區變異、異染色質長度變化及有無等染色體多態性的鑒別。本研究發現,C顯帶和N顯帶在mar的來源及致病性的初步判斷上具有一定意義,如N顯帶見兩端有隨體,C顯帶見深染的異染色質,極有可能來源于D、G組染色體短臂的斷裂重接,通常無臨床表型;如N顯帶未見隨體,C顯帶未見異染色質,致病的可能性大,需進一步行CMA、CNV-seq等分子診斷技術鑒別其來源和致病性。C顯帶在鑒別雙著絲粒染色體的真假性上也有一定價值,假性、無活性的著絲粒其C顯帶較松散,呈細線狀。此外,對于涉及隨體、異染色質的復雜染色體核型鑒定,亦可通過C顯帶和N顯帶技術進行輔助診斷。因此,對于一些傳統的細胞遺傳學技術,在臨床工作中應積極總結經驗,挖掘其多方面的臨床應用價值。

