miR-18a在骨肉瘤中的表達及作用機制
劉曉峰
骨肉瘤是好發于四肢長骨干骺端的原發惡性骨腫瘤,常見于兒童及青少年。骨肉瘤起源于骨間質細胞,導致肌肉萎縮、骨折,導致運動功能障礙。該病易于早期轉移,多轉移至肺。雖然骨肉瘤年發病率低(3/100萬),但惡性程度高、轉移率高、致殘率高、預后差致使其成為臨床治療中的難點[1-3]。迄今對骨肉瘤發生機制遠未闡明,故闡明骨肉瘤的發病機制及制定相應的治療方法是目前亟待解決的問題。微小RNA(microRNA,miR)是一類長約22nt的非編碼RNA,主要在轉錄后水平調控靶基因的表達來參與腫瘤的發生、發展[4,5]。miR并不直接編碼蛋白質,但可在轉錄水平調控其靶基因的轉錄,使靶基因不能翻譯編碼蛋白質。既往研究表明,miR-18a在神經膠質瘤、喉癌、肝癌等多種腫瘤中高表達,并且參與腫瘤細胞的增殖與遷移[6-9]。但目前關于miR-18a與骨肉瘤研究較少。本研究應用qPCR檢測miR-18a在骨肉瘤組織中的表達,通過miR-18a抑制物(anti-miR-18a)抑制骨肉瘤MG63細胞株中miR-18a的表達,檢測抑制前后細胞活性及遷移、侵襲能力的變化,探討miR-18a在骨肉瘤細胞增殖、遷移與侵襲過程中的作用及相關機制。研究結果顯示,骨肉瘤組織中miR-18a表達高于癌旁正常組織,且與腫瘤分級有關[10]。抑制人骨肉瘤MG63細胞中miR-18a表達后細胞活性降低,遷移和侵襲能力減弱,研究還發現MG63細胞中增殖與侵襲相關基因PCNA、CyclinD1、MMP-7、MMP-9表達明顯降低[11]。這些結果提示miR-18a與骨肉瘤關系密切,miR-18a檢測可用來評價患者病情,還有可能作為治療靶基因。本研究為骨肉瘤的診治提供了新的思路。
1 資料與方法
1.1 一般資料 選取遼陽市中心醫院骨科2013年1月至2017年12月行穿刺和活檢的骨肉瘤及相應的肉瘤旁正常組織標本。患者術前均未行放療及化療,未同時合并其他腫瘤,共58例,其中男43例,女15例;年齡6~49歲,中位年齡22歲。操作前取得所有患者知情同意,并簽署相關告知書。本研究經遼陽市中心醫院倫理委員會討論后批準。
1.2 試劑 人骨肉瘤 MG-63 細胞株購置于中國科學院上海生命科學研究院細胞資源中心。anti-miR-18a購自美國AB公司。LipofectamineTM2000轉染試劑、TRIzol試劑購自美國Invitrogen公司。miR-18a熒光定量PCR檢測試劑盒購自美國Gene Copia公司。反轉錄試劑盒和熒光定量RT-PCR試劑購自美國Promega公司。PCNA、CyclinD1、MMP-7、MMP-9抗體購自Santa Cruz公司,β-actin抗體購自Abcam公司。CCK-8細胞增殖-毒性檢測試劑盒購自日本同仁化學研究所。
1.3 方法
1.3.1 細胞培養:人骨肉瘤 MG-63細胞培養于含10%胎牛血清的DMEM培養基,培養于37℃、5% CO2的培養箱中。每2~3天更換培養基1次,傳代時以0.25%的胰蛋白酶消化,取生長良好的細胞用于實驗。
1.3.2 qRT-PCR檢測組織中miR-18a及轉染后各目的基因的表達:用 Trizol提取組織及轉染后各組細胞總RNA。用逆轉錄試劑盒將 RNA 進行逆轉錄,獲取cDNA,與Go Taq? qPCR Master Mix及相應的引物混合后進行熒光定量PCR。U6作為micro RNA的內參,β-actin作為mRNA的內參,分別用ΔCT法、ΔΔCt法分析。miR-18a引物采用Gene Copoia公司的 All-in-One miRNA qRT-PCR Detection Kit 微小RNA檢測試劑盒。其他基因的引物序列:PCNA:上游5’-AAGCCGAAACCAGCTAGACTTTC-3’,下游5’-TGGCGGAGTGGCAACAA-3’;Cyclin D1:上游5’- CTCGGTGTCCTACTTCAAATGT-3’,下游5’-TCCTCGCACTTCTGTTCCT-3’;MMP-7:上游5’-TCTCCTCCGAGACCTGTCC-3’,下游5’-GCTGACATCATGATTGGCTTT-3’;MMP-9:上游5’-GGCACATAGTAGGCCCTTTAA-3’,下游5’-TCACTCCTTTCTTCCTAGCCA-3’;U6:上游5’-ATTGGAACGATACAGAGAAGATT -3’,下游5’-GGAACGCTTCACGAATTTG-3’;β-actin:上游5’-CATCCTCACCCTGAAGTACCCC-3’,下游5’-AGCCTGGATGCAACGTACATG-3’。
1.3.3 anti-miR-18a轉染:實驗分為轉染組、陰性對照組及空白對照組。將MG63細胞以5×105個/ml的密度接種于6孔板中,培養24 h。然后用DMEM清洗細胞;并用DMEM稀釋anti-miR-18a、陰性對照序列及轉染試劑LipofectamineTM2000;混合靜置后轉染MG-63細胞。將陰性對照序列進行熒光標記,熒光顯微鏡下觀察轉染效率。
1.3.4 CCK-8檢測細胞活性:取轉染后的各組細胞,每組設6個重復孔,加入96孔板后分別培養24、48、72 h;培養結束后,吸去培基,加入含CCK-8的培養液100 μl(CCK-8∶培基=1∶9),繼續培養2 h,取出96孔板,用酶標儀于450 nm處測OD值。
1.3.5 細胞劃痕實驗(Wound assay)檢測anti-miR-18a轉染后骨肉瘤細胞遷移能力:用 marker 筆在6孔板背后每隔0.5 cm均勻的劃橫線。將轉染后各組細胞以5×105cells/孔的密度接種于孔板中過夜培養,用10 μl槍頭垂直于橫線在各個孔底部均勻劃痕,然后用PBS輕輕吹打3次,吸除游離的細胞,加入不含10%胎牛血清及雙抗的培基。在37℃、5% CO2的條件下培養,分別在 0、12、24及 48 h拍照記錄。劃痕愈合率(%)=(1-各時間點各組劃痕平均寬度/0 h劃痕寬度)×100%。
1.3.6 Transwell小室實驗檢測anti-miR-18a轉染后骨肉瘤細胞侵襲能力:將Transwell小室置于無菌24孔板中,向小室中加入 20 μl Matrigel 膠(1 mg/ml),快速晃動 24 孔板,使其均勻鋪滿小室底面,然后將各組細胞懸浮于無牛清的MEM培養基中,上室中加入200 μl 共計 5×104個細胞的上述懸液,下室中加入600 μl含10%胎牛血清的MEM培養基,繼續培養20 h。取出小室,用棉簽拭去基質膠和上室內的細胞,4%多聚甲醛(Paraformaldehyde)固定,采用結晶紫(crystal violet)染色并清洗后在顯微鏡下觀察穿過小室基底膜的細胞數。
1.3.7 Western Blot檢測目的蛋白的表達:提取各組細胞總蛋白,應用BCA法測定蛋白總濃度。取各組蛋白樣品40 μg,經SDS-PAGE電泳分離,轉膜后封閉2 h,加入一抗,4℃ 過夜,TBST洗膜后,加入二抗,室溫避光孵育1 h,TBST洗膜后經Odyssey紅外激光成像系統分析。
2 結果
2.1 組織中miR-18a表達量比較 miR-18a在骨肉瘤組織、癌旁組織中的相對表達量分別為0.328±0.059、0.127±0.042。miR-18a在骨肉瘤組織中的表達顯著高于癌旁組織(t=-6.16,P= 0.000)。見表1。
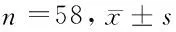
表1 miR-18a在骨肉瘤組織、癌旁組織中的表達
2.2 miR-18a表達與腫瘤分級的關系 miR-18a表達與腫瘤分級的情況有關,分級高的腫瘤組織miR-18a水平明顯高于分級低者(t=-3.06,P=0.022)。見表2。
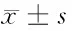
表2 miR-18a在骨肉瘤組織中的表達與腫瘤分級之間的關系
2.3 anti-miR-18a對MG-63細胞miR-18a表達的影響 anti-miR-18a轉染MG-63細胞后,miR-18a mRNA和蛋白的表達顯著降低(F=208.09,P=0.000;F=50.60,P=0.000)。見表3。
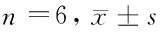
表3 3組細胞miR-18a的表達比較
2.4 anti-miR-18a對MG-63細胞活性的影響 48 h及72 h轉染組的細胞活性明顯低于對照組及空白組(F=82.04,P=0.000;F=31.61,P=0.000),24 h各組細胞活性差異無統計學意義(P>0.05)。見表4。
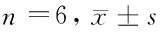
表4 轉染后3組細胞活性比較
2.5 anti-miR-18a對MG-63細胞遷移和侵襲能力的影響 轉染組的細胞遷移和侵襲能力明顯低于對照組及空白組(F=758.15,P=0.000;F=138.81,P=0.000)。見表5、6。
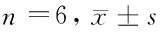
表5 3組細胞遷移能力比較
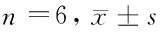
表6 3組細胞侵襲能力比較
2.6 anti-miR-18a對MG-63細胞PCNA、CyclinD1、MMP-7、MMP-9表達的影響 轉染后增殖、遷移及侵襲相關基因PCNA、CyclinD1、MMP-7、MMP-9的mRNA和蛋白表達明顯降低(P<0.05)。見表7。
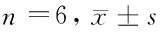
表7 3組PCNA、CyclinD1、MMP-7、MMP-9 mRNA和蛋白水平比較
3 討論
骨肉瘤是骨惡性腫瘤中最多見的一種,是從間質細胞系發展而來,腫瘤迅速生長是由于腫瘤經軟骨階段直接或間接形成腫瘤骨樣組織和骨組織。其好發部位為長骨干骺端,股骨遠端和脛骨近端最多見。骨肉瘤惡性程度高,易早期發生肺轉移,預后較差。骨肉瘤的治療模式經過多年的演變,由最初的“單純手術治療”逐漸發展為當今的“新輔助化療-手術-輔助化療”,大大提高了骨肉瘤的5年生存率,但約有 10%~20%的患者在初診時即存在遠處轉移,其預后明顯低于非轉移性骨肉瘤患者[2,3]。雖然目前明確骨肉瘤細胞是由骨間質細胞惡變而發生,其中多種分子的改變發揮了重要作用,但具體機制尚不明確。所以,闡明骨肉瘤的發病機制及尋找治療有效的靶點是目前亟待解決的問題。既往研究表明,microRNA通過調控靶基因的表達參與骨肉瘤細胞的增殖、遷移及侵襲[12-16]。miR-18a作為microRNA的一員,研究顯示,miR-18a在神經膠質瘤、喉癌、肝癌等多種腫瘤中高表達,并且參與腫瘤細胞的增殖與遷移[6-9]。但筆者發現目前關于miR-18a在骨肉瘤中發揮的作用報道罕見。本研究中,我們發現miR-18a在骨肉瘤組織及細胞系中高表達,說明miR-18a可能是導致骨肉瘤發生的重要分子。實驗研究表明,抑制miR-18a的表達后,骨肉瘤細胞增殖、遷移和侵襲能力明顯降低。證明miR-18a可能通過促進骨肉瘤細胞的增殖、遷移和侵襲從而在骨肉瘤的進展中發揮作用。
腫瘤無限制的分裂及通過各種途徑擴散到其他部位是其重要的生物學特性,在細胞水平即表現為腫瘤細胞增殖、遷移和侵襲能力的增強。CyclinD1是G1期的正調控因子,在細胞周期調控中起重要作用[17]。PCNA是DNA聚合酶δ的載體,主要在細胞周期的S期表達,能客觀的反應細胞增殖的能力[18]。基質金屬蛋白酶(MMPs)能破壞細胞外基質與基底膜的完整性,促進腫瘤細胞的侵襲及遷移,MMP-7、MMP-9是MMPs的重要組成成員[19]。在本次實驗中,我們發現,抑制MG63細胞中miR-18a表達后CyclinD1、PCNA表達減弱,同時MMP-7、MMP-9表達減弱,這與CCK-8、劃痕及Transwell小室實驗結果相符,說明MG63細胞的增殖、遷移與侵襲能力下降。
綜上所述,骨肉瘤組織中miR-18a存在表達增高且與腫瘤分級有關,miR-18a可能通過促進腫瘤細胞的增殖及遷移、侵襲而在骨肉瘤的進展中發揮作用。但本研究樣本量有限,機制研究也有待深入。關于miR-18a在骨肉瘤的作用機制的研究對骨肉瘤的診治有重要臨床價值,應進行深入的系列研究。

