BPA聯合NaF對雄性大鼠生殖功能的損害效果
單炳丹 何干斌 李瑩希 李月 覃金菲 呂倩瑜 許瑞婕 莫有樺 朱樂玫
雙酚A(bisphenol-A,BPA)以其獨特性質而被廣泛應用于食品包裝、牙齒填充物等日用品制作過程,居民日常生活中極易通過飲食攝入和皮膚接觸BPA[1]。BPA是能模擬雌激素而干擾環境內分泌的化學物,即使是極低劑量也能對生物體的生殖、神經、免疫等功能產生深遠影響[2]。大量研究均證實,BPA可引起雄性動物性腺發育不良,降低精液質量及精子數目[3-5]。還有有報道指出,氟化鈉(NaF)能激活ERK、JNK信號通路,抑制卵巢組織細胞活性,導致線粒體功能障礙,從而誘導卵巢顆粒細胞凋亡[6]。同時,氟能引起雄性動物細胞曲細精管生殖細胞凋亡,造成少精或無精癥的發生。機體可以通過各種途徑攝入氟,機體內攝入安全范圍內的氟有利于機體預防齲齒、維持鈣磷代謝和保持神經沖動傳導,但是長期攝入>4 mg/d劑量則會造成氟中毒[7]。因此,長期暴露BPA和NaF的人群,其生殖毒性可能會明顯增強,為探究NaF和BPA聯合作用對大鼠生殖系統的具體影響,為NaF、BPA安全使用及毒理學安全評價提供參考依據,特進行了如下研究。
1 材料與方法
1.1 實驗動物 2018年7月至2019年7月,對165只性成熟的雄性SD大鼠進行了基礎對照試驗研究,大鼠均由長沙市天勤生物技術公司提供(編號SCXK湘-43006700016376),體重250~300 g,平均(275.41±13.26)g。研究項目獲長沙醫學院醫學倫理委員會批準(編號CY倫2018050801)。
1.2 儀器及藥劑 主要儀器包括無菌高速均質機(寧波新藝超聲設備有限公司,中國);DXI800化學發光性激素檢測儀(貝克曼庫爾特公司,美國);全自動生化分析儀(奧林巴斯2700);高速離心機(長沙湘銳離心機有限公司,中國);Alpha-1900Splus紫外分光光度計(上海譜元儀器有限公司,中國);Q-Sense E4石英晶體微天平(北京中儀科信科技有限公司,中國)等。主要藥劑包括BPA(純度>95%,米度生物技術有限公司,中國);NaF(純度>95%,長沙中仁生物科技有限公司,中國);睪酮(T)測定試劑盒、雌二醇(E2)測定試劑盒均由羅氏診斷產品(上海)有限公司提供;丙二醛(MDA)和氧化物歧化酶(SOD)測定試劑盒均由南京建成生物工程研究所提供。
1.3 分組及處理 大鼠適應性喂養后按照隨機數字表法均分為5組(空白對照組、BPA組、NaF組、低劑量BPA+NaF組、高劑量BPA+NaF組),每組33只。各組大鼠獨立飼養,避免交叉影響。持續染毒28 d。見表1。

表1 5組大鼠經口染毒方式及劑量 n=33
1.4 數據采集 納入研究的165只大鼠研究期間均無死亡,每日觀察大鼠活動情況(精神、飲食、外形等),于研究第0、7、14、28天分4次進行如下指標檢測。每間隔7 d即處死1批次(每組11只)大鼠,處理前對大鼠禁食12 h,隔夜麻醉后股動脈取血6 ml分一式2份,供檢測和備檢使用。同時對大鼠進行迅速解剖,取相關臟器制作組織切片進行觀察。
1.4.1 性激素:動脈血液標本放置25 min后高速離心(2 000 r/min)10 min,取上清液采用配套試劑盒定量檢測大鼠血清T、E2含量。
1.4.2 睪丸氧化指標:處死后大鼠取單側睪丸,快速去除被膜,取組織塊(0.1~0.2 g)在冰浴條件下制作勻漿(10%)備用。采用配套試劑盒定量檢測SOD活性、MDA含量。
1.4.3 睪丸和附睪臟器系數:將睪丸和附睪去除周圍脂肪組織和結締組織,準確稱量雙側睪丸和附睪的重量,計算各組實驗大鼠睪丸和附睪臟器系數,計算公式為:臟器系數(%)=臟器體重(g)/小鼠體重(g)×100%)[8]。
1.4.4 精子質量:取單側附睪制作精子推片,具體方法如下:將單側附睪剪碎、孵育(37℃)、過濾得到懸液。取精子懸液(100 μl)與精子固定液(900 μl)混勻,精子固定液按NaHCO3(3.5 g)、甲醛(1 ml)、蒸餾水(100 ml)配制。混勻夜滴于血球計數板,靜置5 min后在顯微鏡下進行精子頭計數(每次取中央5個中方格)數板內的精子數記為R,以精子頭為計數范圍,推算單側附睪精子懸液中精子的數量(R×50 000×10/附睪質量),同時計算精子畸形率(畸形精子數/1 000)[9]。
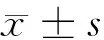
2 結果
2.1 5組大鼠處理前后生化指標變化情況 染毒后不同染毒方法大鼠血清E2濃度差異有統計學意義(F=9.220,P<0.05);不同染毒方法大鼠血清T濃度差異有統計學意義(F=39.589,P<0.05)。同時,聯合染毒組會使實驗大鼠血清E2濃度升高,與空白組、單獨染毒組比較差異有統計學意義(P<0.05),并且隨著聯合染毒組劑量的升高,聯合染毒對大鼠血清E2的提升作用越強(P<0.05);BPA和NaF單獨染毒均會降低實驗大鼠血清T濃度(P<0.05),二者聯合染毒對大鼠血清T的提升的作用較二者單獨染毒強(P<0.05),并且隨著染毒劑量的增加二者聯合染毒對大鼠血清T濃度的降低作用越強(P<0.05)。不同染毒方法均會對大鼠睪丸組織造成氧化損傷導致MDA升高及SOD下降(P<0.05)。BPA染毒對大鼠睪丸組織的氧化損傷作用比NaF強(P<0.05);二者聯合染毒對大鼠睪丸組織氧化損傷作用比二者單獨染毒作用大(P<0.05);隨著二者聯合染毒劑量的加大,其氧化損傷作用增強(P<0.05)。見表2~4。

表2 5組大鼠處理前后E2和T變化情況

表3 5組大鼠處理前后睪丸MDA水平比較

表4 5組大鼠處理前后睪丸SOD水平比較
2.2 5組大鼠處理前后臟器系數和精子質量變化情況 不同染毒方法均會對大鼠睪丸及附睪的臟器系數造成影響,不同組雄性大鼠睪丸及附睪臟器系數的比較差異有統計學意義(P<0.05)。BPA與NaF單獨染毒均能降低大鼠睪丸及附睪臟器系數(P<0.05);BPA與NaF聯合染毒較二者單獨染毒對大鼠睪丸及附臟器系數的影響大(P<0.05);隨著BPA與NaF聯合染毒劑量的加大,二者對大鼠睪丸及臟器系數的影響加大(P<0.05)。不同染毒處理后,不同組雄性大鼠精子數對比差異有統計學意義(P<0.05)、精子畸形率比較差異有統計學意義(P<0.05)。進一步統計分析顯示,BPA和NaF單獨染毒均能降低雄性大鼠的精子數量(P<0.05),提高雄性大鼠精子畸形率(P<0.05);BPA與NaF聯合染毒對降低大鼠精子數量以及提高精子畸形率的作用較二者單獨染毒時的作用強(P<0.05);BPA與NaF聯合染毒對精子數量及畸形率的影響會隨著染毒劑量的增加而加大(P<0.05)。見表5~7。

表5 5組大鼠處理前后臟器系數和精子質量變化情況
表6 5組處理前后精子數量比較

表6 5組處理前后精子數量比較
組別第0天第7天第14天第28天空白對照組50.53±2.7350.68±2.8951.0502.18±51.10±2.77BPA組51.08±2.3646.17±1.80*35.24±2.04*26.63±1.94*NaF組51.25±2.4143.25±1.07*#32.08±2.16*#26.98±3.23*低劑量BPA+NaF組51.08±2.1632.08±2.42*#△25.32±1.64*#△15.73±1.47*#△高劑量BPA+NaF組51.29±2.0728.01±1.63*#△☆15.09±1.11*#△☆9.54±0.32*#△☆
注:與空白組比較,*P<0.05;與BPA組比較,#P<0.05;與NaF組比較,△P<0.05;與低劑量BPA+NaF組比較,☆P<0.05

表7 5組大鼠處理前后精子畸形率比較
2.3 5組大鼠睪丸組織切片和精子形態學觀察 空白對照組大鼠睪丸的組織結構清晰,曲細精管內的各級支持細胞和生精細胞排列整齊,可見正常精子,精子頭部大小形態正常,尾部舒展自然。經過染毒后,大鼠的睪丸發生了病理變化,在高劑量BPA+NaF組中,睪丸的曲細精管發生不同程度的變性,部分曲細精管含有精子,而部分不含精子,同時可見胖頭精子。在低劑量BPA+NaF組中,曲細精管的管腔壁結構紊亂,但管腔內結構清晰,同時可見香蕉頭精子。在BPA組中,可以觀察到管腔壁水腫分離的現象,且管腔內存在脫落的細胞,同時可見無鉤精子。在NaF組中,亦可以觀察到管腔壁水腫分離的現象,且管腔內存在脫落的細胞,同時可見嚴重畸形的三尾精子。見圖1~5。


3 討論
BPA是一種環境內分泌干擾物,能夠模擬雌激素的作用,能與雌激素受體結合,干擾體內天然激素的正常活動。氟能引起雄性動物細胞曲細精管生殖細胞凋亡,導致少精或無精癥的發生[10]。BPA和NaF在我們的生活環境中都是廣泛存在并比較常見的有機化合物,生產環境中接觸比較多,兩種物質可以在機體內長時間存留半減期,單獨作用時的生殖毒性較為確切,但是聯合作用半減期的影響將是今后研究方向[11]。
本研究發現,NaF和BPA聯合染毒后血清E2明顯升高,血清T濃度明顯降低,NaF和BPA單獨染毒組都沒有出現該情況,推測二者長期聯合作用會抑制大鼠血清中T分泌并誘導E2分泌,可能具有協同作用。生殖相關激素正常分泌是保證精子發育成熟的重要條件,T是生精過程中的主要調節激素,在維持精子發生和正常性功能上的作用較為顯著。Li等[12]研究指出,E2則主要通過下丘腦-垂體-睪丸性腺軸的調節與T發生拮抗作用,E2/T的相對平衡對維持雄性大鼠生殖功能具有重要作用。研究還發現,NaF和BPA聯合染毒后對大鼠睪丸的MDA升高、SOD降低程度大于二者單獨染毒,提示NaF和BPA聯合染毒會加劇睪丸組織的氧化損傷。MDA是反應機體內脂質過氧化程度的重要指標,能間接表明機體細胞受自由基攻擊的嚴重程度,進而反映細胞損傷程度[13,14]。同樣,SOD作為機體內抗氧化劑,其活性降低,通常表明其體內清除自由基的能力下降,進而導致細胞受損。
本次研究發現,NaF和BPA聯合染毒組損傷程度較其他組更為嚴重,推測二者聯合染毒可加大睪丸組織病理損傷。在睪丸組織中,睪丸支持細胞(Sertoli細胞)附著在精細小管的基膜上,向管腔方向伸展,頂端深入管腔,Sertoli細胞伸出一些細長的突起包圍著各級生精細胞,與各級生精細胞的生長有關。Douglas等[15]研究表明,BPA可引起未成熟大鼠的率丸Sertoli細胞的退化(出現幾個大空泡,細胞質中有電密集物、不同大小的小空泡核濃縮)和數量減少。其退化程度與BPA的濃度有關系。染毒處理后的大鼠,精細小管管腔內生殖細胞排列層次發生不同程度的紊亂,而生殖細胞周圍的Sertoli細胞數目稀少,說明BPA對小鼠率丸Sertoli細胞造成了損害,并降低了生精能力。有研究顯示,NaF對睪丸間質細胞(Leyding細胞)具有直接毒作用,導致生精細胞周圍不能形成高濃度的睪酮,影響精子的發生[16]。
同時,NaF和BPA聯合染毒組精子數降低和畸形率升高成都明顯大于其他各組。分析原因,BPA可透過血睪屏障而干擾精子的生產發育過程,導致精子數量減少,活動精子百分率降低,精子畸形數升高。NaF對小鼠生殖細胞具有遺傳毒作用,使睪丸初級精母細胞染色體的畸變增加。同時,遺傳物質的分子結構受氟作用可能發生物理性狀發生,后續研究需結合基礎實驗進一步探究。
綜上所述,BPA和NaF的聯合作用可能會促進雄性大鼠雌二醇的分泌并抑制睪酮的分泌、降低雄性大鼠精子質量,二者聯合作用比二者單獨作用強,并且隨劑量增加而加大。因此,在評估環境污染物對機體生殖功能的影響時,不能簡單根據單一毒物的實驗或調查結果,應考慮污染物的聯合作用對機體的影響。但是,由于人與動物之間存在種屬差異,試驗結果不能直接外推到人類,但NaF和BPA作為現在環境中廣泛存在的物質,雖然環境中檢出的劑量遠低于本實驗染毒劑量,但長期接觸可能會導致污染物在體內蓄積,應重視其對接觸人群的生殖健康的長期影響。

