大豆GmGolS2-1基因高溫脅迫誘導(dǎo)表達(dá)及轉(zhuǎn)基因煙草鑒定
邱爽 張軍 何佳琦 李銘楊 周雨明 鄔長(zhǎng)樂 袁洪淼 劉嘉儀 翟瑩

摘要: 肌醇半乳糖苷合成酶(GolS)是棉籽糖系列寡糖(RFO)生物合成途徑中的關(guān)鍵酶,在植物應(yīng)對(duì)非生物脅迫過程中發(fā)揮重要作用。實(shí)時(shí)熒光定量RT-PCR結(jié)果顯示,高溫脅迫可以誘導(dǎo)GmGolS2-1在大豆幼苗中的表達(dá)。將GmGolS2-1基因構(gòu)建到植物表達(dá)載體pRI101上并通過葉盤法轉(zhuǎn)化煙草,經(jīng)卡那霉素抗性篩選,PCR及qRT-PCR檢測(cè)共獲得6株陽性轉(zhuǎn)基因煙草植株(OE1~OE6)。對(duì)野生型煙草植株和GmGolS2-1轉(zhuǎn)基因煙草植株進(jìn)行高溫脅迫處理,結(jié)果顯示野生型煙草的電解質(zhì)滲透率和丙二醛含量均高于轉(zhuǎn)基因煙草。由此推測(cè)GmGolS2-1可以提高轉(zhuǎn)基因煙草的耐熱性。
關(guān)鍵詞: 大豆;肌醇半乳糖苷;GolS基因;高溫脅迫;轉(zhuǎn)基因煙草
中圖分類號(hào): S565.1 文獻(xiàn)標(biāo)識(shí)碼: A 文章編號(hào): 1000-4440(2021)01-0038-06
Expression of soybean GmGolS2-1 induced by heat stress and identification of GmGolS2-1 transgenic tobacco
QIU Shuang1, ZHANG Jun2, HE Jia-qi1, LI Ming-yang1, ZHOU Yu-ming3, WU Chang-le1, YUAN Hong-miao1, LIU Jia-yi1, ZHAI Ying1
(1.College of Life Science and Agro-Forestry, Qiqihar University, Qiqihar 161006, China;2.Branch of Animal Husbandry and Veterinary of Heilongjiang Academy of Agricultural Sciences, Qiqihar 161005, China;3.Jilin Zhongzhi Jiufang Consulting Co., Ltd., Changchun 130000, China)
Abstract: Galactinol synthase (GolS) is the key enzyme in the biosynthetic pathway of raffinose family oligosaccharides (RFOs), which plays an important role in the response to abiotic stresses of plants. The results of real-time fluorescence quantitative RT-PCR showed that the expression of GmGolS2-1 could be induced by high temperature stress in soybean seedlings. The GmGolS2-1 gene was constructed into expression vector pRI101 in plants and was transformed into tobacco using leaf disc method. Six positive transgenic tobacco plants (OE1-OE6) were obtained by kanamycin resistance screening, PCR and qRT-PCR. The wild-type and GmGolS2-1 transgenic tobacco plants were treated with heat stress. The results showed that the electrolyte leakage and malondialdehyde content of wild-type tobacco were both higher than that of transgenic tobacco. These data indicate that GmGolS2-1 can increase the tolerance to heat stress of transgenic tobacco.
Key words: soybean;galactinol;GolS gene;heat stress;transgenic tobacco
植物在遭受不良環(huán)境條件后,可以誘導(dǎo)合成大量滲透調(diào)節(jié)物質(zhì)來增加植物細(xì)胞的滲透壓,提高植物抵抗脅迫的能力,從而維持植物自身的代謝和生長(zhǎng)發(fā)育。其中棉子糖系列寡糖(Raffinose family oligosaccharides, RFO)就是這些滲透調(diào)節(jié)物質(zhì)的典型代表。它們是高等植物中含量?jī)H次于蔗糖的一類可溶性糖,在逆境脅迫條件下可以維持細(xì)胞膨壓,保持細(xì)胞穩(wěn)定性,降低植物氧化性損傷,維持光合作用正常進(jìn)行[1-3]。肌醇半乳糖苷合成酶(Galactinol synthase, GolS)是RFO生物合成途徑中的關(guān)鍵酶,它所催化的UDP-半乳糖和肌醇合成肌醇半乳糖苷的反應(yīng)既是RFO代謝通路中的第一步,也是限速步驟[4]。
GolS基因在植物中以多基因家族形式存在,不同GolS基因在抵御非生物脅迫過程中的作用也各不相同。擬南芥中含有7個(gè)GolS基因,其中AtGolS1和AtGolS2可以被干旱和高鹽脅迫誘導(dǎo)上調(diào)表達(dá),AtGolS3可以被低溫脅迫誘導(dǎo)上調(diào)表達(dá)[5]。AtGolS1和AtGolS2過表達(dá)轉(zhuǎn)基因植株中肌醇半乳糖苷和棉籽糖含量均增加,對(duì)氧化脅迫的耐受能力增強(qiáng)[6]。越來越多的研究結(jié)果顯示,GolS基因在應(yīng)對(duì)高溫脅迫過程中同樣發(fā)揮重要作用。AtGolS1是熱激因子HSF3的調(diào)控靶基因,在高溫脅迫下可以促進(jìn)棉籽糖的合成[7]。葡萄VvGOLS1基因能夠被高溫處理上調(diào)表達(dá)[8]。高溫和氧化脅迫可以誘導(dǎo)鷹嘴豆CaGolS1的表達(dá),將其在擬南芥中過表達(dá)可以降低活性氧的積累從而提高轉(zhuǎn)基因植株的耐熱性[9]。
大豆作為一種重要的經(jīng)濟(jì)作物,其GolS基因的功能鑒定對(duì)于大豆RFO代謝途徑及大豆抗逆機(jī)制的研究都具有重要意義。但到目前為止,有關(guān)大豆中GolS基因與高溫脅迫反應(yīng)之間的關(guān)系的研究尚未見報(bào)道。本研究對(duì)大豆GmGolS2-1基因在高溫脅迫下的表達(dá)量進(jìn)行檢測(cè),并將其轉(zhuǎn)化煙草進(jìn)行耐熱性鑒定。
1 材料與方法
1.1 植物材料及高溫脅迫處理
試驗(yàn)材料為齊齊哈爾地區(qū)廣泛種植的大豆抗逆品種北豆9號(hào)。在Hoagland營(yíng)養(yǎng)液中水培大豆幼苗,待大豆幼苗第一片三出復(fù)葉完全展開時(shí)進(jìn)行高溫脅迫處理:將大豆幼苗置于42 ℃培養(yǎng)箱中,分別在脅迫處理的0 h、1 h、2 h、5 h和10 h,剪取0.1 g第一片三出復(fù)葉并迅速置于液氮中,于-80 ℃超低溫冰箱中保存,用于后續(xù)總RNA的提取。
1.2 實(shí)時(shí)熒光定量RT-PCR
使用RNAiso Plus試劑(TaKaRa公司產(chǎn)品)提取各樣本的總RNA,通過瓊脂糖凝膠電泳和OD260/OD280值檢測(cè)提取RNA的質(zhì)量。使用cDNA反轉(zhuǎn)錄試劑盒(Novoprotein公司產(chǎn)品)合成第一鏈cDNA。利用Primer 5軟件設(shè)計(jì)GmGolS2-1(GenBank登錄號(hào):NM001354866)實(shí)時(shí)熒光定量RT-PCR引物。上游引物序列:5′-GCGGTGATGGATTGTTTCTG-3′;下游引物序列:5′-GTGGGCTTGGTGAGTTGGA-3′。使用大豆組成型表達(dá)基因β-Tubuin(GenBank登錄號(hào):GMU12286)作為內(nèi)參基因,上游引物序列:5′-GGAAGGCT TTCTTGCATTGGTA-3′;下游引物序列:5′-AGTGGCATCCTGGTACTGC-3′)[10]。在BIO-RAD CFX96 Real-Time PCR儀設(shè)置反應(yīng)程序如下:95 ℃預(yù)變性30 s;95 ℃ 5 s,58 ℃ 30 s,共循環(huán)40次。實(shí)時(shí)熒光定量RT-PCR反應(yīng)體系如下:2×TB Green Premix Ex TaqⅡ(TaKaRa公司產(chǎn)品) 10.0 μl、cDNA 2.0 μl、上下游引物各0.8 μl,補(bǔ)充水至總體積20.0 μl。所有處理3次重復(fù),采用2-△△Ct法計(jì)算基因的相對(duì)表達(dá)量。
1.3 植物表達(dá)載體的構(gòu)建
使用限制性內(nèi)切酶Nde I和EcoR I雙酶切pMD18-T-GmGolS2-1重組質(zhì)粒(本實(shí)驗(yàn)室前期構(gòu)建)和植物表達(dá)載體pRI101,分別切膠回收酶切片段后利用Ligation kit 2.0(TaKaRa公司產(chǎn)品)進(jìn)行連接。連接產(chǎn)物轉(zhuǎn)化大腸桿菌DH5α,提取質(zhì)粒進(jìn)行雙酶切驗(yàn)證。將驗(yàn)證后的重組載體質(zhì)粒pRI101-GmGolS2-1轉(zhuǎn)化農(nóng)桿菌EHA105。
1.4 煙草遺傳轉(zhuǎn)化及篩選
通過農(nóng)桿菌侵染葉盤法將重組載體pRI101-GmGolS2-1轉(zhuǎn)化煙草NC89[11]。在含有50 mg/L卡那霉素的MS培養(yǎng)基上篩選煙草抗性苗。待煙草抗性苗生根后提取DNA作為模板,以pRI101-GmGolS2-1重組質(zhì)粒作為陽性對(duì)照,野生型煙草葉片DNA作為陰性對(duì)照,對(duì)轉(zhuǎn)基因抗性苗進(jìn)行PCR檢測(cè)。提取轉(zhuǎn)基因及野生型煙草葉片RNA并進(jìn)行反轉(zhuǎn)錄。使用煙草組成型表達(dá)基因α-Tubuin(GenBank登錄號(hào):AB052822)作為內(nèi)參基因(上游引物序列:5′-ATGAGAGAGTGCATATCGAT-3′;下游引物序列: 5′-TTCACTGAAGAAGGTGTTGAA-3′)[10],目的基因引物同方法1.2 實(shí)時(shí)熒光定量RT-PCR中引物,對(duì)轉(zhuǎn)基因煙草中的GmGolS2-1基因的表達(dá)量進(jìn)行檢測(cè),實(shí)時(shí)熒光定量RT-PCR方法同1.2,每個(gè)株系3次重復(fù)。
1.5 轉(zhuǎn)基因煙草耐熱性檢測(cè)
將營(yíng)養(yǎng)缽中土培56 d的T1代轉(zhuǎn)基因煙草植株置于42 ℃培養(yǎng)箱中進(jìn)行高溫處理。在處理48 h時(shí)進(jìn)行相對(duì)電解質(zhì)滲透率和丙二醛含量的檢測(cè)。電解質(zhì)滲透率測(cè)定:取0.1 g煙草葉片剪碎,加入5 ml去離子水浸泡1 h,測(cè)定電導(dǎo)率D1,之后置于沸水中10 min,冷卻后測(cè)定電導(dǎo)率D2。相對(duì)電解質(zhì)滲透率計(jì)算公式:D1/D2×100%。 丙二醛含量的測(cè)定參照Shao等[12]的方法進(jìn)行。每個(gè)處理3次重復(fù)。
1.6 數(shù)據(jù)處理
數(shù)據(jù)的差異顯著性分析采用Students t檢驗(yàn)。
2 結(jié)果與分析
2.1 高溫脅迫下GmGolS2-1的表達(dá)分析
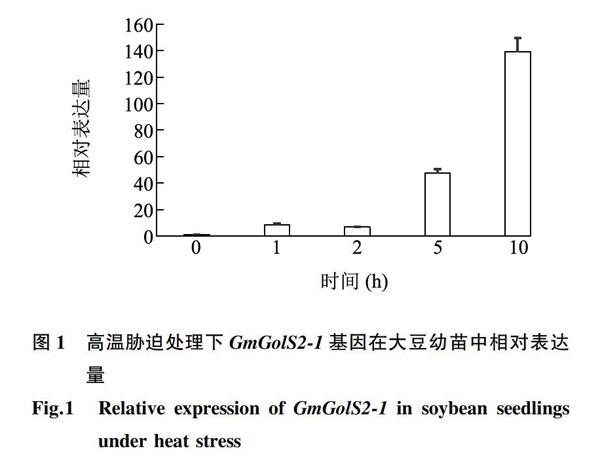
為了檢測(cè)GmGolS2-1在大豆中是否能夠響應(yīng)高溫脅迫,利用實(shí)時(shí)熒光定量RT-PCR對(duì)其高溫脅迫下的表達(dá)動(dòng)態(tài)進(jìn)行分析。結(jié)果(圖1)顯示,GmGolS2-1的表達(dá)量隨著高溫處理時(shí)間延長(zhǎng)逐漸升高,在處理10 h時(shí)達(dá)到最大值,是對(duì)照(0 h)的139倍。表明GmGolS2-1在大豆幼苗中能夠響應(yīng)高溫脅迫,可能在大豆應(yīng)對(duì)高溫脅迫過程中發(fā)揮作用。
2.2 GmGolS2-1植物表達(dá)載體構(gòu)建
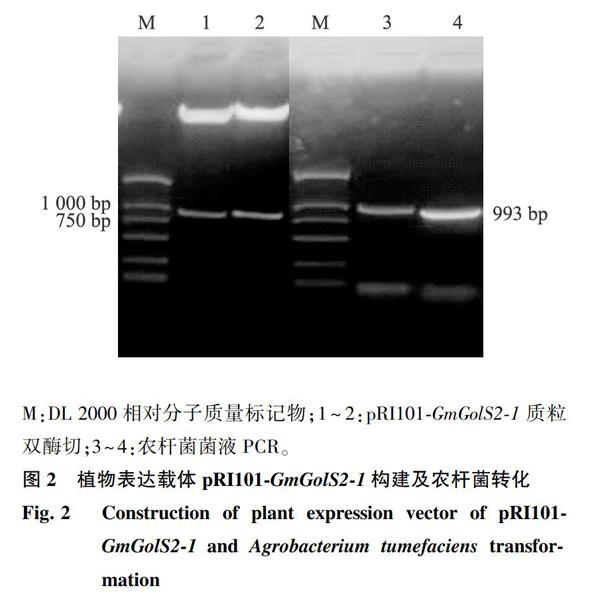
利用引物兩端的限制性內(nèi)切酶位點(diǎn),構(gòu)建GmGolS2-1植物表達(dá)載體。如圖2所示,質(zhì)粒雙酶切鑒定結(jié)果表明GmGolS2-1已經(jīng)整合進(jìn)植物表達(dá)載體pRI101中。農(nóng)桿菌菌液PCR鑒定結(jié)果(圖2)顯示已獲得含有重組載體pRI101-GmGolS2-1的轉(zhuǎn)基因工程菌。
2.3 GmGolS2-1轉(zhuǎn)基因煙草的篩選及鑒定
煙草遺傳轉(zhuǎn)化如圖3所示,在卡那霉素抗性培養(yǎng)基上篩選煙草愈傷組織(圖3A),待抗性芽長(zhǎng)至1 cm時(shí)(圖3B)將其移入生根培養(yǎng)基中,待根系生長(zhǎng)正常后(圖3C)再移入土中正常培養(yǎng)。
PCR檢測(cè)結(jié)果顯示,共獲得6株陽性轉(zhuǎn)基因煙草植株,分別命名為OE1~OE6(圖4A)。對(duì)轉(zhuǎn)基因煙草植株中GmGolS2-1基因的表達(dá)量進(jìn)行檢測(cè),野生型煙草中沒有GmGolS2-1基因的表達(dá),OE4植株中GmGolS2-1基因的表達(dá)量最高,其次是OE2植株,因此后續(xù)選擇OE4和OE2植株進(jìn)行耐高溫脅迫鑒定(圖4B)。
2.4 轉(zhuǎn)基因煙草耐熱性鑒定
高溫脅迫處理后,OE2和OE4轉(zhuǎn)基因煙草植株中的相對(duì)電解質(zhì)滲透率均低于野生型煙草,且OE4達(dá)到顯著程度(圖5A)。丙二醛含量檢測(cè)結(jié)果(圖5B)顯示,OE2和OE4轉(zhuǎn)基因煙草植株與野生型煙草植株在未處理(0 h)時(shí)的丙二醛含量沒有顯著差異;高溫脅迫處理48 h后,丙二醛含量均升高,但OE2和OE4轉(zhuǎn)基因煙草植株中的丙二醛含量均低于野生型煙草植株,且OE4達(dá)到顯著程度。以上結(jié)果表明,GmGolS2-1在煙草中的持續(xù)過表達(dá)可以減少高溫脅迫對(duì)煙草細(xì)胞質(zhì)膜完整性的破壞,提高轉(zhuǎn)基因煙草的耐熱性。
3 討論
作物在生長(zhǎng)發(fā)育過程中常常遭受各種逆境脅迫,其中高溫可以對(duì)作物的生長(zhǎng)發(fā)育造成不可逆轉(zhuǎn)的影響,且高溫常常伴隨著干旱及各種病害的發(fā)生,是導(dǎo)致作物減產(chǎn)質(zhì)量降低的主要因素之一。當(dāng)植物遭受高溫脅迫時(shí),相關(guān)轉(zhuǎn)錄因子可以激活脅迫相關(guān)基因的表達(dá)。GolS是RFO生物合成起始的關(guān)鍵限速酶,它通過催化UDP-半乳糖和肌醇反應(yīng)合成肌醇半乳糖苷,再以此為供體,在棉籽糖合成酶和水蘇糖合成酶的作用下將蔗糖合成棉籽糖和水蘇糖等寡糖[13]。這些可溶性糖不僅可以作為細(xì)胞中的滲透調(diào)節(jié)物質(zhì),還可以作為植物適應(yīng)環(huán)境的信號(hào)物質(zhì)[14]。因此,GolS基因?qū)χ参锏挚鼓婢趁{迫意義重大。
GolS屬于多基因家族,僅在擬南芥中就發(fā)現(xiàn)了10個(gè)編碼GolS的基因[15]。我們?cè)诖蠖够蚪M中共獲得6個(gè)GolS基因堿基序列,它們對(duì)非生物脅迫的應(yīng)答模式并不相同。基因表達(dá)量檢測(cè)結(jié)果顯示,GmGolS2-1是一個(gè)典型的高溫脅迫誘導(dǎo)表達(dá)基因。基因的表達(dá)模式往往與基因功能密切相關(guān),由此推測(cè)GmGolS2-1可能在大豆耐熱生理中起重要作用。前人也有過類似報(bào)道,例如鷹嘴豆CaGolS1可以應(yīng)答高溫脅迫,將其在擬南芥中過表達(dá)可以提高轉(zhuǎn)基因植株的耐熱性[9]。但到目前為止,有關(guān)GolS基因與高溫脅迫反應(yīng)之間的關(guān)系的研究相比其與其他非生物脅迫反應(yīng)還比較少,耐熱機(jī)制也不甚明了。Wang等[16]認(rèn)為,丹參中的3個(gè)GolS基因能夠被高溫脅迫誘導(dǎo)表達(dá),可能是這些基因上游的啟動(dòng)子序列中含有HSF轉(zhuǎn)錄因子結(jié)合的順式作用元件,轉(zhuǎn)基因試驗(yàn)結(jié)果也驗(yàn)證了此觀點(diǎn)。
植物在遭受外界逆境脅迫后通常會(huì)在形態(tài)上出現(xiàn)一系列的變化,如葉片萎蔫、葉色褪綠、幼苗死亡等[17-18]。但是單純的形態(tài)學(xué)觀察常常會(huì)產(chǎn)生極大的誤差,因此可以通過檢測(cè)某些與抗逆相關(guān)的生理指標(biāo)來鑒定不同植株的抗逆能力。高溫脅迫會(huì)導(dǎo)致植物脫水,影響植物體內(nèi)自由基產(chǎn)生和消除的平衡,進(jìn)而導(dǎo)致過氧化作用,破壞細(xì)胞膜的完整性,對(duì)細(xì)胞造成傷害[19]。電解質(zhì)滲透率增大是植物遭受逆境脅迫后細(xì)胞膜通透性增大的最直觀體現(xiàn),細(xì)胞膜通透性增大會(huì)導(dǎo)致細(xì)胞中物質(zhì)大量流失,進(jìn)而影響細(xì)胞正常的生理功能并最終影響植物的正常生長(zhǎng)發(fā)育[20]。丙二醛是植物膜脂過氧化的產(chǎn)物,其含量可作為判斷植物受損傷程度的一項(xiàng)重要生理指標(biāo)[21]。因此,電解質(zhì)滲透率和丙二醛含量可以在一定程度上反應(yīng)植株的抗逆能力。TaGolS3轉(zhuǎn)基因擬南芥和水稻在鋅離子脅迫下活性氧清除相關(guān)基因的表達(dá)量升高,其電解質(zhì)滲透率和丙二醛含量均低于野生型對(duì)照,由此提高了轉(zhuǎn)基因植株對(duì)重金屬脅迫的抗性[22]。本研究中,GmGolS2-1轉(zhuǎn)基因煙草植株在高溫處理下葉片電解質(zhì)滲透率及丙二醛含量均低于野生型對(duì)照組,證明GmGolS2-1基因可以降低高溫脅迫對(duì)煙草葉片造成的傷害,提高轉(zhuǎn)基因煙草的耐熱性。
參考文獻(xiàn):
[1] BARTELS D, SUNKAR R. Drought and salt tolerance in plants[J]. Critical Reviews in Plant Sciences, 2005, 24(1): 23-58.
[2] NISHIZAWA Y A, YABUTA Y, SHIGEOKA S. Galactinol and raffinose constitute a novel function to protect plants from oxidative damage[J]. Plant Physiology, 2008, 147(3): 1251-1263.
[3] KNAUPP M, MISHRA K B, NEDBAL L, et al. Evidence for a role of raffinose in stabilizing photosystem II during freeze-thaw cycles[J]. Planta, 2011, 234(3): 477-486.
[4] ELSAYED A I, RAFUDEEN M S, GOLLDACK D. Physiological aspects of raffinose family oligosaccharides in plants: protection against abiotic stress[J]. Plant Biology, 2014, 16(1): 1-8.
[5] TAJI T, OHSUMI C, IUCHI S, et al. Important roles of drought-and cold-inducible genes for galactinol synthase in stress tolerance in Arabidopsis thaliana[J]. Plant Journal, 2002, 29(4): 417-426.
[6] NISHIZAWA Y A, YABUTA Y, SHIGEOKA S. The contribution of carbohydrates including raffinose family oligosaccharides and sugar alcohols to protection of plant cells from oxidative damage[J]. Plant Signal Behavior, 2008, 3(11): 1016-1018.
[7] PANIKULANGARA T J. Galactinol synthase1. A novel heat shock factor target gene responsible for heat-induced synthesis of raffinose family oligosaccharides in Arabidopsis[J]. Plant Physiology, 2004, 136(2): 3148-3158.
[8] PILLET J, EGERT A, PIERI P, et al. VvGOLS1 and VvHsfA2 are involved in the heat stress responses in grapevine berries[J]. Plant & Cell Physiology, 2012, 53(10): 1776-1792.
[9] PRAFULL S, NITIN U K, MANOJ M. Stress-inducible galactinol synthase of chickpea (CaGolS) is implicated in heat and oxidative stress tolerance through reducing stress-induced excessive reactive oxygen species accumulation[J]. Plant Cell Physiol, 2018, 59(1): 155-166.
[10]ZHAI Y, SHAO S L, SHA W, et al. Overexpression of soybean GmERF9 enhances the tolerance to drought and cold in the transgenic tobacco[J]. Plant Cell Tissue and Organ Culture, 2017, 128(3): 607-618.
[11]HOEKEMA A, HIRSCH P R, HOOYKAASP J J, et al. A binary plant vector strategy based on separation of vir- and T-region of the Agrobacterium tumefaciens Ti-plasmid[J]. Nature, 1983, 303(5913): 179-180.
[12]SHAO H B, LIANG Z S, SHAO M A. Osmotic regulation of 10 wheat (Triticum aestivum L.) genotypes at soil water deficits[J]. Colloids and Surfaces B: Biointerfaces, 2006, 47(2), 132-139.
[13]PETERBAUER T, RICHTER A. Biochemistry and physiology of raffinose family oligosaccharides and galactosyl cyclitols in seeds[J]. Seed Science Research, 2001, 11(3), 185-197.
[14]SHEEN J, ZHOU L, JIANG J C. Sugar as signaling molecules[J]. Current Opinion in Plant Biology, 1999, 2(5): 410-418.
[15]KAPLAN F, KOPKA J, SUNG D Y, et al. Transcript and metabolite profiling during cold acclimation of Arabidopsis reveals an intricate relationship of cold-regulated gene expression with modifications in metabolite content[J]. The Plant Journal, 2007, 50(6): 967-981.
[16]WANG D H, YAO W, SONG Y, et al. Molecular characterization and expression of three galactinol synthase genes that confer stress tolerance in Salvia miltiorrhiza[J]. Journal of Plant Physiology, 2012, 169(18): 1838-1848.
[17]夏瑞祥,肖 寧,洪義歡,等. 東鄉(xiāng)野生稻苗期耐冷性的QTL定位[J]. 中國(guó)農(nóng)業(yè)科學(xué), 2010, 43(3): 443-451.
[18]王代鑫,徐 升,程 哲,等. 吉林省中晚熟水稻品種耐冷性鑒定結(jié)果與分析[J]. 中國(guó)稻米, 2020, 26(3): 48-53.
[19]CAKMAK I, HORSTW J. Effect of aluminium on lipid peroxidation, superoxide dismutase, catalase, and peroxidase activities in root tips of soybean (Glycinemax)[J]. Physiologia Plantarum, 1991, 83(3): 463-468.
[20]周 旋,申 璐,金 媛,等. 外源水楊酸對(duì)鹽脅迫下茶樹生長(zhǎng)及主要生理特性的影響[J]. 西北農(nóng)林科技大學(xué)學(xué)報(bào)(自然科學(xué)版), 2015, 43(7): 161-167.
[21]高向陽,楊根平,許志強(qiáng),等. 水分脅迫下鈣對(duì)大豆膜脂過氧化保護(hù)酶系統(tǒng)的影響[J]. 華南農(nóng)業(yè)大學(xué)學(xué)報(bào), 1999,20(2): 7-12.
[22]WANG Y, LIU H, WANG S, et al. Overexpression of a common wheat gene GALACTINOL SYNTHASE3 enhances tolerance to zinc in Arabidopsis and rice through the modulation of reactive oxygen species production[J]. Plant Molecular Biology Reporter, 2016, 34: 794-806.
(責(zé)任編輯:陳海霞)
收稿日期:2020-06-29
基金項(xiàng)目:黑龍江省普通本科高等學(xué)校青年創(chuàng)新人才培養(yǎng)計(jì)劃項(xiàng)目(UNPYSCT-2017153);黑龍江省省屬高等學(xué)校基本科研業(yè)務(wù)費(fèi)科研項(xiàng)目(植物性食品加工技術(shù)特色學(xué)科專項(xiàng))(YSTSXK201878);黑龍江省省屬高等學(xué)校基本科研業(yè)務(wù)費(fèi)科研項(xiàng)目(135209264);齊齊哈爾大學(xué)研究生創(chuàng)新科研項(xiàng)目(YJSCX2019050)
作者簡(jiǎn)介:邱 爽(1995-),男,山東濟(jì)寧人,碩士研究生,主要從事大豆分子育種研究。(E-mail)qs187143@163.com
通訊作者:翟 瑩,(Tel)15845640163;(E-mail)fairy39809079@126.com

