嗜烴乳化功能菌在多孔介質中的生長規律及驅油機理
李彩風,束青林,韓保鋒,曹嫣鑌,汪衛東,宋永亭,吏鋒兵,張 勇
(1.中國石化勝利油田分公司石油工程技術研究院,山東東營 257000;2.中國石化勝利油田分公司,山東東營 257001;3.中國石化勝利油田分公司孤島采油廠,山東東營 257231)
內源微生物采油技術是通過向油層注入激活劑,利用油藏條件下微生物的生長代謝活動提高原油采收率。該技術作為一項環保、低成本的可持續性發展技術,已在中外油田顯示良好的應用前景[1-6]。前期研究發現中高溫乳化微生物在中高溫油藏驅油過程中起著舉足輕重的作用[7-11]。由于油藏微生物生態系統及其生長代謝途徑紛繁復雜,定向調控內源微生物中的乳化功能菌使其發揮驅油作用的難度大[12-14]。與內源菌相比,外源菌具有復雜度低、可控性強、穩定性好等優點,因此,向油藏注入外源乳化功能菌,調整油藏微生物種群結構使其朝著有利于驅油的方向發展,成為內源微生物采油技術發展的新思路。注入的外源菌必須適應油藏環境,并與油藏內源菌相兼容,形成油藏微生物群落中穩定的優勢菌群,從而發揮內外源菌的協同驅油作用[15-16]。目前,乳化功能菌在油藏環境中生長繁殖情況、時空分布規律及其與油藏內源菌群之間的競爭關系尚不清楚,外源菌對生態系統中內源菌驅油影響的相關文獻報道非常少[17],還未見外源乳化功能菌在內源菌群落驅油過程中的追蹤生長變化報道,導致在油藏環境下對該類重要功能菌的激活調控針對性不強。
Geobacillus是高溫油藏中一類具有嗜烴和產乳化劑功能的菌屬[18-21],它是從Bacillus菌屬中分離出來的一組在表型和系統發育上相似的嗜熱菌群,該菌屬中大多數細菌的生長溫度高于55 ℃,并能降解烴類化合物。勝利油田石油工程技術研究院從油藏環境中篩選獲得一株SL-1菌,該菌能以烴類為唯一碳源進行生長代謝,烴類乳化能力強,最適宜生長溫度是65~70 ℃[22-23],且能產生一種以糖、蛋白和脂為主的生物乳化劑。本文將該乳化功能菌進行微觀可視模型和巖心填砂模型的多孔介質驅油研究,首次探索研究了多孔介質中油藏內源菌生態系統影響下外源乳化功能菌的驅油機理及生長分布規律,為中高溫油藏環境下利用外源菌強化內源菌驅油效果提供指導。
1 實驗器材與方法
1.1 實驗器材
實驗儀器包括微觀可視模型、微觀驅替系統、物理模擬驅油裝置、巖心填砂模型(尺寸:1 800 mm×38 mm,如圖1 所示)、定量PCR 儀、分光光度計。油水樣品取自勝利油田沾3 區塊,原油黏度為230 mPa·s,地層水礦化度為1 890 mg/L;菌種采用SL-1菌,來自勝利油田石油工程技術研究院微生物中心菌種庫。激活劑體系包括尿素,酵母粉,K2HPO4·3H2O,KH2PO4,MgSO4·7H2O和微量元素,其質量濃度分別為5,1,2.7,1.0,0.2和0.1 g/L,pH 值調至中性。
圖1 巖心填砂模型分段取樣Fig.1 Sectional sampling of core sand-packed model
1.2 實驗方法
1.2.1 微觀驅油實驗方法
利用高溫高壓微觀可視驅油系統,模擬油藏高溫、高壓環境,將SL-1 菌注入至微觀可視模型中進行培養,研究剩余油變化[24],具體步驟包括:①將微觀可視模型升溫至65 ℃,抽真空,飽和含有激活劑的地層水。②飽和原油后,進行一次水驅至約1.5 PV,停止水驅。③注入0.8 PV 的SL-1 菌液,緩慢增壓至10 MPa,培養不同時間,觀察剩余油變化。④培養結束后,后續二次水驅1.5 PV,水驅后分析剩余油驅替情況。
1.2.2 巖心填砂模型驅油實驗方法
利用巖心填砂模型驅油系統,模擬油藏高溫、高壓環境,將不同介質分批次注入巖心填砂模型中,激活培養,研究該菌的時間及空間變化規律,具體步驟包括:①將巖心填砂抽真空、飽和水,并飽和原油。②進行一次水驅,注入速度為1 mL/min,驅替3 PV 至含水率95%以上。③巖心中注入0.05 PV 的激活劑體系/SL-1 菌/SL-1 菌+激活劑體系,注入結束后繼續以相同速度用注入水連續驅替。分別于一次水驅后的第1 d、第8 d、第15 d 和第22 d,共注入4輪次激活劑體系/SL-1菌/SL-1菌+激活劑體系。④對不同時間產出液進行驅替效率、微生物種群結構及SL-1 數量等指標檢測。⑤實驗結束后拆卸巖心,分析不同位點油砂內滯留的SL-1菌數量及殘余油飽和度。以一直注水驅替的巖心作為空白對照。其中,僅注入激活劑體系是利用內源菌的生長代謝進行驅油,僅注入SL-1 菌是利用SL-1 菌的發酵代謝產物進行驅油,而同時注入SL-1菌和激活劑體系是利用SL-1 菌和內源菌共同繁殖代謝來發揮驅油作用。
1.2.3 SL-1菌定量檢測
從NCBI 的GenBank 數據庫中下載G.stearother?mophilus目的序列,根據功能基因中的保守區設計特異性引物,功能基因Geb-F 引物序列為5`-TAA GCG TGA GAT CGG TGG TTC-3`,功能基因Geb-R引物序列為5`-GCG CTC TCG GTT TCT TCC TT-3`。從油藏微生物中提取細菌總DNA 后,利用特異性引物進行基因擴增,擴增片段純化后構建標準品質粒,制作SL-1菌標準曲線。
1.2.4 微生物種群結構分析
提取樣品中微生物DNA,然后擴增獲取16s DNA 基因文庫克隆,送至深圳華大基因公司進行微生物高通量測試,確定樣品中微生物種群結構組成。
1.2.5 油砂中原油測定
利用沾3 區塊原油繪制原油含量標準曲線,對巖心中的油砂進行石油醚萃取,分離并收集原油萃取液,然后利用分光光度計對萃取液進行吸光度檢測,明確樣品中的原油含量,并通過巖心孔隙體積計算殘余油飽和度。
2 實驗結果
2.1 SL-1菌的微觀驅油
一次水驅之后,微觀可視模型中存在膜狀、簇狀、盲端等大量不同形態的剩余油,繼續同時注入外源菌SL-1和激活劑體系作為實驗組進行培養,以只添加激活劑體系作為空白對照。隨著地層水中內源菌的激活,代謝產生的生物表面活性劑使膜狀剩余油減少,但是壁面殘余油及盲端剩余油的剝離能力有限(圖2)。SL-1菌在油藏環境中生長繁殖產生生物表面活性劑,導致模型潤濕性發生改變,孔隙壁面的膜狀剩余油收縮,乳化成油滴從壁面剝離,盲端剩余油也被有效剝離驅出,原油乳化現象增強(圖3)。

圖2 空白培養期間剩余油變化Fig.2 Changes of residual oil in blank control group

圖3 SL-1菌培養期間剩余油變化Fig.3 Changes of residual oil in test group with SL-1
油藏環境下,微生物與原油作用一段時間后,再進行二次水驅,剩余油明顯減少,大部分簇狀、柱狀剩余油被驅替(圖4,圖5)。與空白對照相比,SL-1 菌作用后的油膜、盲端等剩余油被有效驅動,二次水驅后剩余油更少。由此可見,在高溫、高壓油藏環境下,加入SL-1菌可以有效提高剩余油驅替效率。
2.2 巖心填砂模型微生物驅油效果
從表1中可以看出,外源菌+內源菌體系提高原油采收率達13.5%。其次,內源菌提高原油采收率為8.8%,外源菌提高原油采收率為7.2%。由此可見,內、外源菌的生長繁殖,強化了單純內源菌或單純外源菌發酵液的驅油效果,從而進一步提高了原油采收率。
2.3 不同注入體系產出液中微生物數量變化
不同注入體系產出液中的微生物數量變化不同(圖6)。僅注入外源菌的巖心產出液中微生物數量很低,基因拷貝數最高約為102copies/mL,說明微生物在地層水貧瘠的營養環境中難以有效生長,這時驅油效率的貢獻來自發酵液中存在的生物表面活性劑產物,與外源菌繁殖代謝無關;僅注入激活劑體系的巖心產出液中微生物數量開始呈現波動變化,然后逐漸趨于穩定,約為107copies/mL,說明激活劑體系可以有效促進內源菌的生長,但是到后期,微生物增殖到一定程度,數量難以進一步增加;而同時注入外源菌和激活劑體系的巖心產出液中微生物總量呈上升變化趨勢,基因拷貝數約為109copies/mL,微生物數量始終高于其余2種注入體系。由此可見,同時注入外源菌和激活劑可以進一步提高油藏微生物的數量,強化微生物代謝活性,有利于微生物驅油。
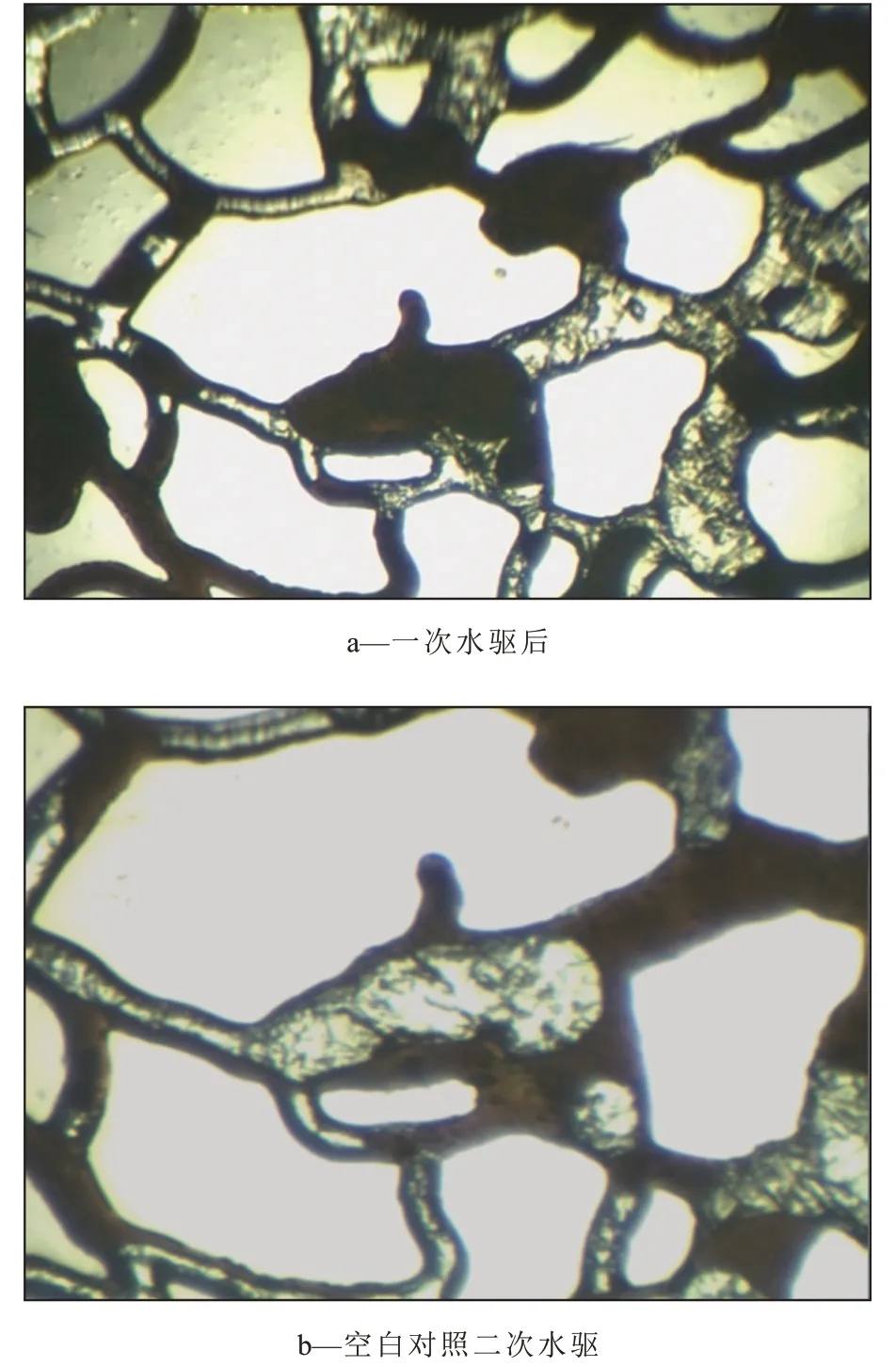
圖4 空白對照作用前后剩余油分布Fig.4 Distribution of residual oil before and after blank control

圖5 SL-1菌作用前后剩余油分布Fig.5 Distribution of residual oil before and after addition of SL-1

表1 不同微生物注入體系提高采收率情況Table1 Enhanced oil recovery in different microbial injection systems %
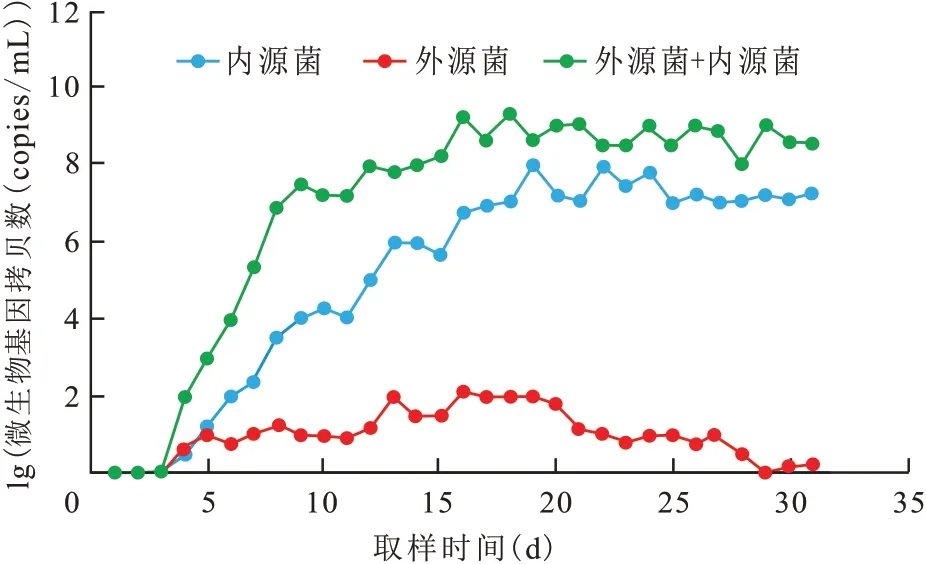
圖6 不同注入體系驅替中微生物數量變化Fig.6 Changes in number of microorganisms during oil displacement in different injection systems
2.4 復合驅替中微生物群落結構
2.4.1 不同輪次微生物群落結構
微生物種群結構分析結果顯示,同時注入外源菌SL-1 菌和激活劑體系的巖心產出液<中Geoba?cillus始終是產出液中微生物群落的優勢菌之一,而其他優勢菌在各輪次之間變化較大。但是整個微生物生態系統中的功能菌以烴降解菌為主,每輪次中占比均達70%以上,可能與注入的無機鹽激活劑體系有關。由表2 可知,除Geobacillus菌之外,第1輪激活后主要是棲熱孢菌(Thermotoga)、不動桿菌(Acinetobacter)、海桿菌(Marinobacter)和油桿菌(Petrobacter);第2 輪激活后主要包括脫硫桿菌(De?thiobacter)、不動桿菌(Acinetobacter)、吞菌弧菌(Pe?redibacter)、棲熱孢菌(Thermotoga);第3 輪優勢菌以纖維單孢菌屬(Cellulomonas)、脫硫弧菌(Desulfovi?brio)、脫硫桿菌(Dethiobacter)、海桿菌(Marino?bacter)為主;第4 輪優勢菌以假單胞菌(Pseudomo?nas)、脫硫弧菌(Desulfovibrio)、希瓦氏菌屬(She?wanella)和海桿菌(Marinobacter)。
SL-1 菌能夠適應沾3 油藏環境,在油藏微生物生態系統中具有一定競爭優勢,多輪次外源菌的注入使該菌在內源群落中逐漸保持穩定,功能菌優勢地位凸顯。但是隨著培養時間延長,Geobacillus菌在整個微生物生態系統中的占比有所下降,由開始21%降低至13%,推測隨著激活劑體系消耗,代謝產物積累、內源菌的競爭繁殖等因素影響,油藏生態系統中微生物群落結構開始發生轉變。

表2 4輪激活過程中驅出液的優勢菌群Table2 Dominant bacterium in produced liquid during four rounds of activator injections
2.4.2 不同巖心位置微生物群落結構
對巖心不同部位油砂中微生物種群結構及SL-1 菌進行了分析,結果顯示SL-1 菌在巖心入口處占比最高,可達55%,隨著離入口端距離增加,該菌在菌群中的比例逐漸降低,出口端為12%(圖7)。分析認為:一方面,該菌具備兼性厭氧的生理特性,可以在巖心不同位置進行生長繁殖;另一方面,激活劑體系注入后充分激活了地層水中內源菌,微生物多樣性增強。同時,對不同位置的SL-1菌進行基因定量分析,結果顯示(圖8),該菌在巖心中前部數量較高,最高可達106copies/mL,隨之緩慢下降,出口端數量約為103copies/mL,說明大部分外源菌依然滯留于巖心中,可以繼續有效發揮驅油作用。此外,還可以看出SL-1菌在巖心不同位點的濃度與殘余油飽和度存在一定負對應關系,該菌濃度高的位點對應的殘余油飽和度比較低(殘余油飽和度約為30%)。

圖7 油砂不同取樣點的微生物種群結構Fig.7 Microbial community structure at different sampling points in oil sands
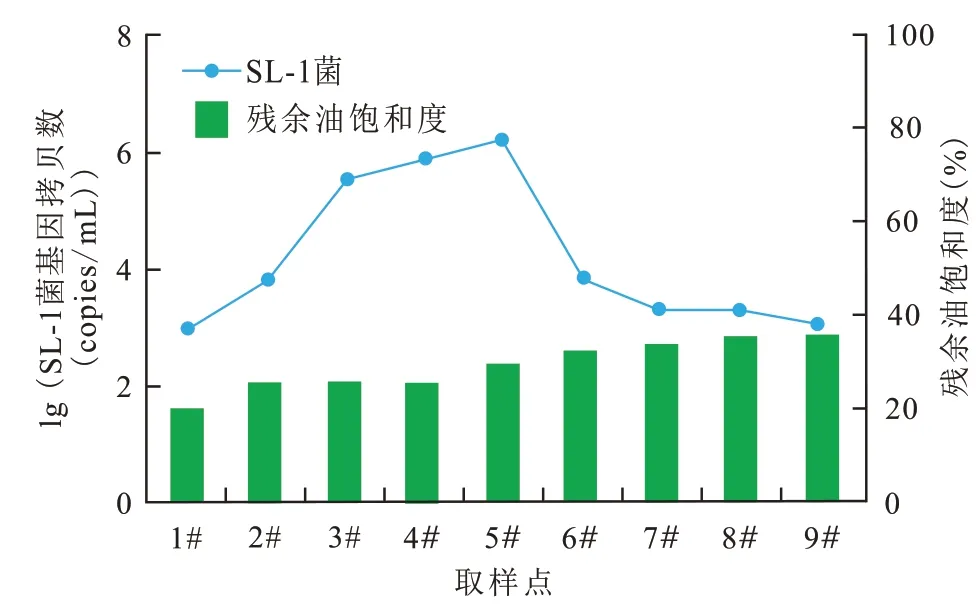
圖8 SL-1菌在巖心中的空間分布Fig.8 Spatial distribution of SL-1 in core
3 結論
SL-1 菌能夠在模擬油藏環境的微觀可視模型中生長代謝,同單純激活內源菌的空白對照相比,添加該菌后可以增強微生物與原油的相互作用,提高了微生物的原油驅替效率。巖心填砂模型實驗中該菌始終是產出液微生物優勢種群之一,其濃度與巖心殘余油飽和度呈現負對應關系,表明該菌生長繁殖與巖心驅油密切相關,與微觀模型驅油現象一致。隨著注入時間延長,該菌在生態系統中占比有所下降。因此,要使該菌長期在油藏內源菌生態系統中維持穩定,還需要對SL-1 菌的注入方式、注入時間、激活劑體系種類等調控方式繼續進行深入研究。
此外,內源菌驅油過程中油藏微生物數量隨著時間延長逐漸趨于平穩,后期即使再注入激活劑體系,微生物數量也不會有顯著的增殖變化,整個生態系統達到一個平衡狀態。外源菌的注入可以刺激油藏微生物進一步生長繁殖,提高微生物驅油效果。因此,調控研究外源菌與內源菌之間的協同機制,充分發揮外源菌強化內源菌驅油的效果,將為微生物驅油技術的發展提供新思路。

