內窺鏡開發和臨床診療環節中的感控影響因素
浙江省醫療器械審評中心,浙江 杭州 311121
引言
內窺鏡診療是臨床常用的診療手段。2012年中國共完成消化內鏡診療2877萬例;2015年全國胸外科采用胸腔鏡的肺癌手術比例為73.74%(108116/146601)[1];在我國華東地區,有60%的患者接受了微創手術,這個比例在大醫院已經達到了90%[2];世界范圍內主要的醫學中心,微創手術所占的比例已經超過了開放手術[3]。
內窺鏡的大量應用也帶來了交叉感染的風險。根據美國的相關報導,軟性胃腸鏡或支氣管鏡引起的感染包括:乙型肝炎病毒(Hepatitis BVirus,HBV)感染、丙型肝炎病毒(HepatitisCVirus,HCV)感染、綠膿桿菌感染等[4-6]。而我國擁有龐大的傳染病患者群體,是內窺鏡交叉感染的風險因素之一,國內慢性HBV感染者約為7000萬例[7],丙肝患者共計約1000萬例[8],報告的現存活HIV/AIDS 患者 758610 例[9]。
但是目前內窺鏡感染控制的主要手段是進行內窺鏡的術后處理(清洗、消毒、滅菌)。Rauwers等[10]報道了多例十二指腸鏡經過清洗消毒仍造成交叉感染的案例,因此不能僅關注術后處理環節,需要全面考慮影響內窺鏡感染控制的因素,降低內窺鏡交叉感染風險。
1 產品開發過程中的感控影響因素
1.1 設計環節對內窺鏡交叉感染的影響
設計一次性內窺鏡可杜絕內窺鏡交叉感染。這類內窺鏡由企業進行滅菌,且僅由一個患者使用,沒有交叉感染的風險[11]。Baeg等[12]報道,一次性超細內窺鏡用于經皮胃造瘺手術,能夠提高患者的滿意度,防止不必要的麻醉,降低感染。Muthusamy等[13]針對一次性十二指腸鏡的研究也證明這種替代方法可降低ERCP相關的感染風險。目前全球已經有成功獲批上市的一次性內窺鏡產品,見圖1。

圖1 國外企業開發的一次性內窺鏡產品
重復用內窺鏡的“感控”設計能最大程度降低交叉感染的發生率。重復用內窺鏡可以給多個患者使用,每次給患者使用前都需要由醫療機構進行清洗消毒。結構設計的原則是不應“藏匿”血液、體液及組織;內窺鏡沾染血液、體液及組織的部位應該易于發現并易于清洗消毒。考慮這些因素開發出的產品可有效減少內窺鏡的交叉感染。
美國制定指南較早,美國醫療器械促進協會(Association for the Advancement of Medical Instrumentation,AAMI)2010年發布的TIR12:2010指出生產商應該確保其產品能被安全有效的再處理。之后,AAMI發布了針對重復用醫療器械清洗剛要TIR30:2011,對器械產品的材料、設計、清洗、測試給出了相關建議,這兩個指南給企業的產品開發提供了指導。
國內沒有專門的開發指導建議,企業可參考國內滅菌的相關標準和規范:a. 醫用低溫等離子滅菌器不能滅菌的物品:內徑小于1 mm、長度大于500 mm的不銹鋼管狀器械[14];b. 醫用環氧乙烷滅菌器的挑戰裝置是管長4.55 m(標稱),內徑為3.0 mm(標稱)鋼管[15];c. 硬式內窺鏡可拆卸部分必須拆開清洗[16];d. 軟性內窺鏡清洗過程中,必須刷洗軟式內鏡的所有管道[17]。綜合國內外標準、指南的相關信息,越細長的管道、越深的縫隙、越復雜的結構越不容易清洗和消毒,越容易造成交叉感染,反之則會降低交叉感染發生的幾率。
1.2 驗證環節對內窺鏡交叉感染的影響
經過充分驗證的處理流程可有效降低內窺鏡交叉感染的風險。
根據法規的要求,內窺鏡生產企業在產品上市前應該進行清洗、消毒、滅菌方面的研究,并將驗證過的流程寫入說明書。醫療器械使用單位應當按照說明書的要求使用醫療器械[18],因此經過充分驗證的流程可以保證產品清洗、消毒、滅菌的效果,從而避免內窺鏡交叉感染的發生。
截至目前國內沒有重復用醫療器械清洗、消毒、滅菌驗證的指南或指導原則,企業在產品驗證過程中可以參考類似產品的方案,或者AAMI發布的TIR12:2010和TIR30:2011,來制定適合自己產品的方案。
2 臨床診療環節中的感控影響因素
2.1 內窺鏡術前檢查對內窺鏡交叉感染的影響
內窺鏡損壞會導致交叉感染的發生[19-20],未經檢測的內鏡可能會導致患者感染或傷害[21-22]。因此手術前應對內窺鏡進行檢查,確保內窺鏡沒有損壞,降低交叉感染的發生。
攜帶病毒或致病菌的患者是交叉感染的高危因素,輸血前及手術前對患者進行四項感染性疾病[人類免疫缺陷病毒(Human Immunodeficiency Virus,HIV)、總蛋白(Total Protein,TP)、HCV、乙型肝炎表面抗原(Hepatitis B surface Antigen,HBsAg)]指標的檢測可以確定患者患以上四種傳染性疾病的情況,對防止醫院感染和減少醫療糾紛具有重要意義[23]。
因此內窺鏡術前應對患者進行檢查,但是國內內窺鏡術前檢查沒有統一標準。腹腔鏡、胸腔鏡手術,常規檢查傳染性疾病指標;消化內鏡診療,衛生部沒有明確提出患者術前檢查的要求。國內有學者指出規范的內鏡清洗消毒可避免交叉感染,時間及費用相對較低,因此內鏡診療前的血液檢驗并非必須[24]。支氣管鏡診療,中華醫學會指南建議患者檢查前應篩查血源性傳播疾病,防治醫源性感染[25],不過此條建議的推薦等級為D,由于不是衛生部發布的操作規范,因此在支氣管鏡的實際診療中,僅有部分醫院進行術前檢查;婦科內窺鏡診療,中華醫學會術前檢查推薦HBsAg、丙型肝炎(丙肝)抗體、HIV及梅毒螺旋體抗體,對于宮腔鏡手術,還需要輔加項目:血型、RH因子、凝血功能、肝腎功能、血糖、乙型肝炎(乙肝)五項等[26]。
2.2 內窺鏡術中措施對內窺鏡交叉感染的影響
非專用內窺鏡增加交叉感染的風險。2001年衛生部要求醫療機構對于HBsAg陽性者、已知特殊感染患者或非特異結腸炎患者等,應使用專用內窺鏡或安排在每日檢查的最后[27]。但是自2006年衛生部已經不再對專用內窺鏡做強制要求。因此內窺鏡的感染控制主要依靠術后的清洗消毒來實現,可是強明珠等[28]發現即使經過了清洗和消毒,內窺鏡中仍然檢出了結核分歧桿菌等病原菌,增加了患者交叉感染的風險。因此為減少了交叉感染風險,部分醫療機構出臺了各自的“內窺鏡感染管理制度”,要求傳染病患者使用“專用內窺鏡”,同時會將此類患者安排在每天的最后進行檢查或治療。
使用一次性內窺鏡沒有交叉感染風險。即使根據感控指南對內窺鏡進行處理,重復用內窺鏡仍然有交叉感染的風險[29],而一次性內窺鏡沒有交叉感染的風險[30-31]。衛健委對是否使用一次性內窺鏡進行診療沒有明確要求,但是感染朊病毒患者或疑似感染朊病毒患者宜選用一次性使用診療器械、器具和物品;氣性壞疽病原體患者宜使用一次性診療器械、器具和物品[32]。
因此,內窺鏡診療中可采用“專鏡專用”或使用一次性內窺鏡降低交叉感染風險。
2.3 內窺鏡術后處理對交叉感染的影響
完整的內窺鏡術后處理應包括回收、分類、清洗、消毒、干燥、器械檢查與保養、包裝、滅菌、儲存[33]等幾個步驟。其中較重要的環節為清洗和消毒(滅菌),內鏡清洗消毒不徹底將會導致醫院感染發生甚至暴發,因而醫院內鏡清洗消毒效果也越來越受到關注[34]。
國內目前普遍采用斯伯爾丁分類法[32]對內窺鏡進行分類,并進行相應級別的消毒。根據《內鏡清洗消毒技術操作規范(2004年)》,內窺鏡種類為腹腔鏡、關節鏡、腦室鏡、膀胱鏡、宮腔鏡時對應滅菌,當內窺鏡種類為喉鏡、氣管鏡、支氣管鏡、胃鏡、腸鏡、乙狀結腸鏡、直腸鏡時,進行高水平消毒。
2015年5月25 日于德興銅礦壓濾機廠房取底泥運至研究基地進行模擬小試,試驗分地栽與生態袋栽兩種模式。
雖然國家出臺了相關細則,但是由于每種內窺鏡的結構有所不同,因此應該按照具體產品的說明書分別進行清洗消毒。
另外,多項研究也表明加強內鏡清洗、消毒人員的培訓,規范內鏡清洗、消毒流程,加強清洗消毒管理能有效防止交叉感染[35-37]。
3 監管機構對內窺鏡感染控制的監管與指導
國家藥品監督管理局要求企業提交滅菌和消毒工藝研究[38]。其下屬的醫療器械審評中心負責審核內窺鏡清洗消毒驗證的合理性。同時醫療器械審評中心也在持續發布相關審評指導原則,用以指導企業開展清洗消毒的確認工作。
衛生健康委員會要求醫院建立針對內鏡、外來器械、植入物等的清洗消毒滅菌管理規范和相應標準操作規程,做好清洗消毒滅菌質量監測和反饋[39],并定期對醫院進行檢查,同時發布管理規范指導醫院開展內窺鏡的感控工作,見圖2。

圖2 監管機構對內窺鏡感控環節的監管
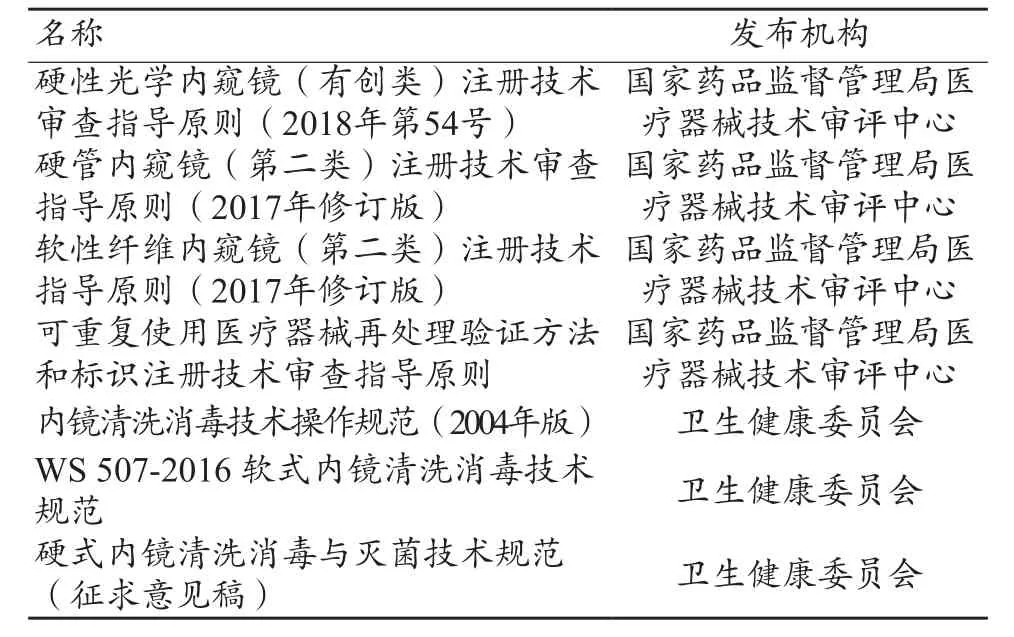
表1 監管機構出臺的重復用內窺鏡相關法規或規范
4 總結
內窺鏡感染控制非常重要,其直接影響患者的安全。完善的產品設計、產品驗證、術前檢查、術中診療、術后處理、機構監管才可以防止內窺鏡交叉感染。
目前內窺鏡的術后處理較為成熟,已經可以實現對大部分內窺鏡的消毒或滅菌,降低交叉感染的發生率。但是產品設計、術前檢查等環節還沒有得到足夠的重視,即使嚴格執行術后處理流程,仍有交叉感染的案例發生,因此需要改進其他環節,防止交叉感染的發生。
現在不少生產企業已經意識到感染控制的重要性,在開發之初就將感控概念融入產品當中,醫療機構也越來越重視交叉感染,已經有醫院應用信息化系統管理內窺鏡洗消,實現感控可追蹤,相信未來內窺鏡感控不會僅針對某一環節的管控,而是從開發到使用的全流程管理,大幅度降低交叉感染的發生。

