姜黃素促進炎癥微環境下大鼠骨髓間充質干細胞骨向分化
董春燕 盧永超 劉海英 徐子琪 張韶君
1 濱州醫學院口腔醫學院 山東 煙臺 264003;2 千佛山醫院口腔科 山東 濟南 250001
牙周病是口腔常見疾病,在牙周致病菌刺激下,大量炎癥因子激活炎性反應的過程打破了骨改建的內穩態,從而造成機體成骨能力下降和牙周骨組織損傷[1]。目前對于該疾病的治療和缺損骨組織的修復仍未解決。近年來,許多學者將目光投向再生醫學方向,希望通過干細胞的手段進行骨缺損的再生。間充質干細胞(mesenchymal stem cells,MSCs)免疫原性低,具備再生和修復功能,是牙周組織再生良好的種子細胞[2-3]。骨髓間充質干細胞(bone marrow mesenchymal stem cell,BMSCs)具有較強自我更新和多向分化潛能[4],并且其取材方便、來源廣泛,成為骨組織工程較理想的來源細胞[5]。干細胞微環境的調控對于牙周組織的再生非常重要[6-7],但是在牙周炎患者的牙周支持組織中,炎癥的持續存在會影響MSCs的成骨分化,所以很難實現喪失的骨組織重建[8]。姜黃素為中藥姜黃的主要活性成分,因其安全的藥理活性被應用于骨質疏松癥的治療[9]。姜黃素對于炎癥環境下BMSCs骨向分化能力的影響研究較少,本研究使用腫瘤壞死因子α(tumor necrosis factor-α,TNF-α)建立體外炎癥微環境,觀察姜黃素對炎癥環境下大鼠細胞的增殖情況的影響,用礦化結節染色等方法進行體外細胞實驗研究,揭示炎癥微環境對BMSCs成骨分化的影響,以便后期進一步研究其可能的調控機制,為牙周炎的治療和防治提供思路。
1 材料與方法
1.1 試劑與儀器 4周齡wistar雄性大鼠(山東省千佛山醫院實驗動物中心);磷酸鹽緩沖液(phosphate buffered saline,PBS)、雙抗(100 U/mL青霉素+100 μg/mL鏈霉素)、α-MEM培養液、0.25%胰蛋白酶(HyClone,美國);胎牛血清(fetal calf serum,FBS;Gibco,美國);姜黃素、維生素 C、β-甘油磷酸鈉、地塞米松、吲哚美辛、胰島素、IBMX、茜素紅染色液、飽和油紅O染液、氯化十六烷吡啶、Trizol試劑(Sigma-Aldrich,美國);堿性磷酸酶染色試劑盒(上海碧云天生物技術有限公司);Cell Counting Kit-8(CCK-8)試劑盒(Dojindo公司,日本);HiScript ?ⅢRT反轉錄試劑盒、SYBR Green熒光定量聚合酶鏈檢測試劑盒(南京諾唯贊生物科技有限公司);倒置相差顯微鏡(Olympus,日本);全自動酶標儀(Spectro公司,德國);LightCycler480 PCR儀(Roche,瑞士)。
1.2 BMSCs的培養及多向分化能力檢測 全骨髓細胞貼壁法培養獲得Wistar大鼠BMSCs,第三代細胞用于后續實驗。將細胞以2.0×105個/孔的密度接種于6孔板中,接種后加入完全培養液,置于37 ℃、5% CO2的培養箱中靜置培養。24 h后棄去培養基,分別加入成骨誘導液(含有地塞米松10-8mol/L、β-甘油磷酸鈉10 mmol/L、維生素C 50 mg/L的α-MEM完全培養基)和成脂誘導液(含1 μmol/L 地塞米松、200 μmol/L 吲哚美辛、10 mg/L胰島素及500 μmol/L IBMX的α-MEM培養液),每3 d換液 1 次。成脂誘導2周后,進行油紅O染色;成骨誘導3周后,進行茜素紅染色。
1.3 細胞分組 取第三代細胞,分為正常組、炎癥組和姜黃素+炎癥組。根據相關文獻報道及前期實驗[10]選用10 ng/mL TNF-α處理BMSCs進行炎癥誘導。利用CCK8分別檢測1、3、5 d 姜黃素(0.01、0.1、1、10 μmol/L)對細胞活性的影響進行姜黃素濃度的選擇。
1.4 CCK-8檢測細胞活性 細胞以3×103個/孔接種于96孔板中,加入常規培養液放入恒溫培養箱。貼壁24 h后,對細胞進行不同處理,每個樣本設置5個復孔,每2天更換1次培養液,分別于培養的1、3、5 d,吸凈96孔內的培養基,每孔加入10 μL CCK8溶液和90 μL無血清培養基,將孔板繼續孵育1 h后,酶標儀在450 nm波長處測量吸光度值。
1.5 ALP染色及茜素紅染色檢測細胞骨向分化能力 將細胞以2.0×105個/孔的密度接種于6孔板中,貼壁24 h后,按實驗分組方案更換成骨誘導液體外培養細胞,每3 d換液一次。于成骨誘導的第7天行堿性磷酸酶染色;在第14天進行茜素紅染色,觀察細胞礦化情況,并用十六烷基吡啶水溶液溶解成骨染色結節,將一定量的各組溶解液置于96孔板內,在562 nm 波長下測定吸光光度值。
1.6 RT-PCR檢測成骨相關基因表達 將細胞以2.0×105個/孔的密度接種于6孔板中,貼壁24 h后按照不同分組方案繼續培養細胞14 d。應用 TRIzol 試劑并參照試劑盒說明書分別提取細胞總RNA,利用HiScript ?ⅢRT反轉錄試劑盒合成cDNA。使用SYBR Green熒光定量聚合酶鏈檢測試劑盒進行qRT-PCR反應,分別檢測骨涎蛋白(bone sialoprotein,BSP)、Runt相關轉錄因子2(Runx2)的mRNA的表達,以GAPDH作為內參基因,據2-△△CT法計算基因的相對表達量。引物由鉑尚生物科技有限公司設計合成。
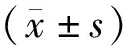
2 結果
2.1 大鼠BMSCs培養 倒置顯微鏡下見,培養3 d后大部分BMSCs貼壁,呈現多角形、長梭形;約7 d后,細胞長滿培養皿約80%(圖1A)。到第3代細胞形態較為均一,無自發性分化現象。對第3代細胞進行成骨誘導后,茜素紅染色可見鈣化現象(圖1B);成脂誘導后油紅O染色可見脂滴形成(圖1C)。

A.原代BMSCs培養7 d(×40);B.茜素紅染色(×40);C.油紅O染色(×100)
2.2 CCK-8檢測細胞增殖情況 0.01、0.1、1 μmol/L 姜黃素對炎癥狀態下大鼠BMSCs的增殖無明顯影響,各組之間差異無統計學意義,但是在10 μmol/L姜黃素作用下,細胞增殖能力明顯下降,P<0.01,見圖2。故本研究選擇1 μmol/L姜黃素濃度進行實驗。
與炎癥組比較,**P<0.01。
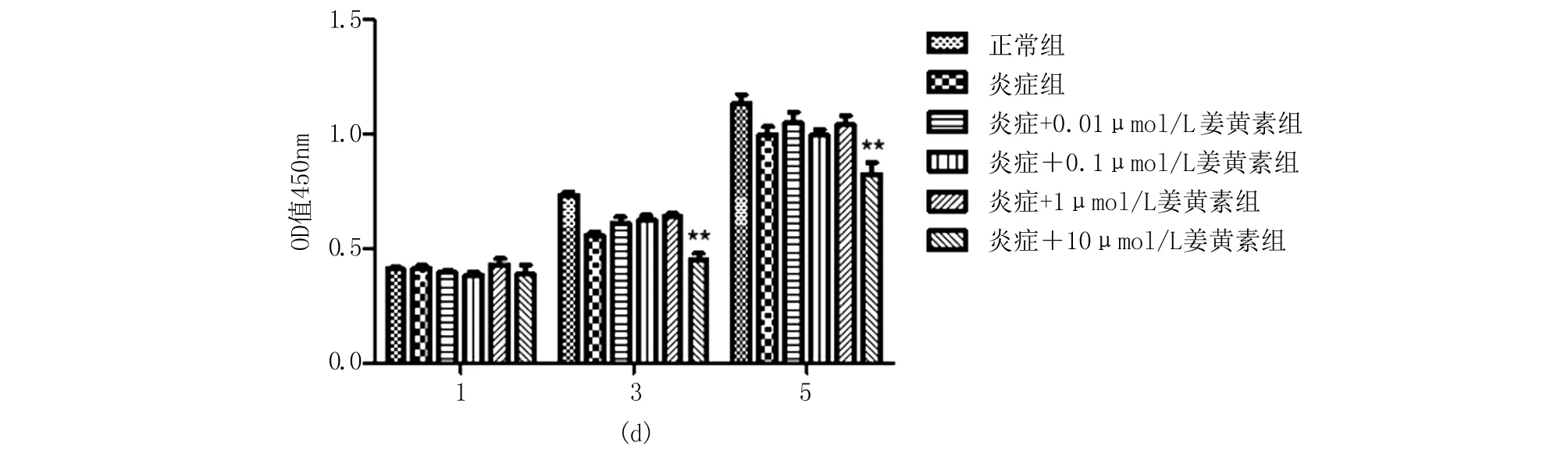
2.3 ALP及茜素紅染色 經過成骨誘導培養,染色結果顯示三組細胞均有成骨分化特性,炎癥組較正常組染色變淺、礦化結節減少;姜黃素+炎癥組染色加深、礦化結節增多(圖3、4)。
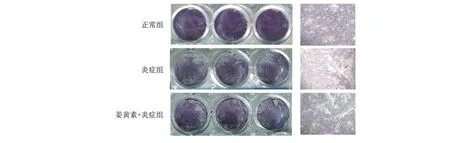
圖3 各組大鼠骨髓間充質干細胞堿性磷酸酶染色
與炎癥組比較,*P<0.05,**P<0.01。
2.4 qRT-PCR檢測BSP、Runx2 mRNA表達情況 成骨誘導后14 d,炎癥組BSP、Runx2的基因表達水平均低于正常組,P<0.01;姜黃素+炎癥組可促進炎癥微環境下BMSCs細胞BSP、Runx2 mRNA表達,P<0.05,見圖5。

與炎癥組比較,*P<0.05,**P<0.01。
3 討論
牙周炎主要是由局部因素引起的牙周支持組織的慢性炎癥性疾病,其始動因子是口腔致病微生物[10]。正常的牙周組織處于一種動態平衡狀態,當細菌感染時,牙周袋內細菌分泌的毒素及代謝產物會產生大量的細胞因子,若炎癥得不到及時控制,炎癥可擴散到深層牙周膜、牙槽骨和牙骨質,破壞平衡狀態,打破骨改建的內穩態,造成牙槽骨的吸收[11-12]。在這種炎癥持續存在的情況下,骨質的重建非常困難。到目前為止,沒有抑制牙周炎引起牙槽骨喪失的理想藥物。為實現缺損牙槽骨的再生,需探究新的方法來提高炎癥狀態下的成骨分化能力。
BMSCs是一種來源于中胚層的具有多向分化潛能和自我更新能力的干細胞,可促進牙槽骨的再生、加速牙周疾病的好轉乃至愈合,在組織損傷修復的治療中有著廣泛的應用前景,成為目前進行基因治療、干細胞治療以及骨組織工程的理想種子細胞[13]。牙周炎患者的牙周炎癥微環境降低了BMSCs的骨性分化能力,影響牙周組織的再生[14]。因此,提高BMSCs的成骨分化率已成為國內外研究的熱點,對牙周病的防治乃至整個骨組織工程的研究都具有重要意義。
TNF-α是牙周炎患者牙周組織中存在的一種主要促炎因子,在牙周病的發生、發展及轉歸進程中起著至關重要的作用[15-16],并且TNF-α 可以激活 NF-κb 通路,使炎癥、增殖和凋亡相關基因的表達上調[17],所以其可以作為誘導劑誘發間充質干細胞產生炎癥。本研究通過在BMSCs中加入10 ng/mL的 TNF-α,誘發BMSCs炎癥反應,模擬牙周炎時骨質所處的炎癥微環境,建立骨細胞凋亡模型[18]。
姜黃素是從姜科姜黃屬植物姜黃、莪術等的根莖中提取的有效成分,是一種植物多酚類化合物質,具有抗炎、抗腫瘤、抗氧化、降糖等多種藥理活性[19]。姜黃素在骨代謝過程中具有重要的調節作用[20],不但可以抑制破骨細胞的形成,減少骨吸收,還可以促進成骨細胞骨形成,增加骨密度,減輕骨質疏松癥狀[20]。Bharti等[21]研究發現,姜黃素抑制破骨細胞前體中NF-κb配體誘導的NF-κb活化的受體活化劑,并抑制破骨細胞生成。李廣悅等[22]的研究顯示,姜黃素可減少LPS引發的成骨細胞的凋亡,改善骨形成能力。姜黃素作用于細胞的濃度不同,對成骨及破骨的研究結果亦會產生較大的出入。為探討姜黃素對炎癥狀態下大鼠BMSCs的骨向分化作用,本研究首先用不同濃度的姜黃素處理大鼠BMSCs,檢測細胞活性。實驗證實1 μmol/L的姜黃素干預處理,觀察到其對炎癥狀態下大鼠BMSCs的增殖無明顯影響。后續實驗中,通過ALP、茜素紅染色及qRT-PCR檢測成骨分化水平的變化表明,炎癥微環境下BMSCs的成骨分化能力降低,而姜黃素則會在一定程度上改善炎癥狀態下抑制的骨髓間充質干細胞成骨分化能力。
綜上所述,姜黃素在一定程度上可以增強炎癥微環境下BMSCs的骨向分化能力,姜黃素對細胞的炎癥保護作用及促進其在炎癥狀態下骨向分化的具體機制還需進一步的研究。

