黃杞苷對H2O2誘導SH-SY5Y細胞氧化應激損傷的保護作用
劉 慧 閆 冬 徐洋洋 李淑翠 張樹平
1 濱州醫學院基礎醫學院藥理學教研室 山東 煙臺 264003;2 濱州醫學院附屬醫院藥學部 山東 濱州 256603
氧化應激是引起神經損傷的原因之一,細胞內的活性氧簇(reactive oxygen species,ROS)的產生和清除不平衡會引起ROS的過度積累,導致氧化應激。氧化應激會破壞蛋白質、酶、脂質等成分,損害神經元[1]。SH-SY5Y細胞源自人神經母細胞瘤SK-N-SH系,此細胞能夠表達神經元所特有的酪氨酸羥化酶、多巴胺、多巴胺-β羥化酶和多巴胺轉運體[2],因此它常作為神經元細胞模型,用于神經系統疾病的發病及作用機制方面的研究[3]。H2O2能夠引起組織細胞氧化損傷,破壞細胞膜的結構,導致組織細胞受損[4]。核因子E2相關因子2(nuclear factor erythroid-2 related factor 2,Nrf2)是調節氧化還原平衡的關鍵轉錄因子。氧化應激狀態下,Nrf2被激活,并由細胞漿轉移至細胞核,提高谷胱甘肽過氧化物酶(glutathione peroxidase,GSH-Px)和超氧化物歧化酶(superoxide Dismutase,SOD)的活性,從而對抗氧化應激[5]。其下游蛋白血紅素氧化酶1(Heme Oxygenase 1,HO-1)是一種重要的內源性抗氧化防御蛋白,可以催化血紅素降解,具有抗氧化、維持細胞微循環和調節細胞周期的作用[6]。
從中藥中提取出的多種活性單體化合物對神經元細胞發揮有益的作用。黃杞苷是中藥土茯苓中一種具有生物活性的黃酮類化合物。中國藥典記載,土茯苓性平,除濕、解毒、通利關節。土茯苓中含有的黃酮苷類物質包括黃杞苷、落新婦苷、白藜蘆醇等[7]。Huang等[8]研究發現,黃杞苷通過調節果蠅肌動蛋白(kelch-like ECH-associated protein 1,Keap1)/Nrf2通路的功能,減輕了Aβ1-42誘導的BV-2細胞氧化應激和炎癥反應。本研究擬建立H2O2誘導的SH-SY5Y細胞損傷模型,觀察黃杞苷的抗氧化損傷作用,探討其分子機制是否與Nrf2/HO-1信號通路有關。
1 材料與方法
1.1 細胞、主要藥物和試劑 人神經母細胞瘤細胞株(SH-SY5Y),購買于中國醫學科學院基礎醫學研究所。黃杞苷(標準品,HPLC≥98%)購自森貝伽生物科技(南京)有限公司;胎牛血清、DMEM培養基購于Gibco公司;Nrf2抗體(ab137550)、HO-1抗體(ab13243)、Lamin B1抗體(ab65986)和辣根過氧化物酶(horseradish peroxidase,HRP)標記的山羊抗兔IgG二抗(ab6721)均購自Abcam公司(美國);細胞核蛋白和細胞漿蛋白抽提試劑盒、4-甲基偶氮唑藍(MTT)檢測試劑盒、Annexin V-FITC/PI雙染試劑盒、DCFH-DA試劑盒、SOD活性檢測試劑盒和GSH過氧化物酶檢測試劑盒均購自碧云天生物技術有限公司(中國,上海)。
1.2 儀器 HERAcell 240I CO2培養箱購自美國Thermo公司;LA2-5A1型生物安全柜購自新加坡ESCO公司;H1M全功能酶標儀購自美國伯騰儀器有限公司;SYSTEM GelDoc XR+凝膠成像系統購自美國Bio-Rad公司;Eppendorf低溫高速離心機購自Eppendorf AG公司。
1.3 細胞培養 復蘇并培養SH-SY5Y細胞,將其置于培養條件為10%胎牛血清的DMEM培養基中,于37 ℃、5% CO2細胞培養箱內常規培養,每兩天換一次培養液,每三天傳代一次,細胞生長至約80%融合時進行相關實驗。
1.4 H2O2損傷模型的建立 將細胞接種在96孔板中,分為空白對照組與H2O2損傷組,共6組,每組設置6個副孔,每孔含完全DMEM培養基200 μL,37 ℃、5%CO2條件下培養24 h,使細胞完全貼壁。小心去除培養基,向每孔中加入H2O2終濃度為(125、200、250、500和800 μmol·L-1)的不完全DMEM培養基溶液200 μL,繼續培養12 h。棄掉含有H2O2的培養基,向每孔中加入100 μL的MTT工作液,培養箱中孵育4 h,棄掉MTT工作液,每孔加120 μL DMSO,490 nm下檢測吸光度(OD值),以空白對照組細胞的抑制率為0 %,根據各組細胞平均OD值計算各組細胞平均抑制率,用SPSS軟件計算得到IC50值,最終確定H2O2(500 μmol·L-1)孵育12 h作為H2O2損傷模型的條件。
1.5 MTT法 SH-SY5Y細胞以每毫升4×104個接種于96孔板中,待細胞處于對數生長期時,分為空白對照組、模型組和給藥組,6個給藥組分別加入不同濃度黃杞苷(5、10、20、40、80、160 μmol·L-1)預處理12 h后,模型組和給藥組給予H2O2(500 μmol·L-1)孵育12 h。采用MTT法檢測SH-SY5Y細胞存活率。
1.6 檢測SOD和GSH水平 SH-SY5Y細胞以每毫升4×104個接種于96孔板中,待細胞處于對數生長期時,分為空白對照組、模型組和給藥組,3個給藥組分別加入黃杞苷(5、10和20 μmol·L-1)預處理12 h后,模型組和給藥組給予H2O2(500 μmol·L-1)孵育12 h。按照試劑盒說明的方法準備測定所需工作液,并對各組樣品進行處理。總SOD活力以SOD活力單位表示,GSH含量以各組等量樣品勻漿中GSH濃度表示。
其中總SOD活力計算公式為:
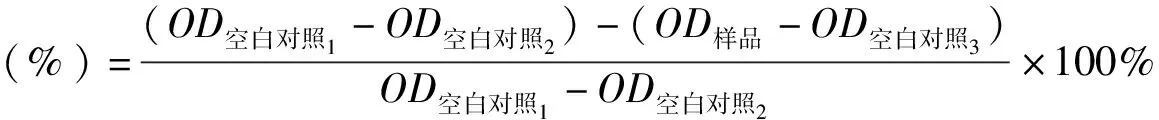
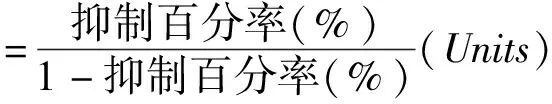
GSH計算公式為:

1.7 流式細胞術 將SH-SY5Y細胞按每孔5×105個細胞的密度接種在6孔板中培養24 h,使細胞完全貼壁。分為空白對照組、模型組和給藥組,給藥組分別加入黃杞苷(5、10和20 μmol·L-1)預處理12 h后給予H2O2(500 μmol·L-1)孵育12 h,模型組和給藥組只給予H2O2(500 μmol·L-1)孵育12 h。通過流式細胞術對使用DCFH-DA探針標記的SH-SY5Y細胞進行ROS水平測定。用不完全DMEM培養基將10 mmol·L-1的DCFH工作液以1∶1 000比例稀釋為10 μmol·L-1的工作液,每管細胞中加入100 μL并置于培養箱中孵育20 min,離心棄上清,每管中加入4℃ PBS 100 μL吹打混勻,用流式細胞儀進行計數和熒光強度檢測。
1.8 Western Blot 將SH-SY5Y細胞按每孔5×105個細胞的密度接種在6孔板中培養24 h,使細胞完全貼壁。一種實驗設計是分對照組和實驗組,黃杞苷(20 μmol·L-1)預處理6、12、24 h后,Western Blot檢測各組細胞漿和細胞核內Nrf2的表達的影響。另一種實驗設計是分對照組、模型組和給藥組,給藥組分別給予不同黃杞苷(5、10和20 μmol·L-1)預處理12 h后,模型組和給藥組用H2O2(500 μmol·L-1)孵育12 h,Western Blot檢測各組細胞漿和細胞核內Nrf2的表達以及細胞漿內HO-1的表達。
2 結果
2.1 MTT法檢測細胞存活率
2.1.1 H2O2誘導SH-SY5Y細胞損傷濃度篩選 利用MTT法確定H2O2的損傷條件,計算各組細胞活力損失百分比和抑制率。根據MTT的活力計算IC50值,以損傷條件接近IC50與試劑配制簡便為原則,最終確定H2O2誘導SH-SY5Y細胞損傷模型條件為500 μmol·L-1H2O2損傷12 h。
2.1.2 黃杞苷對H2O2誘導SH-SY5Y細胞損傷的保護作用 先用不同濃度黃杞苷(5、10、20、40、80、160 μmol·L-1)預處理SH-SY5Y細胞12 h,再用500 μmol·L-1H2O2孵育12 h,采用MTT法檢測細胞活力。結果顯示,與對照組相比,H2O2損傷細胞12 h后,細胞活力明顯下降(P<0.01),而黃杞苷處理過的細胞,其活力明顯上升且呈現劑量依賴性趨勢,并在20 μmol·L-1處呈現最佳促進濃度(P<0.01),見圖2。因此,在后續實驗中選取5、10、20 μmol·L-1的黃杞苷作為預處理給藥濃度。

和對照組相比,**P<0.01。

和對照組相比,##P<0.01;和模型組相比,*P<0.05,**P<0.01。
2.2 黃杞苷對H2O2誘導SH-SY5Y細胞損傷后SOD和GSH含量的影響 模型組H2O2孵育12 h后SH-SY5Y細胞的SOD和GSH水平顯著降低(P<0.01),黃杞苷(5,10和20 μmol·L-1)預處理后的SH-SY5Y細胞SOD和GSH水平較模型組顯著升高(P<0.05),如圖3所示。結果表明,黃杞苷能夠上調SH-SY5Y細胞中SOD和GSH水平,減輕H2O2對SH-SY5Y細胞的氧化損傷。

A.模型組平均SOD活力為0.53U,空白組為1.31U,低、中、高給藥組活力分別為1.08U、1.09U、0.87U;B.模型組GSH的平均濃度為20.90 μmol·L-1,空白組為60.13 μmol·L-1,低、中、高給藥組濃度分別為30.04、35、34 μmol·L-1。和對照組相比,##P<0.01;和模型組相比,*P<0.05,**P<0.01。
2.3 黃杞苷抑制H2O2誘導SH-SY5Y細胞損傷后ROS的生成 利用流式細胞術和DCFH-DA探針技術對SH-SY5Y細胞ROS的生成量進行檢測,其散點圖結果見圖4A,對陽性細胞計數并統計,統計結果見圖4B。結果表明,空白組細胞經DCFH-DA染色后ROS生成較少(4.07% ± 0.90),H2O2孵育SH-SY5Y細胞12 h后,ROS陽性率(11.27±0.91)顯著提高,P<0.01。黃杞苷給藥組(5、10和20 μmol·L-1)劑量依賴性降低了ROS陽性率,三個濃度的陽性率分別為10.5±0.6,6.93±0.64,5.83±0.61。和模型組相比,黃杞苷給藥組(10和20 μmol·L-1)ROS陽性率顯著降低,P<0.01。結果表明,黃杞苷能夠濃度依賴性地抑制H2O2誘導SH-SY5Y細胞損傷后ROS的生成增多。
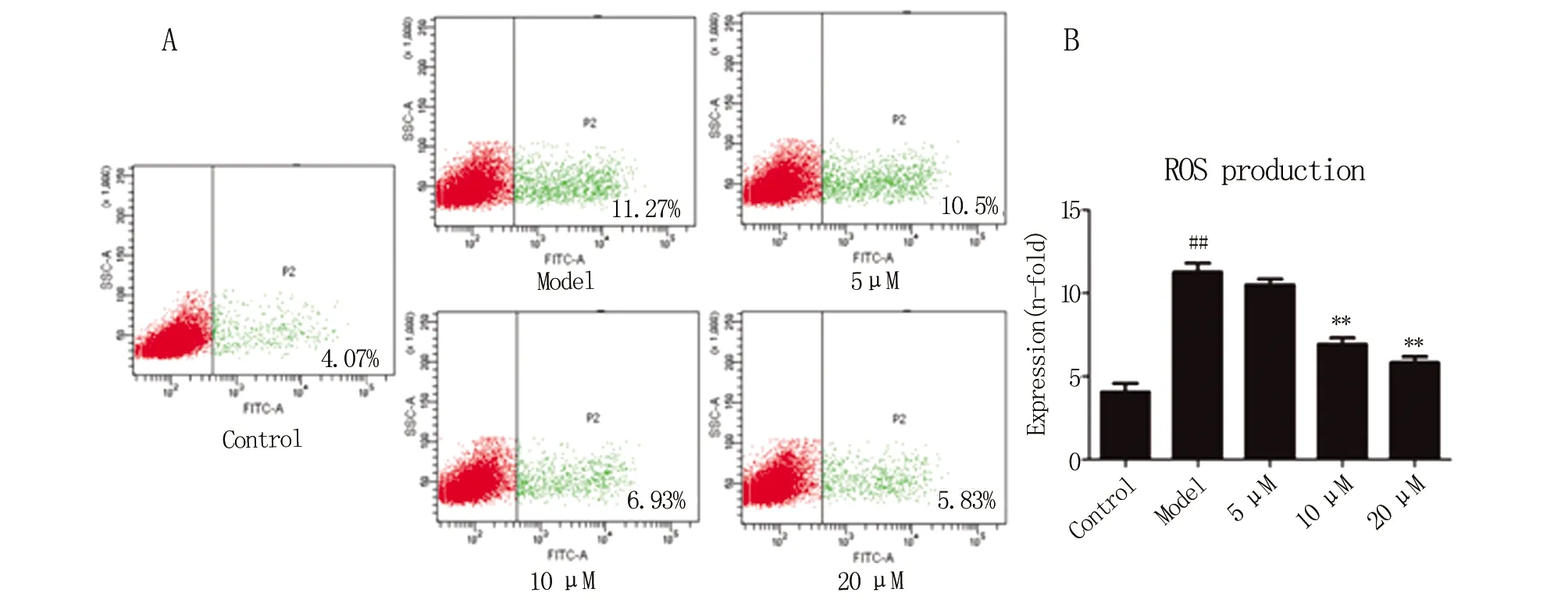
和對照組相比,##P<0.01;和模型組相比,**P<0.01。
2.4 黃杞苷對H2O2誘導SH-SY5Y細胞損傷中Nrf2表達的影響 為了探討黃杞苷抑制H2O2誘導SH-SY5Y細胞氧化損傷的作用機制,本研究采用Western blot方法分析了Nrf2的表達及其核轉位情況。免疫印記結果顯示,黃杞苷(20 μmol·L-1)孵育細胞0、6、12、24 h后,能夠時間依賴性地促進細胞核內Nrf2蛋白表達(P<0.05),且在12 h時最顯著(圖 5 A、B、C)。此外,黃杞苷(5,10和20 μmol·L-1)預處理12 h后,細胞核中的Nrf2表達量明顯增加(P<0.01),胞漿內Nrf2表達量減少(P<0.01),說明黃杞苷可以濃度依賴性地激活Nrf2,并促進其向核內轉位(圖5 D、E、F)。

A.用黃杞苷(20 μmol·L-1)對SH-SY5Y細胞進行不同時間(0、6、12和24 h)孵育處理,Western Blot檢測分析核Nrf2與胞漿Nrf2表達水平,利用Image J軟件對Western Blot條帶進行灰度值分析;B.不同效應時間SH-SY5Y細胞核Nrf2表達統計結果;C.不同效應時間SH-SY5Y細胞胞漿Nrf2表達統計結果;D.用不同濃度黃杞苷(5、10和20μmol·L-1)處理細胞12 h,Western Blot檢測分析核Nrf2與胞漿Nrf2表達水平,利用Image J軟件對Western Blot條帶進行灰度值分析;E.不同濃度黃杞苷處理后SH-SY5Y細胞核Nrf2表達統計結果;F.不同濃度黃杞苷處理后SH-SY5Y細胞胞漿Nrf2表達統計結果。和對照組相比,*P<0.05,**P<0.01;和模型組相比,#P<0.05,##P<0.05。
2.5 黃杞苷對H2O2誘導SH-SY5Y細胞損傷中HO-1表達的影響 黃杞苷(5、10和20 μmol·L-1)預處理SH-SY5Y細胞12 h后,H2O2孵育12 h。Western Blot檢測HO-1蛋白表達情況見圖6A,HO-1蛋白統計結果見圖6B,與模型組比較,黃杞苷低、中劑量組HO-1水平顯著提高(P<0.01),而高劑量組HO-1表達略有升高。這說明,黃杞苷在一定程度上能夠促進HO-1蛋白的表達,降低H2O2誘導SH-SY5Y細胞氧化損傷。
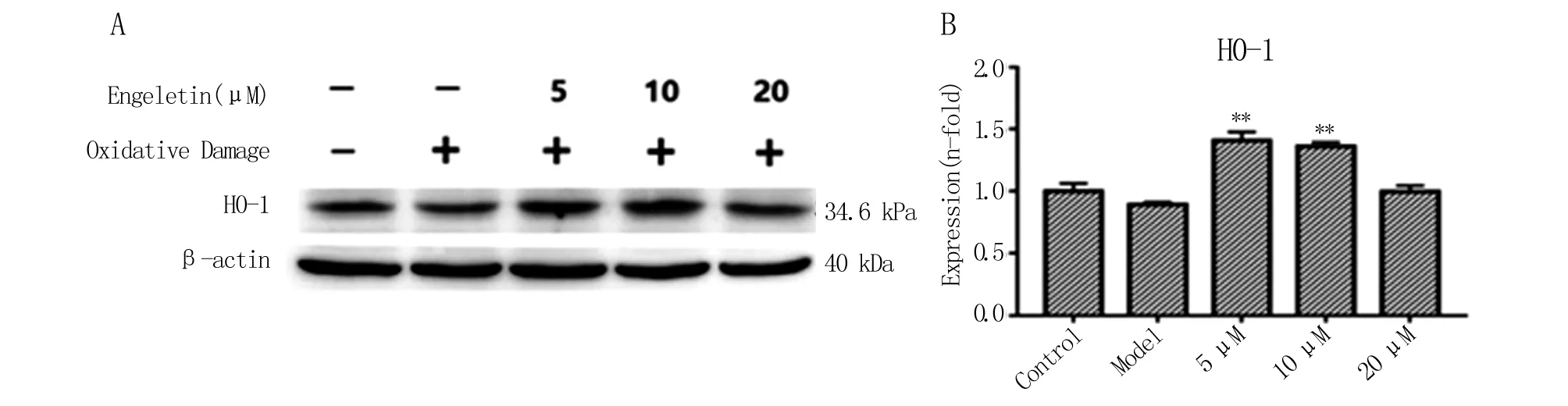
A.不同濃度黃杞苷(5、10和20 μmol·L-1)處理細胞12 h后,Western Blot 法檢測分析細胞總蛋白中HO-1的表達情況;B.不同濃度黃杞苷處理后HO-1蛋白表達統計結果。和模型組相比,**P<0.01。
3 討論
氧化應激是諸多中樞神經系統疾病的重要病理機制,主要表現為活性氧的增加和抗氧化能力的下降,過量的活性氧導致細胞膜發生脂質過氧化、蛋白質的降解以及核酸的破壞,嚴重影響神經元突觸功能,甚至導致神經元凋亡[9]。因此,氧化應激成為預防和治療中樞神經系統疾病的重要靶標。SOD是生物體內存在的一種抗氧化金屬酶,可反映機體對氧自由基的清除能力,具有高度專一性,SOD活性水平降低與神經組織受損直接相關[10]。GSH-Px是谷胱甘肽系統中一種重要的酶,它能調節細胞氧化還原平衡,在降低H2O2或氧化型脂質的水平中起到重要作用[11]。本研究表明,H2O2誘導SH-SY5Y細胞12 h后ROS陽性率顯著提高、SOD、GSH-Px含量顯著降低。黃杞苷(5、10和20 μmol·L-1)預處理后,黃杞苷劑量依賴性地降低H2O2誘導SH-SY5Y損傷后ROS陽性率、提高SOD、GSH-Px含量。
Nrf2是存在于細胞質中的重要的氧化應激調控蛋白。正常狀態下,機體內存在Nrf2分子合成和酶解的動態平衡,Nrf2分子與Keap1結合形成異二聚體,并借助Keap1蛋白固定在細胞骨架上[12]。氧化應激反應發生時,大量ROS可促使Nrf2從Keap1上解離,并轉移至細胞核內,并與核內抗氧化反應元件(antioxidant response element,ARE)結合將其激活,從而使機體上調下游一些抗氧化因子相關基因的表達[13],HO-1相關基因就是ARE下游靶基因之一[14]。本次研究中,模型組Nrf2表達略有上升,可能是氧化應激引起機體自身抗氧化防御系統啟動。與模型組相比,黃杞苷顯著促進Nrf2從胞漿向細胞核內的轉移,且呈現劑量依賴性趨勢。此外,對黃杞苷預處理SH-SY5Y細胞的藥動學結果看,Nrf2在12 h時出現最大轉移,表明黃杞苷對Nrf2的最佳效應時間比較接近12 h。與模型組相比,黃杞苷給藥組HO-1表達顯著提高,結合Nrf2結果可知,黃杞苷可通過增加Nrf2向核內轉移,進而激活下游HO-1蛋白,發揮其保護作用。
綜上所述,本文首次研究了黃杞苷對H2O2誘導的SH-SY5Y氧化應激損傷的保護作用,其機制可能是激活了Nrf2,并促進Nrf2向核內轉位,進而上調了其下游抗氧化酶HO-1的表達。但是,黃杞苷對Nrf2由胞漿向核膜的轉移是否同時激活了Nrf2上游通路蛋白,尚需進一步研究。

