針刺激痛點聯合電沖擊波對肌筋膜激痛點MTrPs大鼠海馬表達的影響*
王興瑜
黑龍江中醫藥大學,黑龍江 哈爾濱 150040
骨骼肌結節處存在大量高度異常敏感小點即為肌筋膜激痛點(myofascial trigger points,MTrPs),經觸診發現該處存在一條緊繃肌帶[1]。隱性激痛點在受到創傷、免疫力下降、疲勞、機體姿勢長期失衡及營養物質缺乏等刺激會轉化為活化激痛點,從而導致關節功能受限、骨骼肌疼痛、自主神經功能紊亂及感覺異常等,甚至導致患者肢體功能喪失[2]。已有學者指出,對MTrPs進行針刺可起到滅活作用,通過觀察患者疼痛改善情況、疼痛閾值、關節活動度及焦慮、抑郁指數等進行多方面證實,確定針刺MTrPs可起到良好效果[3]。采用體外沖擊波干預,同樣可起到治療肌筋膜疼痛的作用。雖然已有大量學者投身于鎮痛激痛點的研究,但關于該治療的機理仍無統一定論,且現有研究主要集中在組織形態學及肌電生理學方面,關于分子生物層面的研究相對較少[4]。體外沖擊波的治療機制雖已明確,但是關于體外沖擊對激痛點是如何發揮作用的研究卻相對較少。本研究通過制備大鼠MTrPs模型,采用不同方式進行干預,分析針刺及電沖擊波對大鼠海馬Smad4和TGF-β1蛋白表達的影響。
1 材料
1.1 動物6周齡SD雄性大鼠60只,體質量220~250 g,由上海杰思捷實驗動物有限公司提供,許可證號:SYXK(滬)2014-0002。飼養條件:溫度20~25 ℃,相對濕度40%~70%,每日保持12 h的固定明暗周期。
1.2 試劑Smad4抗體(美國Abcam公司,批號:XY-E30413);轉化生長因子-β1(transforming growth factor-β1,TGF-β1)抗體(美國Abcam公司,批號:XY-E30026);BCA蛋白濃度測定試劑盒(美國ThermalScientific公司,批號:BC-WB-005-500T);Trizol(美國Invitrogen公司,批號:15596-026);RNA-freeWater(德國QIAGEN公司,批號:129112)。
1.3 儀器MutiscanGo型全波長酶標儀(Thermo公司);TissueRuptor型勻漿器(北京鼎昊源公司);GIS-1600型凝膠成像系統(上海天能科技有限公司);電泳槽和電泳儀(美國BIORAD公司);熱循環儀(美國LIFE公司)。
2 方法
2.1 模型制備與給藥大鼠適應飼養1周后進行模型制備。將大鼠隨機分為6組,每組10只,即空白組、模型組、針刺激痛點組、針刺非激痛點組、電沖擊波組、針刺痛點沖擊波結合組。除空白組外,其余大鼠復制MTrPs模型。每周第1天對大鼠進行打擊處理,將其固定在自制模型上,取仰臥位,對標記部位垂直打擊,用質量為1200 g的打擊器,選擇20 cm自由落體運動完成打擊,動能約2.4 J,與大鼠腓腸肌接觸面積約1 cm2,打擊部位為大鼠左后肢腓腸肌中端偏上0.5~1 cm位置,導致該位置出現鈍挫傷。打擊后第2天對大鼠進行跑臺離心運動,讓其完成持續性下坡跑訓練,該訓練在傾斜角為-16°的電動動物跑臺上進行,逐漸增加跑臺轉速,直至升至16 m·s-1,每次跑臺訓練時間為90 min,訓練期間研究人員可采用聲音、木棒等對大鼠進行刺激,保證其進行良好的運動。在后續5 d內對大鼠正常喂養,重復以上操作,進行為期8周的重復后,進入為期4周的修復期,修復期大鼠正常喂養,干預12周后完成MTrPs模型創建。采用國際公認MTrPs存在特征對動物模型建立成功與否進行判斷。首先剔除大鼠后肢毛發,對造模部位觸診,可觀察到大鼠左后肢造模部位存在攣縮結節,在結節處刺入第1支電極針,觀察到存在肌肉跳動情況,在第1根電極針旁3~5 mm 處將另一電極針刺入作為參考電極,進行肌電裝置連接,觀察大鼠肌電活動情況,時間為 1 min,造模成功時會存在高頻自發性電位,對該期間頻率的波頻、波幅及波長詳細記錄。
2.2 各組干預措施空白組大鼠不進行任何處理;模型組大鼠僅進行造模處理,但在完成造模后不對該組大鼠進行針刺或(和)電沖擊波處理;針刺激痛點組大鼠在造模成功后進行針刺干預,對大鼠左后肢常規消毒,取針灸針對大鼠腓腸肌的4處激痛點針刺刺激,采用分層次提插方式,對相應的疼痛激痛點尋找,并內外上下4個方向進行滅活,在找準激痛點后,可觀察到該部位肌肉出現抽搐顫動狀,進行中等強度針刺,顫動次數為6次時出針,本次針刺治療結束;針刺非激痛點組同樣對其左后肢常規消毒,對腓腸肌的4處激痛點旁1~2 cm處針刺,觀察進針后大鼠未發生肌肉顫動情況,同樣為中等強度針刺,進行6次分層次提插后將針取出,治療結束;體外沖擊波組在完成造模后進行4周正常飼養,對大鼠麻醉后,在大鼠右股內側肌處涂沫耦合劑,采用沖擊波治療儀(storzMP100型,瑞典)對其進行沖擊波治療,探頭選擇F15,劑量0.16 Mj·mm-2,沖擊300次,頻率1.3 Hz,每5 d進行1次,連續3次后對該組大鼠正常飼養;針刺聯合電沖擊波組在完成針刺后隨即對其進行電沖擊波治療,針刺方案與針刺痛點組一致,電沖擊波方案與電沖擊波組一致,干預周期均為每周1次治療,共4周。采用腹膜內注射戊巴比妥鈉(60 mg·kg-1)對大鼠深度麻醉,確定其完全麻醉后,取其仰臥位,對股內側肌解剖分離,取 1 cm3左右的組織切塊,放入4%的多聚甲醛固定,無菌操作下剝離腦組織分離海馬部分,用預冷的 PBS 洗滌去除殘留血液和污染物,沖洗干凈[5],立即置于液氮中速凍,-80 ℃冰箱保存備用[6]。
2.3 觀察指標
2.3.1 免疫組織化學染色采用免疫組織化學染色對股內側肌組織切片處理,觀察激痛點局部Smad4和TGF-β1表達。脫蠟處理,用體積分數為3%的雙氧水滅活后過氧化酶滴加,時間 10 min;用微波爐對其進行加熱,在沸騰后停止加熱,自然冷卻,將其置于pH值7.4的0.1 mol·L-1枸櫞酸鈉緩沖液中,時間10 min;用5%的BSA封固液封固處理在37 ℃下反應30 min;滴加兔大鼠Smad4和TGF-β1多克隆抗體,反應時間2 h,用PBS液反復沖洗,時間5 min,共3次;加入二抗,37 ℃下反應 30 min;用PBS沖洗,時間5 min,共3次;滴加ASBC溶液,時間30 min,溫度為37 ℃,用PBS溶液清洗,時間 5 min,共4次;滴加DAB試劑,顯色在室溫下完成,反應時間15 min,在顯微鏡下控制;用蒸餾水洗滌,復染采用蘇木精,完成染色后脫水、透明及封固等操作,在光學顯微鏡下觀察[7]。
2.3.2 Western Blot法對大鼠海馬中Smad4和TGF-β1的表達將海馬剪切成碎片,用RIPA裂解液溶解,充分混合,離心半徑8.5 cm,12 000 r·min-1,離心時間 5 min,分離上層清液,用BCA蛋白濃度測定試劑盒測定蛋白濃度,37 ℃,孵育30 min,562 nm處進行吸光度測量[8],根據蛋白標準品濃度計算樣本總蛋白濃度。每孔加樣液30 μg,電脈后轉膜,用封閉液稀釋的GAPDH、Smad4及TGF-β1進行孵育,4 ℃,過夜;用TBST溶液洗膜,沖洗5 min,連續3次,加入HRP標記的羊抗兔二抗及HRP標記的羊抗小鼠二抗,室溫下孵育2 h,用TBST溶液洗膜,每次 15 min,連續5次;加入化學發光檢測試劑,反應2 min,將膜取出,甩去多余液體,用保鮮膜包好PVDF膜,在暗室中感光、顯影以及定影[9-10]。

3 結果
3.1 各組大鼠波頻、波幅及波長變化結果分析與空白組相比,模型組波頻、波幅及波長均顯著升高(P<0.01);與模型組相比,針刺激痛點組、電沖擊波組及刺痛點沖擊波結合組的波頻、波幅及波長均顯著降低(P<0.01),其中刺痛點沖擊波結合組大鼠波頻、波幅及波長下降最為明顯。見表1。
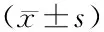
表1 各組大鼠波頻、波幅以及波長變化結果分析
3.2 免疫組化法檢測TGF-β1及Smad4在大鼠股內側肌的表達空白組大鼠股內側肌內Smad4及TGF-β1呈現低表達狀態,僅有少量區域被染為淡黃色;與空白組相比,模型組和針刺非激痛點組大鼠股內側肌內Smad4以及TGF-β1呈現高表達狀態,存在大量區域被染為棕色或棕黃色,光密度明顯升高(P<0.05)。與模型組相比,針刺激痛點組、電沖擊波組及刺痛點沖擊波結合組Smad4及 TGF-β1 表達明顯下降(P<0.05;P<0.01)。提示采用針刺激痛點聯合電沖擊波干預可降低大鼠Smad4及TGF-β1的表達。見表2,圖1。

注:A:空白組;B:模型組;C:針刺激痛點組;D:針刺非激痛點組;E:電沖擊波組;F:針刺痛點沖擊波結合組圖1 TGF-β1及Smad4免疫組化法檢測結果
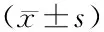
表2 各組大鼠股內測TGF-β1與Smad4的表達
3.3 Smad4及TGF-β1在大鼠海馬中的表達與空白組相比,模型組大鼠海馬中Smad4及 TGF-β1 蛋白表達顯著升高(P<0.01);與模型組組相比,針刺激痛點組、電沖擊波組及刺痛點沖擊波結合組可明顯降低Smad4和TGF-β1蛋白表達(P<0.05)。見表3,圖2。
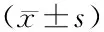
表3 TGF-β1及Smad4在大鼠海馬中的表達

注:A:空白組;B:模型組;C:針刺激痛點組;D:針刺非激痛點組;E:電沖擊波組;F:針刺痛點沖擊波結合組圖2 TGF-β1及Smad4在大鼠海馬中的表達
4 討論
MTrPs的形成和發生過程比較復雜,目前對該疾病有多種假說。其中中樞敏化假說認為,若不能及時對MTrPs進行滅活,會因缺血、缺氧而導致局部刺激物堆積,使神經元附近的傷害感受器被激活,造成脊髓后角神經元池致敏,反復放大神經信號,增強神經元對閾值刺激的反應,進而導致中樞敏化的發生,在骨骼肌的反饋表現即為力學失衡或張力改變[11-13]。海馬是中樞神經系統的重要組成部分,參與對傷害性感受信息(如神經損傷、炎癥等)的加工、修飾及中樞整合。現有研究表明,神經病理性疼痛可導致海馬神經元發生減少、體積縮小、突觸可塑性降低等結構的改變[14]。已有研究發現,在激痛點局部組織處存在缺血、缺氧,且氧適應性、氧耐量明顯降低,從而導致局部內循環灌注不佳情況的發生[15]。目前有研究發現,組織會因為低氧而發生炎癥細胞浸潤、水腫等,促進相關炎癥因子及纖維化因子表達,對纖維細胞分化可起到促進作用[16]。
組織纖維化過程中TGF-β1/Smad信號轉導通路起著重要作用[17]。經臨床證實,對患者進行針刺治療可降低其炎癥因子水平,使IFN-γ水平上調、TGF-β1水平下調對組織纖維化產生抑制作用[18]。目前體外沖擊波主要用于腎結石治療,隨著醫學研究的不斷拓展,體外沖擊波的應用范圍逐漸擴大,在骨折愈合不良、慢性疼痛及肢體康復治療中,因其治療具有無創、操作簡單及不良反應小,其療效逐漸得到臨床認可[19-20]。關于體外沖擊波對MTrPs治療的研究不多,本研究通過觀察不同干預方式下大鼠海馬中Smad4及TGF-β1的表達,分析采用針刺激痛點聯合電沖擊波治療MTrPs的作用機制[21]。
TGF-β1對多種靶基因的表達可起到調節作用,屬于一種多功能多肽,在腸上皮細胞的分化、轉移及增殖等過程中均發揮重要作用,對炎癥細胞可起到趨化作用,促進成纖維細胞增殖分化,在細胞外基質生成過程中同樣發揮著重要作用[22]。TGF-β1 屬于機體內重要的抗炎因子,對所有淋巴細胞的增殖及其功能可起到抑制作用,同時抑制巨噬細胞激活,從而促進組織修復[23]。已有研究證實TGF-β1的抗炎具有雙重作用,在其正常表達狀態下,抑制炎癥及細胞增生,但在其出現過度表達情況時,則可能導致病理性改變,如促進組織纖維化等[24]。Smads蛋白是一種重要的轉導分子,對 TGF-β1 家族信號從受體到核傳遞有著重要的作用,屬于TGF-β1與其受體的重要中介分子,而Smad4是TGF-β1信號傳導必需的中轉分子。已有研究指出,Smad4低表達可對成肌細胞及受 TGF-β1 誘導成肌纖維細胞的纖維化過程起到抑制作用[25]。有研究指出,體外沖擊波所產生的機械效應與中醫推拿相似,可降低肌張力,松懈組織粘連,對微循環起到改善作用,抑制疼痛物質的釋放[11]。沿激痛點傳播方向由沖擊波導致介質出現壓縮與膨脹情況,從而產生機械應力,達到軟組織松懈及彈性變形[26]。體外沖擊波可有效促進局部血管擴張,改善局部組織血液循環,促進新組織形成,有利于肌腱恢復[27]。本研究顯示,針刺激痛點組、電沖擊波組及刺痛點沖擊波結合組的波頻、波幅及波長均顯著降低,同時可顯著下降股內側肌和海馬組織Smad4和TGF-β1的表達,而采用針刺激痛點聯合電沖擊波可有效降低Smad4和TGF-β1表達,從而使激痛點局部纖維得到改善。綜上所述,采用針刺激痛點及聯合點沖擊波進行治療,可降低海馬中Smad4和TGF-β1蛋白表達,分析其可能與針刺MTrPs的鎮痛機制存在相關性。

