原發(fā)性開角型青光眼家系致病基因檢測(cè)及其啟動(dòng)子區(qū)域甲基化的關(guān)系
李思媛 鄭娟 翟玉喜 顧明亮 高建魯
青光眼是一種以視神經(jīng)損傷和相應(yīng)視功能損害為特征的視神經(jīng)疾病,是僅次于白內(nèi)障的致盲性疾病。全球約有6050萬(wàn)原發(fā)性開角型青光眼(primary open-angle glaucoma,POAG)患者,到2020年該病患者的數(shù)量將達(dá)7960萬(wàn)[1]。POAG的發(fā)病機(jī)制目前普遍認(rèn)為是基因與環(huán)境等多種因素相互作用導(dǎo)致的疾病[2]。迄今,通過對(duì)符合孟德爾遺傳的青光眼家系進(jìn)行連鎖分析,定義了20多個(gè)青光眼遺傳位點(diǎn),并鑒定了可能的青光眼致病基因[3]。對(duì)于大多數(shù)青光眼家系,其受累個(gè)體往往在成年后發(fā)病,具有延遲發(fā)病和不完全外顯的特點(diǎn)。通過數(shù)十年模式生物的研究,已經(jīng)證明表觀遺傳機(jī)制對(duì)基因組功能的調(diào)控具有重要作用[4],包括組蛋白轉(zhuǎn)錄后修飾、胞嘧啶(C)甲基化和non-coding RNA的調(diào)節(jié)等[5]。甲基化的特點(diǎn)是DNA 序列不發(fā)生改變的情況下調(diào)控基因的表達(dá),調(diào)節(jié) DNA 重組、保證染色體完整性和某些基因組區(qū)域的轉(zhuǎn)錄活性[6]。本研究通過分析一個(gè)POAG家系,確定其致病基因,并分析基因和表型的關(guān)系,初步探測(cè)基因甲基化修飾對(duì)遲發(fā)性的意義。
資料與方法
一、一般資料
獲得一個(gè)呈孟德爾顯性遺傳模式的POAG家系的血樣本及臨床資料(標(biāo)準(zhǔn)為邯鄲眼科研究標(biāo)準(zhǔn),所有樣本由聊城市人民醫(yī)院提供,研究通過倫理委員會(huì)的審查,所有受試者均簽署知情同意書)。該家系符合“孟德爾遺傳青光眼家系較適合連鎖分析”的要求,共81例,生存78例,其中患者10例(圖1)。
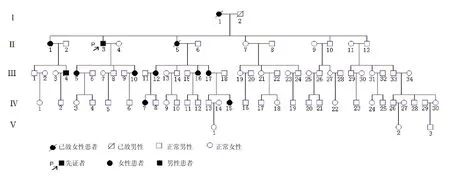
圖1 POAG家系成員組成及受累情況
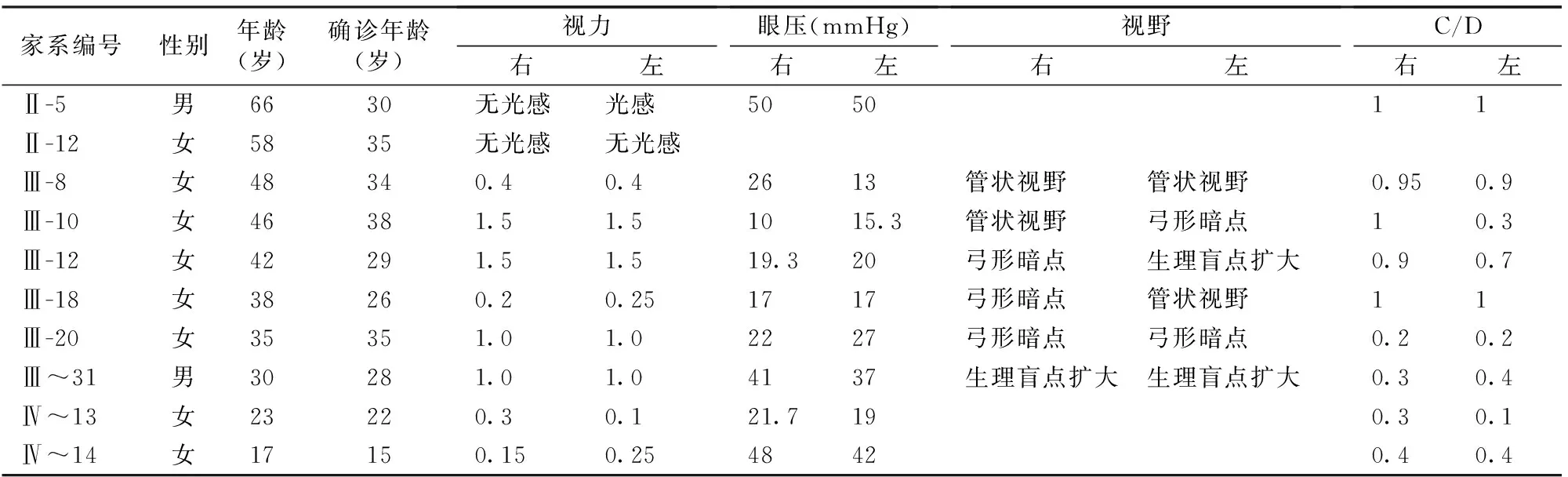
表1 家系部分患者的臨床資料
二、POAG診斷標(biāo)準(zhǔn)
1.有青光眼性視盤損害和(或)視網(wǎng)膜神經(jīng)纖維層缺損;
2.青光眼性視野缺損;
3.前房角開放,具有以上3項(xiàng)并排除繼發(fā)性開角型青光眼。僅眼壓大于21 mmHg(1 mmHg=0.133 kPa)或青光眼激發(fā)試驗(yàn)(如飲水試驗(yàn)和暗室俯臥試驗(yàn))陽(yáng)性應(yīng)診斷為可疑。
三、方法
1.臨床資料收集:詳細(xì)詢問該家系家族史(已故者信息詢問其家庭成員獲得),并進(jìn)行詳細(xì)的眼科專科檢查,包括視力、眼壓、裂隙燈顯微鏡檢查、房角鏡檢查、眼前節(jié)照相、眼底檢查及Humprey視野檢查、海德堡視網(wǎng)膜斷層掃描儀(Heidelberg retinal tomography II,HRT-II)。
2.DNA的提取:抽取家系成員靜脈血5 ml,EDTA抗凝,-4 ℃保存,采用氯仿法提取外周血細(xì)胞DNA,-80 ℃保存。
3.致病基因檢測(cè):對(duì)該家系所有成員進(jìn)行致病基因檢測(cè)。應(yīng)用芯片捕獲測(cè)序技術(shù),捕獲POAG相關(guān)基因所有的外顯子及剪切位點(diǎn),通過高通量測(cè)序檢測(cè)這些基因的突變情況,對(duì)于高通量測(cè)序中出現(xiàn)的可疑致病位點(diǎn),再行Sanger測(cè)序驗(yàn)證。
4.檢測(cè)家系外周血中MYOC甲基化水平:使用MethPrimer http://www.uro-gene.org/methprimer預(yù)測(cè)致病基因啟動(dòng)子CPG島,設(shè)計(jì)甲基化引物,重硫酸鹽處理全基因組DNA,一代測(cè)序檢測(cè)DNA甲基化程度,并行聚類分析。
結(jié) 果
一、家系基本情況
該家系共5代,81人,其中患者12人(已故2人。5代中最年輕的一代尚未出現(xiàn)表型,其余均有患者出現(xiàn),發(fā)病年齡在15~38歲,具有遲發(fā)性特點(diǎn)。
二、家系患者眼部情況及特點(diǎn)
先證者,家系編號(hào)II-3,女,48歲,確診時(shí)間為34歲。間斷降眼壓藥物治療(卡替洛爾滴眼液、布林佐胺滴眼液,2年前加用曲伏前列素滴眼液),眼壓控制欠佳,視野右眼為管狀視野,C/D=1.0,左眼弓形缺損,C/D=0.3。因視野損失逐漸加重,于2017年行雙眼小梁切除術(shù)。部分家系患者現(xiàn)在眼部情況及治療結(jié)果(表1)。
根據(jù)家系成員青光眼確診時(shí)間,考慮為青少年型青光眼,確診時(shí)均行視野檢查,提示有視野缺損,嚴(yán)重者雙眼無(wú)光感;眼壓在多種藥物及手術(shù)和選擇性激光小梁成形術(shù)的控制下,均在正常范圍。隨著年齡增長(zhǎng),家系內(nèi)發(fā)病個(gè)體逐漸增加,表現(xiàn)出一定的遲發(fā)特征。
三、家系致病基因
在rs10911021的位置有一個(gè)與青光眼候選基因重疊的連鎖峰,其LOD值為3.302,NPL值為16.67,位于染色體1q24.2~25.3(圖2),該區(qū)域遺傳距離約14Mb,其中的MYOC為候選致病基因。然后,我們對(duì)該基因進(jìn)行Sanger測(cè)序,在其MYOC G1099A鑒定出致病突變(G367R)(圖3)。
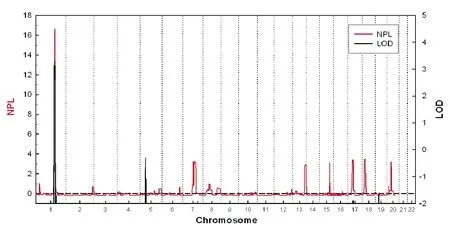
圖2 POAG家系致病基因的染色體定位
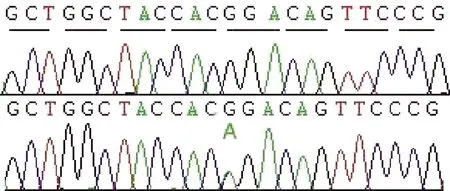
圖3 POAG家系MYOC G1099A突變的測(cè)序峰圖
四、致病基因的甲基化測(cè)序結(jié)果
患者、突變攜帶者及正常者,MYOC 上游0bp至-2000bp 啟動(dòng)子區(qū)內(nèi)F1-R1 CG位點(diǎn)的檢測(cè)如熱圖所示(圖4)。3組甲基化豐度水平的改變,在疾病亞組之間無(wú)明顯差異。
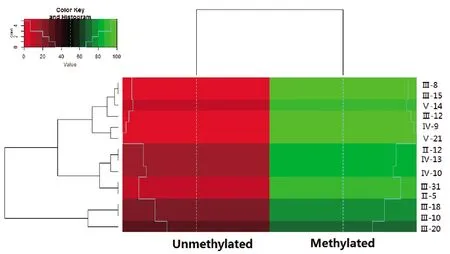
圖4 疾病亞組之間Myoc甲基化聚類
討 論
POAG遺傳背景復(fù)雜,是多基因參與的高度遺傳異質(zhì)性疾病。迄今,通過家系的連鎖研究定義了29個(gè)青光眼遺傳位點(diǎn),并鑒定了12個(gè)可能的青光眼致病基因[7],其中包括MYOC[8]、OPTN[9]、CYP1B1[10]、WDR36[11],ASB10和NTF4等等[12]。隨著基因組技術(shù)的發(fā)展,多個(gè)臨床研究中心通過基因組測(cè)序、外顯子測(cè)序、GWAS 、基因芯片等方法,對(duì)大量的青光眼家系及散發(fā)人群從POAG的內(nèi)在表型、線粒體、小梁網(wǎng)等相關(guān)基因進(jìn)行檢測(cè),又進(jìn)一步發(fā)現(xiàn)了約50個(gè)可能青光眼遺傳位點(diǎn)[13]。但是由于POAG遺傳背景的復(fù)雜性,這些基因的發(fā)現(xiàn)僅解釋了不到10%POAG患者的發(fā)病原因[14],在絕大多數(shù)POAG患者中這些變異都是罕見的。因此,繼續(xù)通過遺傳家系、大樣本及多中心研究進(jìn)行致病基因的篩選、鑒定,敏感位點(diǎn)的定位和功能研究仍然是青光眼領(lǐng)域研究的熱點(diǎn)。
正是這些決定基因的存在,啟動(dòng)一系列下游相關(guān)基因的級(jí)聯(lián)信號(hào)通路,誘導(dǎo)POAG的發(fā)生與發(fā)展。在本研究的家系中,患者攜帶相同致病基因,但發(fā)病年齡存在明顯差異,個(gè)體間發(fā)病年齡的時(shí)間跨度能達(dá)10余年之久,即存在疾病遲發(fā)現(xiàn)象。我們推測(cè)POAG遲發(fā)實(shí)質(zhì)上就是生物進(jìn)化出來的對(duì)環(huán)境適應(yīng)性的表觀響應(yīng)機(jī)制。環(huán)境因素如飲食、肥胖、吸煙、日曬和年齡能引起基因組表觀層面的改變,例如DNA甲基化,組蛋白甲基化,組蛋白乙酰化等。Jünemann 等研究發(fā)現(xiàn)青光眼患者的外周單核細(xì)胞中總的DNA甲基化水平比健康人存在明顯的升高[15]。Fiona等進(jìn)一步利用ELISA方法檢測(cè)人青光眼小梁網(wǎng)細(xì)胞系和正常小梁網(wǎng)細(xì)胞系中總的甲基化水平,發(fā)現(xiàn)人青光眼小梁網(wǎng)細(xì)胞系DNA甲基化水平高。低氧處理正常細(xì)胞系后,會(huì)出現(xiàn)與青光眼細(xì)胞系相似的甲基化與基因表達(dá)結(jié)果。說明低氧環(huán)境可以誘導(dǎo)DNA甲基化水平改變,從而使相關(guān)基因表達(dá)發(fā)生改變,進(jìn)而誘發(fā)青光眼[16,17]。
本研究中我們初步應(yīng)用全基因組甲基化測(cè)序檢測(cè)基因組上的差異甲基化區(qū)域,擬找到受不同環(huán)境因素刺激的個(gè)體間的表觀分子差異。但結(jié)果并不理想,考慮一代測(cè)序的局限性,測(cè)序開始的50個(gè)堿基可能存在序列的錯(cuò)誤,以及樣本量偏少,可能存在偏差。因此,擴(kuò)大樣本量檢查,重新調(diào)整檢測(cè)方法,或得到可觀的效果,而繼續(xù)行青光眼家系的遺傳研究,將有利于POAG復(fù)雜發(fā)病機(jī)制的闡明,而且對(duì)POAG預(yù)防、早期診斷和治療具有潛在的應(yīng)用價(jià)值。

