3,4-裂環羽扇豆烷型三萜化合物及其生物活性研究進展
肖 瑾,肖 珊,羅 姣,魯曼霞,盧茂芳,劉向前
3,4-裂環羽扇豆烷型三萜化合物及其生物活性研究進展
肖 瑾,肖 珊,羅 姣,魯曼霞,盧茂芳,劉向前*
湖南中醫藥大學藥學院,湖南 長沙 410208
3,4-裂環羽扇豆烷型三萜是五環三萜類化合物,在五加屬植物中含量較為豐富。藥理學研究表明該類成分具有廣泛的生物活性,主要包括抗炎、抗菌、抗腫瘤等作用,具有潛在開發應用價值。通過查閱國內外相關文獻報道,從化學結構特征、植物來源和生物活性等方面對天然來源的3,4-裂環羽扇豆烷型三萜類化合物的研究進展進行綜述,以期為此類化合物的進一步研究及五加屬植物藥用資源的合理應用與開發提供參考依據。
3,4-裂環羽扇豆烷型三萜;生物活性;化學成分;藥理作用;五加屬;抗炎;抗腫瘤
羽扇豆烷型三萜的結構類型可分為基本結構、開環、成內酯、降碳和其他類[1]。A環開裂的五環三萜是A環通過天然代謝轉化或人為氧化擴環而形成的一類化合物,A環開環一般發生在2/3或3/4位[2]。已知的天然3,4-裂環羽扇豆烷型三萜類化合物較少,本文對目前為止的國內外相關文獻進行檢索發現共報道39個此類化合物,其中從五加屬植物中得到的共有25個。雖然目前發現的該類化合物數量較少,但研究發現其具有較強的生理活性。
目前,國內外對3,4-裂環羽扇豆烷型三萜類化合物的相關報道,大都集中于此類單體化合物的提取分離、結構鑒定或生物活性等方面的研究,尚未見到關于此類化合物研究現狀的全面綜合報道。因此,本文從植物來源、結構特征和生物活性等方面對3,4-裂環羽扇豆烷型三萜類化合物的研究成果進行綜述,以期為其深入研究提供相關理論依據。
1 3,4-裂環羽扇豆烷型三萜化合物
1.1 結構特征
羽扇豆烷型三萜的骨架類型可裂環化,生成A環開環的羽扇豆烷型三萜,A環開裂一般發生在2/3或3/4位,3/4位裂環羽扇豆烷型三萜比2/3位裂環羽扇豆烷型三萜類化合物更為常見[3]。部分此類化合物在21位存在羥基或酮基取代,當11位有氧取代存在時,A環3位羧基可與11位形成七元環的內酯化合物;28位羧基常與糖結合以皂苷的形式存在,該羧基通常與2個葡萄糖和1個鼠李糖相連;A環3位羧基與11位羥基形成七元環的母核也可以與糖結合形成皂苷[4]。此外,該類型三萜皂苷1位與4位還可形成五元環的氧橋[1]。具體結構見圖1和表1。
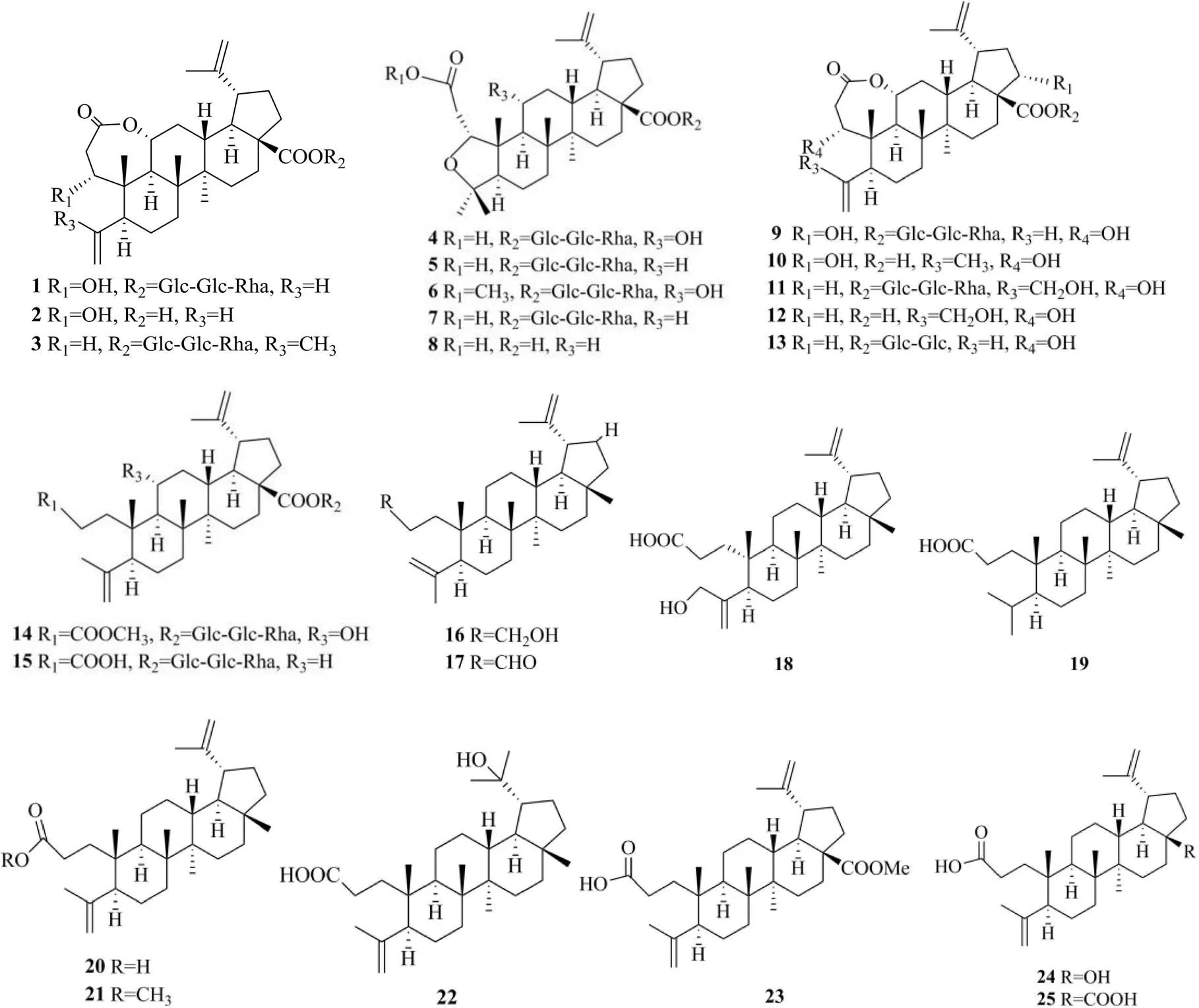

表1 3,4-裂環羽扇豆烷型三萜類化合物

續表1
1.2 植物來源
3,4-裂環羽扇豆烷型三萜類化合物主要分布于五加科五加屬Miq.植物之中,是該屬植物中的特征化合物之一。最先是在.Nakai中發現化合物chiisanoside,后續不斷在多種五加屬植物中發現3,4-裂環羽扇豆烷型三萜化合物的存在[39]。查閱文獻可知,主要從以下五加屬植物中得到該類化合物,如formaHarms、刺五加(Rupr. Maxim.) Harms、智異山五加Nakai、短梗五加(Rupr. Maxim.) Seem.、兩歧五加(Sieb. Zucc.) Seem.、白毛五加var.Yook、var.Yook、formaYook。目前,在其他科屬植物中發現的該類化合物較少,除五加屬外,文獻報道在willd.、Loes.、Merr.、(Thw.) Hook.、Vogel、(Cham.) Müll. Arg.、(Zucc.) Radlk.、Wall. ex Traill、(Lehm.) Mitt、Hook. f.、Chun、K.Koch、G. L. Nesom等非五加屬植物中有發現少量3,4-裂環羽扇豆烷型三萜類化合物的存在[55]。但五加屬植物中3,4-裂環羽扇豆烷型三萜類化合物的數量和含量更多,具體分布情況可見表1。
1.3 Chiisanoside的研究現狀
chiisanoside是從中分離得到的第1個3,4-裂環羽扇豆烷型三萜糖苷[12],其在多種五加屬植物中廣泛存在[6,56],也是目前研究最多的3,4-裂環羽扇豆烷型三萜類化合物之一。楊春娟[16]采用UPLC-ESI-MS/MS法對無梗五加果中的chiisanoside進行含量測定,發現chiisanoside的含量因果實的逐漸成熟而隨之下降,但以其苷元形式存在的chiisanogenin的含量明顯增加,原因是chiisanoside的糖鏈斷裂之后降解為苷元形式的chiisanogenin。本課題組長期以來對大量五加屬植物的化學成分進行研究,已在多種五加屬植物中分離出chiisanoside與chiisanogenin,在課題組以往的文章報道中,劉恒言等[57]對刺五加葉、智異山五加葉、唐五加Makino葉、白毛五加葉、短梗五加葉、異柱五加葉、糙葉五加(Oliv.) Harms葉、民家氏五加f.(Nakai) H. Hara葉、細柱五加W. W. Smith葉、島五加Nakai葉這10種五加屬植物中的活性成分chiisanoside進行含量測定,實驗結果發現在細柱五加葉與島五加葉中未檢測到chiisanoside。劉向前等[58]采用RP-HPLC法對以上同樣的10種五加屬植物葉中三萜chiisanoside和chiisanogenin進行定量分析,發現10種五加屬植物中chiisanoside含量最高的是白毛五加葉,chiisanogenin含量最高的是刺五加葉。戴秀珍[59]采用RP-HPLC法同時測定10種五加屬植物葉中chiisanoside和chiisanogenin的含量,實驗結果與先前研究結果一致,細柱五加葉與島五加葉中不含chiisanogenin與chiisanoside,白毛五加葉中的chiisanoside含量最高,其次為糙葉五加葉,唐五加葉中含量較低;刺五加中的chiisanogenin含量最高,其次為糙葉五加葉。
2 Chiisanoside、chiisanogenin和22α-hydroxy- chiisanoside的生物活性研究
查閱文獻發現,目前對于3,4-裂環羽扇豆烷型三萜類化合物的生物活性研究主要集中于chiisanoside、chiisanogenin和22α-hydroxy- chiisanoside這3個化合物。
2.1 抗菌
Lee等[11]研究了刺五加葉中化合物chiisanogenin和chiisanoside對6種細菌菌株的抗菌活性,研究發現chiisanogenin具有顯著的抗菌活性,最小抑菌濃度為50~100 μg/mL,對革蘭陽性菌、陰性菌均具有抑制作用。
2.2 抗腫瘤
郭雪[60]對chiisanoside的抗腫瘤活性進行研究,發現chiisanoside的抑瘤率伴隨著給藥劑量的增加而升高,具有一定的劑量相關性,能有效抑制腫瘤生長;高劑量組抑制腫瘤生長的效果強于對照組,且對小鼠的肝腎功能沒有損害。給藥后腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)、白細胞介素- 2(interleukin-2,IL-2)及γ-干擾素(interferon γ,IFN-γ)水平提高,血管內皮生長因子被抑制,HE、TUNEL染色結果提示化合物chiisanoside可誘導腫瘤細胞凋亡,作用機制與下調Bcl-2、血管內皮生長因子,上調Bax、Caspase-3及減少腫瘤組織新生血管生成有關。在此基礎上對chiisanoside的藥動學以及組織分布進行研究后發現化合物在大鼠體內能快速吸收,達峰時間較短,迅速消除;主要分布在大鼠的肝臟和小腸,還可透過血腦屏障。Bian等[21]對chiisanoside的抗腫瘤功效進行研究,發現chiisanoside可有效抑制腫瘤細胞生長,且對免疫器官沒有副作用。其抗腫瘤機制可能與其對免疫的調節、抗血管生成以及促進腫瘤細胞凋亡有關。Bae等[31]研究了chiisanoside、chiisanogenin對腫瘤細胞的體外細胞毒性,研究發現chiisanogenin對腫瘤細胞的抑制作用比chiisanoside強。
2.3 抗炎
Won等[14]研究發現chiisanogenin、chiisanoside和isochiisanoside均呈劑量依賴性抑制NO產生;chiisanoside與isochiisanoside呈劑量依賴性抑制前列腺素E2(prostaglandin E2,PGE2)產生。Chiisanogenin對PGE2無明顯抑制作用,22-hydroxychiisanoside對NO、PGE2的產生均無影響。在此基礎上,進一步研究發現chiisanoside對誘導型一氧化氮合酶(inducible nitric oxide synthas,iNOS)、環氧合酶-2(cyclooxygenase-2,COX-2)蛋白,iNOS、COX-2、TNF-α、IL-1β mRNA的表達具有顯著的抑制作用;并能通過抑制核因子κB(NF-κB)易位至核從而阻止NF-κB活化。Chiisanoside抑制脂多糖(LPS)誘導的NO、PGE2、TNF-α和IL-1β產生的作用機制可能與阻斷NF-κB活化以及抑制巨噬細胞中細胞外調節蛋白激酶(extra cellular regulated protein kinases,ERK)、c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)磷酸化有關。Jung等[13]研究發現chiisanoside和chiisanogenin能減輕大鼠類風濕性關節炎,降低C反應蛋白(C-reactive protein,CRP)。此外,Bian等[23]發現chiisanoside的抗炎活性與NF-κB和絲裂原活化蛋白激酶(MAPKs)信號通路的調節有關。
2.4 抗血小板聚集
Jin等[9]以乙酰水楊酸為對照,研究化合物chiisanogenin和chiisanoside對大鼠血小板聚集的抑制作用。研究發現chiisanogenin與chiisanoside均能抑制由二磷酸腺苷、膠原、腎上腺素、花生四烯酸和U46619所誘導的血小板聚集,且抑制活性呈劑量依賴性。chiisanogenin抑制血小板聚集的活性比乙酰水楊酸強。
2.5 降糖
α-葡萄糖苷酶抑制劑具有抑制α-葡萄糖苷酶的活性,可改善糖尿病并發癥的發生與發展[61]。Wang等[10]對chiisanoside和22α-hydroxy-chiisanoside的生物活性進行研究,發現22α-hydroxychiisanoside可有效抑制α-葡萄糖苷酶,以上研究結果表明22α-hydroxychiisanoside可能具有降糖作用。
2.6 保肝
Bian等[23]對chiisanoside的保肝作用進行研究,發現在給予chiisanoside治療后可明顯減輕對乙酰氨基酚(acetaminophen,APAP)誘導的肝組織病理學改變,顯著抑制APAP誘導的IL-6、IL-1β和TNF-α增加,且能抑制NF-κB的抑制蛋白α(inhibitor of NF-κBα,IκB-α)磷酸化和NF-κB p65易位。用chiisanoside預處理可有效改善APAP誘導的ERK1/2、JNK和p38蛋白磷酸化,提示chiisanoside參與抑制MAPK活化。Chiisanoside可預防肝組織損傷,具有肝保護作用,作用機制與其能減輕炎癥反應和抑制氧化應激有關。
2.7 抗抑郁
Bian等[22]通過強迫游泳試驗(FST)和懸尾實驗(TST)評估chiisanoside的抗抑郁作用。結果表明,chiisanoside給藥后可顯著減少FST和TST的不動時間,并未改變自主活動。Chiisanoside還可以有效增加聯合治療組中小鼠大腦的多巴胺和γ-氨基丁酸水平。對LPS誘導的小鼠抑郁樣行為,chiisanoside給藥后可有效降低IL-6和TNF-α的水平;同時,改善了超氧化物歧化酶(SOD)和丙二醛(MDA)等氧化應激相關指標的變化。此外,chiisanoside有效下調了海馬中的腦源性神經營養因子(brain-derived neurotrophic factor,BDNF)、原肌球蛋白相關激酶B(tropo-myosin-related kinase B,TrkB)和NF-κB。對其抗抑郁作用機制的進一步研究表明,chiisanoside可能是通過改變動物行為學、海馬炎癥、氧化應激和神經營養來發揮抗抑郁樣作用,與BDNF/TrkB/NF-κB等途徑有關。
2.8 抗病毒
Bae等[31]測定了chiisanoside及其苷元chiisanogenin兩者的細胞毒性和抗輪狀病毒等生物活性。研究發現將chiisanoside與人腸道細菌共同孵育15 h時,其主要代謝產物是chiisanogenin。Chiisanoside在體外的細胞毒作用低于chiisanogenin,其抗輪狀病毒活性強于chiisanogenin。
2.9 其他作用
Yoshizumi等[56]研究發現chiisanoside可顯著抑制血漿三酰甘油水平的升高,其作用在給藥4 h后最為明顯。Yoshizumi等[17]以大豆皂苷作對照,評估sessiloside 和chiisanoside的溶血活性。結果表明,在劑量為0.2 mg/mL時,只有sessiloside引起輕微的溶血,而chiisanoside則未表現出溶血作用。Jung等[13]研究發現chiisanoside、chiisanogenin 能減輕角叉菜膠大鼠動物模型血漿中的脂質過氧化;同時具有抑制黃嘌呤過氧化酶,升高SOD、谷胱甘肽過氧化物酶及過氧化氫酶的活性。Bae等[31]研究發現化合物chiisanoside和chiisanogenin對β-葡萄糖醛酸苷酶有較弱的抑制作用。Chiisanogenin還能抑制H+/K+-ATP酶。Choi等[62]研究了chiisanoside對骨代謝的影響,結果顯示chiisanoside使堿性磷酸酶(ALP)活性、膠原蛋白含量和礦化結節明顯升高,顯著促進了MC3T3-E1成骨細胞的生長。表明chiisanoside可刺激MC3T3-E1細胞的增殖和分化,具有預防骨質疏松的作用。Kim等[8]研究發現chiisanogenin對晚期糖基化終末產物(advanced glycation end products,AGEs)的形成具有很強的抑制活性。使用50 μmol/L的AGE抑制劑氨基胍(陽性對照藥)治療時,chiisanogenin的抑制活性與之相似,但chiisanoside不具有這種活性。
3 其他3,4-裂環羽扇豆烷型三萜的生物活性研究
Sadhu等[46]研究發現dihydrocanaric acid可有效抑制人宮頸癌HeLa和結腸癌SW480細胞的生長,IC50分別為(32.8±0.7)和(34.1±0.5)μmol/L。裴英鴿[42]發現3,4--lupa-4(23),20(29)-dien-24- hydroxy-3-oic acid對胃癌SGC-7901細胞無明顯抑制作用。He等[48]對dysoxyhainic acid H的抗菌活性進行測定,結果顯示其具有抑制藤黃微球菌和枯草芽孢桿菌的活性,最小抑菌濃度為3.12 μg/mL,對革蘭陽性菌同樣具有抑制作用。Maldonado等[53]研究發現lippiolic acid具有顯著的抗炎作用,其對佛波酯(12--tetradecanoylphorbol-13-acetate,TPA)誘導的小鼠耳腫脹具有抑制作用。Yang等[40]以水楊酸為對照,研究了(1,11α)-1,4-epoxy-11-hydroxy- 3,4-lupane-20(30)-ene-3,28-dioic acid和(1,11α, 22α)-1,4-epoxy-11,22-hydroxy3,4-lupane-20(30)- ene-3,28-dioic acid對大鼠血小板聚集的抑制作用,發現上述2個化合物抗血小板聚集的作用與ASA相似。宋洋等[28]同樣發現以上2個化合物具有顯著的體外抗血小板聚集活性。Lee等[25]發現化合物acanthosessiligenin I、acanthosessilioside A、acanthosessiligenin II、acanthosessilioside B和acanthosessilioside D可有效抑制巨噬細胞中NO的生成,且不影響細胞存活率。杜鵬[39]對(1,11α)-1,4- epoxy-11-hrdroxy-3,4-lupane-20(30)-ene-3,28- dioic acid的生物活性進行測定,結果表明該化合物的抗炎活性呈現出劑量相關性,可有效抑制COX-2與iNOS的基因表達以及炎癥細胞內NO的釋放。Cheng等[50]對3,4--4(23),20(29)-lupadiene-3,28- dioic acid的抗炎活性進行評估,發現其對超氧陰離子的產生具有抑制作用,在1 μmol/L時抑制率可達(86.9±2.8)%;對彈性蛋白酶的釋放同樣具有抑制作用。并且發現該化合物沒有明顯的抗HIV作用,A-結構的存在會降低抗HIV活性。Jiang等[7]研究發現sessiloside和chiisanoside具有較好的體外抑制胰腺脂肪酶的活性。Yoshizumi等[17,56]發現sessiloside和chiisanoside呈劑量相關性抑制脂肪酶的活性,IC50值分別是0.36、0.75 mg/mL。Isochiisanoside、11-deoxyisochiisanoside抑制脂肪酶的活性較弱。
4 結語
3,4-裂環羽扇豆烷型三萜結構新穎,是一類A環3/4位開裂的三萜類化合物,主要分布在五加屬植物中,在大戟屬、美登木屬、球蘭屬等植物中也有分布。其現代藥理作用研究表明部分化合物藥理活性顯著,且具有生物活性多樣性的特點。關于3,4-裂環羽扇豆烷型三萜類化合物的研究尚且處于初期階段,生物活性研究主要集中于單體化合物chiisanoside和chiisanogenin,關于其他單體化合物的生物活性研究相對較少。目前對于3,4-裂環羽扇豆烷型三萜類化合物的研究仍不全面,分離得到的化合物數量有限,部分該類型化合物的藥理作用機制不明確,其潛在藥用價值有待進一步的發掘與運用。因此,對該類化合物的開發與利用需建立在大量基礎性研究之上,應進一步探索新化合物,深入研究其生物活性。對3,4-裂環羽扇豆烷型三萜類化合物進行的全面研究,可豐富羽扇豆烷型三萜類化合物的內容,同時加深對五加屬植物化學成分的認識,為進一步合理開發利用五加屬藥用植物資源提供相關依據。
利益沖突 所有作者均聲明不存在利益沖突
[1] 劉向前, 鄒親朋, 陸昌洙. 天然產物中羽扇豆烷型三萜波譜特征 [J]. 湖南中醫藥大學學報, 2013, 33(9): 10-32.
[2] Yan W Q, Zhang C Z, Li B,. A series of oleanolic acid derivatives as anti-hepatitis B virus agents: Design, synthesis, andandbiological evaluation [J]., 2016, 21(4): 402.
[3] 閔慶喜. 3,4-裂—五環三萜-3,4-內酯的合成及其抗乙肝病毒活性的研究 [D]. 廣州: 南方醫科大學, 2015.
[4] 鄒親朋. 兩種五加屬植物葉中抗HMGB1三萜活性成分研究 [D]. 長沙: 中南大學, 2012.
[5] Park S Y, Chang S Y, Yook C S,. New 3, 4--Lupane-type triterpene glycosides fromforma[J]., 2000, 63(12): 1630-1633.
[6] Jeong M L, Hye M K, Lee S. Quantitative analysis of chiisanoside inspecies by HPLC [J]., 2007, 13(2): 148-151.
[7] Jiang W H, Li W, Han L K,. Biologically active triterpenoid saponins from[J]., 2006, 69(11): 1577-1581.
[8] Kim H Y, Lee D G, Lee K H,. Protective effects of 3,4--lupane type triterpenes fromagainst advanced glycation endproducts [J]., 2012, 53(3): 242-246.
[9] Jin J L, Lee S, Lee Y Y,. Platelet anti-aggregating triterpenoids from the leaves ofand the fruits of[J]., 2004, 70(6): 564-566.
[10] Wang Z B, Jiang H, Xia Y G,. Α-Glucosidase inhibitory constituents fromharm leaves [J]., 2012, 17(6): 6269-6276.
[11] Lee S, Shin D S, Oh K B,. Antibacterial compounds from the leaves of[J]., 2003, 26(1): 40-42.
[12] Hahn D, Kasai R, Kim J,. A new glycosyl ester of a 3,4--triterpene from Korean medicinal plant,(Araliaceae) [J]., 1984, 32(3): 1244-1247.
[13] Jung H J, Nam J H, Choi J,. Antiinflammatory effects of chiisanoside and chiisanogenin obtained from the leaves ofin the carrageenan-and Freund's complete adjuvant-induced rats [J]., 2005, 97(2): 359-367.
[14] Won J H, Park S Y, Nam S G,. Inhibition of lipopolysaccharide-induced expression of inducible nitric oxide and cyclooxygenase-2 by chiisanoside via suppression of nuclear factor-kappaB activation in RAW 264.7 macrophage cells [J]., 2005, 28(10): 1919-1924.
[15] Kasai R, Matsumoto K, Taniyasu S,. 3,4-- Lupane type triterpene glycosyl esters from a Korean medicinal plant,(Araliaceae) [J]., 1986, 34(8): 3284-3289.
[16] 楊春娟. 無梗五加果化學成分分析和chiisanogenin的藥動學研究 [D]. 沈陽: 沈陽藥科大學, 2009.
[17] Yoshizumi K, Hirano K, Ando H,. Lupane-type saponins from leaves ofand their inhibitory activity on pancreatic lipase [J]., 2006, 54(2): 335-341.
[18] 王廣樹, 陳燕萍, 徐景達, 等. 無梗五加葉化學成分的研究 [J]. 中國藥學雜志, 1997, doi: CNKI:SUN:ZGYX. 0.1997-01-003.
[19] 鄭穎. 無梗五加葉化學成分的研究 [D]. 北京: 中國農業科學院, 2012.
[20] Chen C, Zhang D F, Zhao Y,. A new 3,4--lupane triterpenene glycosyl ester from the leaves of[J]., 2020, 34(13): 1927-1930.
[21] Bian X B, Zhao Y, Guo X,. Chiisanoside, a triterpenoid saponin, exhibits anti-tumor activity by promoting apoptosis and inhibiting angiogenesis [J]., 2017, 7(66): 41640-41650.
[22] Bian X, Liu X, Liu J,. Study on antidepressant activity of chiisanoside in mice [J]., 2018, 57: 33-42.
[23] Bian X B, Wang S J, Liu J P,. Hepatoprotective effect of chiisanoside against acetaminophen-induced acute liver injury in mice [J]., 2019, 33(18): 2704-2707.
[24] Ryoo H S, Park S Y, Chang S Y,. Triterpene components from the leaves ofseem [J]., 2003, 34(4): 269-273.
[25] Lee D Y, Seo K H, Lee D S,. Bioactive 3,4-- triterpenoids from the fruits of[J]., 2012, 75(6): 1138-1144.
[26] 安琪. 無梗五加果化學成分及質量控制方法研究 [D]. 沈陽: 沈陽藥科大學, 2009.
[27] 安琪, 楊春娟, 宋洋, 等. 無梗五加果化學成分的研究 [J]. 天然產物研究與開發, 2008, 20(5): 765-769.
[28] 宋洋, 楊春娟, 安琪, 等. 無梗五加果三萜類成分及其活性的研究 [A]. //第二屆中草藥提取關鍵技術與提取物產業應用研討會論文集 [C]. 北京: 中華中醫藥學會, 2009: 171-176.
[29] Shirasuna K, Miyakoshi M, Mimoto S,. Lupane triterpenoid glycosyl esters from leaves of[J]., 1997, 45(3): 579-584.
[30] Matsumoto K, Kasai R, Kanamaru F,. 3,4-seco- Lupane-type triterpene glycosyl esters from leaves ofSeem [J]., 1987, 35(1): 413-415.
[31] Bae E A, Yook C S, Oh O J,. Metabolism of chiisanoside fromvar.by human intestinal bacteria and its relation to some biological activities [J]., 2001, 24(5): 582-585.
[32] Park S Y, Yook C S, Nohara T. A novel 3,4-- migrated-lupane glycoside with a seven-membered B-ring fromvar.[J]., 2001, 42(15): 2825-2828.
[33] Nam S G, Yook C S, Kim I S,. Studies on the constituents of the leaves offorma flavi-flos [J]., 2006, 12(3): 119-121.
[34] Oh O J, Chang S Y, Yook C S,. Two 3,4--lupane triterpenes from leaves ofvar.[J].(Tokyo), 2000, 48(6): 879-881.
[35] 吳高松, 王知斌, 楊春娟, 等. HPLC-ELSD法同時測定無梗五加果中3種3,4-裂環羽扇豆烷型三萜化合物的含量 [J]. 中醫藥信息, 2017, 34(1): 36-39.
[36] 閆兆威. 刺五加果肉化學成分及其藥理活性的研究 [D]. 長春: 吉林大學, 2011.
[37] Yan Z W, Liu J P, Lu D,. A new 3, 4-- lupane-type triterpenoid from the pulp of(Rupr. et Maxim) Harms [J]., 2010, 24(16): 1523-1527.
[38] Lischewski M, Ty P D, Kutschabsky L,. Two 24-nor-triterpenoid carboxylic acids from[J]., 1985, 24(10): 2355-2357.
[39] 杜鵬. 短梗五加果抗炎活性成分及其藥物動力學研究 [D]. 蘇州: 蘇州大學, 2017.
[40] Yang C J, An Q, Xiong Z L,. Triterpenes fromfruits and their antiplatelet aggregation activities [J]., 2009, 75(6): 656-659.
[41] Dallavalle S, Jayasinghe L, Kumarihamy B M,. A new 3,4--lupane derivative from[J]., 2004, 67(5): 911-913.
[42] 裴英鴿. 地錦草化學成分及生物活性研究 [D]. 蘭州: 蘭州大學, 2007.
[43] Pei Y G, Wu Q X, Shi Y P. Triterpenoids and other constituents from[J]., 2007, 54(6): 1565-1572.
[44] Amaral L F G, Leit?o S G, Delle Monache F,. 3,4--Lupanes and other constituents from[J]., 2001, 72(4): 441-443.
[45] Ríos M Y, Ramírez-Cisneros M á, León-Rivera I,. Complete NMR assignment of 3,4--lup-20(29)-en-3- oic acid from[J]., 2012, 50(4): 329-331.
[46] Sadhu S K, Khatun A, Ohtsuki T,. Constituents fromand their cell growth inhibitory activity [J]., 2008, 74(7): 760-763.
[47] Lopes M N, Mazza F C, Young M C M,. Complete assignments of 1H and13C-NMR spectra of the 3,4-- triterpene canaric acid isolated from[J]., 1999, 10(3): 237-240.
[48] He X F, Wang X N, Yin S,. Ring A-triterpenoids with antibacterial activity from[J]., 2011, 21(1): 125-129.
[49] Kennedy M L, Llanos G G, Castanys S,. Terpenoids fromspecies and assessment of their reversal activity against a multidrug-resistantline [J]., 2011, 8(12): 2291-2298.
[50] Cheng Y B, Liu F J, Wang C H,. Bioactive triterpenoids from the leaves and twigs ofand[J]., 2018, 84(1): 49-58.
[51] El-Gamal A A. Cytotoxic lupane-, secolupane-, and oleanane-type triterpenes from[J]., 2008, 22(3): 191-197.
[52] Vazdekis N E J, Chávez H, Estévez-Braun A,. Triterpenoids and a lignan from the aerial parts of[J]., 2009, 72(6): 1045-1048.
[53] Maldonado E, Díaz-Arumir H, Toscano R A,. Lupane triterpenes with a-lactone at ring E, from[J]., 2010, 73(11): 1969-1972.
[54] Bl?s B, Zapp J, Becker H. Ent-clerodane diterpenes and other constituents from the liverwort(Lehm.) Mitt [J]., 2004, 65(1): 127-137.
[55] Baas W J. Naturally occurring-ring-A-triterpenoids and their possible biological significance [J]., 1985, 24(9): 1875-1889.
[56] Yoshizumi K, Murota K, Watanabe S,. Chiisanoside is not absorbed but inhibits oil absorption in the small intestine of rodents [J]., 2008, 72(4): 1126-1129.
[57] 劉恒言, 戴秀珍, 劉向前, 等. 十種五加屬植物葉中化學成分的TLC分析和三萜chiisanoside的HPLC含量測定 [A]. //第三屆中國中藥商品學術年會暨首屆中藥葛根國際產業發展研討會論文集 [C]. 北京: 中國商品學會中藥商品專業委員會, 2012: 112-117.
[58] 劉向前, 戴玲, 戴秀珍. RP-HPLC法同時測定十種五加屬植物葉中三萜chiisanoside和chiisanogenin [J]. 天然產物研究與開發, 2013, 25(1): 71-75.
[59] 戴秀珍. 含chiisanogenin和chiisanoside活性物質的五加屬植物資源的化學篩選 [D]. 長沙: 中南大學, 2011.
[60] 郭雪. 短梗五加葉活性成分chiisanoside抗肝癌作用及其藥動學研究 [D]. 長春: 吉林農業大學, 2017.
[61] 董文婷, 霍金海, 張海燕, 等. 刺五加葉的藥理作用研究進展 [J]. 中國實驗方劑學雜志, 2015, 21(23): 220-223.
[62] Choi E M, Ding Y, Nguyen H T,. Chiisanoside, a lupane triterpenoid fromleaves, stimulates proliferation and differentiation of osteoblastic MC3T3-E1 cells [J]., 2008, 14(1): 1-6.
Advance in 3,4--lupane type triterpenoids and their bioactivity
XIAO Jin, XIAO Shan, LUO Jiao, LU Man-xia, LU Mao-fang, LIU Xiang-qian
School of Pharmacy, Hunan University of Chinese Medicine, Changsha 410208, China
3,4--lupane type triterpenoids are pentacyclic triterpenoids, which are abundant in the plants ofgenus. Pharmacological studies have shown that 3,4--lupane type triterpenoids have a wide range of biological activities, such as anti-inflammatory, antibacterial, and anti-tumor activities. 3,4--Lupane type triterpenoids have potential development and application value. By referring to relevant domestic and foreign literature reports, the research progress of 3,4--lupane type triterpenoids is reviewed in terms of chemical structure, plant origin and biological activities. It provides a reference for further study of 3,4--lupane type triterpenoids and the development of medicinal resources of.
3,4--lupane type triterpenoids; biological activity; chemical component; pharmacological activity;Miq.; anti-inflammatory activity; anti-cancer
R284
A
0253 - 2670(2021)06 - 1834 - 09
10.7501/j.issn.0253-2670.2021.06.033
2020-06-25
湖南省自然科學基金項目(2019JJ40223);湖南中醫藥大學生物工程重點學科資助(校行科字[2018]3號)
肖 瑾,女,在讀碩士,研究方向為中藥及天然藥物活性成分研究。Tel: 18774086049 E-mail: xiaojin9339@163.com
劉向前,男,博士生導師,教授。Tel: 13308439949 E-mail: lxq0001cn@163.com
[責任編輯 王文倩]

