籠養蛋雞關節炎病的診斷
汪 敏 , 徐子恒 , 王 粲 , 梁競臻 , 周辰瑜 , 張遠琴 , 楊耀炎 , 韋 平
(廣西大學養禽與禽病研究所 , 廣西 南寧 530000)
近年來,規模化養雞場發展迅速,但在養殖過程中,雞關節炎病凸顯,盡管該病的死亡率不高,但能導致病雞生長遲緩、生產性能下降、淘汰率增高[1],對養殖場造成巨大的經濟損失。雞關節炎病是一類由病毒、細菌或支原體引起的以關節發炎、腫脹、站立困難、行走障礙等為特征的局部性疾病,主要病原有禽呼腸孤病毒(Avian reovirus,ARV)、金黃色葡萄球菌(Staphylococcusaurous,S.aurous)、沙門菌(Salmonellaspp.)、滑液囊支原體(Mycoplasmasynoviae,MS)等[2-4]。研究顯示[5-6],MS主要以水平傳播的方式導致雞群間感染,病原攜帶雞為主要的傳染源,此外還可經垂直傳播感染下一代,產生病原攜帶者,成為全球家禽養殖業的一種重要的致病性病原體。目前報道的金黃色葡萄球菌和滑液囊支原體混合感染引起的雞關節炎病較為少見,本試驗通過對廣西某蛋雞場關節炎發病雞群進行病原鑒定及對滑液囊支原體陽性樣品進行vlhA基因序列分析和系統進化樹分析,旨在為由葡萄球菌和滑液囊支原體混合感染引起雞關節炎病的診斷和研究提供參考依據。
1 材料與方法
1.1 病料來源 廣西某養雞場有96日齡的海蘭灰蛋雞共50 000只,轉群后不少雞只于90日齡時開始出現關節腫脹、跗關節著地、臥地不起、行動不便等癥狀,且腫脹部位手觸發熱有波動感。每天以0.2%的增長率發病、死亡,淘汰率達0.3%。雞場曾針對雞群發病癥狀投以鹽酸頭孢噻呋和大觀林可霉素,但治療效果不佳。
1.2 主要試劑 革蘭染色液及常規生化試劑盒,均購自廣東環凱微生物科技有限公司;17種常規藥敏紙片,購自杭州微生物試劑有限公司;DNA抽提試劑盒、膠回收試劑盒,均購自北京天根生化科技有限公司;pMD-18T載體,購自TaKaRa;DL-2 000 DNA Marker,購自南京諾維贊生物科技有限公司;DMEM培養基,購自BIOLOGICAL INDUSTRIES;血平板和ddH2O,均由本實驗室制備。
1.3 檢測方法
1.3.1 細菌的分離培養 用無菌接種環分別采集病雞的病變部位、骨髓及關節液,并劃線于血平板上,37 ℃培養24 h,觀察菌落形態。挑取單個可疑菌落進行革蘭染色觀察,并將其劃線于普通營養瓊脂培養基上。
1.3.2 生化鑒定 將上述1.3.1中的分離株接種于生化常規微量鑒定管中,并置于37 ℃培養24~72 h;同時進行血漿凝固酶試驗試管法,置于37 ℃培養24 h后觀察結果。
1.3.3 菌株16S rRNA 序列鑒定 用加熱煮沸法提取上述1.3.1中的菌株DNA并對其進行16S rRNA序列鑒定。引物為16S rRNA基因通用引物,序列為F:5′-AGAGTTTGATCCTGGCTCAG-3′,R:5′-GGTCAGGTTGTTACGACTT-3′。PCR擴增體系:GreenTaqMix 12.5 μL,ddH2O 9.5 μL,上、下游引物各0.5 μL,DNA 2 μL。PCR擴增程序:95 ℃ 預變性5 min;95 ℃ 變性1 min,56 ℃ 退火1 min,72 ℃ 延伸1 min,共35個循環;72 ℃ 延伸10 min。取PCR擴增產物經1.2%瓊脂糖凝膠電泳檢測,再用DNA回收試劑盒進行膠回收。將膠回收產物送至華大基因公司測序。將測序結果上傳至GenBank中進行比對。
1.3.4 細菌的藥敏試驗 從血平板上挑取單個菌落接種于普通營養瓊脂板上37 ℃純化培養24 h,采取K-B紙片擴散法[7]對純化后的分離株進行17種常見抗菌藥的敏感性試驗,并參考美國臨床實驗室標準委員會(CLSI)的標準[8]進行判定。
1.3.5 MS的鑒定及vlhA基因測序 無菌取病雞關節滲出物置于DMEM培養基中,于37 ℃搖床培養24 h,按照DNA提取試劑盒操作步驟提取DNA,并參照Ghaniei[9]建立的MS檢測方法對vlhA基因進行擴增,上游引物序列為F:5′-TACTATTAGCAGCTAGTGC-3′,下游引物序列為R:5′-AGTAACCGATCCGCTTAAT-3′,擴增目的條帶長度約為399 bp。PCR擴增體系為25 μL:上、下游引物各0.5 μL,GreenTaqMix 12.5 μL,DNA 2 μL,ddH2O 9.5 μL。PCR反應條件:95 ℃預變性5 min;95 ℃變性30 s,53 ℃退火30 s,72 ℃延伸30 s,共35個循環;72 ℃延伸10 min。反應產物經1.5%瓊脂糖凝膠電泳檢測并觀察結果。將陽性PCR產物經電泳鑒定后按膠回收試劑盒說明書步驟進行膠回收,將其連接至pMD-18T載體并轉入大腸桿菌DH5α感受態細胞中。最后將篩選出的陽性菌液送至北京華大基因有限公司進行測序。
1.3.6 序列進化樹的構建分析 使用 DNASTAR對測序序列進行編輯以及同源性分析,并將其與 GenBank中參考序列進行比對,進化樹由MAGE 6軟件制作完成。
2 結果
2.1 臨床癥狀 病雞精神沉郁、羽毛蓬亂、消瘦、雞冠蒼白、關節腫大、單側或雙側跛行、無法站立、不愿走動。
2.2 病理變化 剖檢發現病雞跗關節腫脹,大部分病變關節腔內有干酪樣滲出物,少部分病變處有膿液,其他內臟器官無明顯病變。
2.3 血平板分離培養及鏡檢 本試驗的分離株在血平板上生長為濕潤、光滑、圓形、凸起的菌落,菌落較大,且在菌落周圍有β溶血環。革蘭染色后經顯微鏡觀察,只存在藍紫色的球菌,初步確定其為葡萄球菌。5只病雞中有3只分離到葡萄球菌,分離率為60%(3/5)。
2.4 生化試驗 由表1可知,本試驗中分離到的葡萄球菌可發酵葡萄糖、乳糖、甘露醇、山梨醇、蔗糖,對凝固酶、鳥氨酸脫羧酶、賴氨酸脫羧酶呈陽性,不可發酵尿素、木糖醇、衛矛醇、西蒙氏櫞酸鹽、硫化氫。

表1 分離株的生化試驗結果Table 1 Biochemical test results
2.5 16S rRNA鑒定 由圖1可知,分離菌株經16S rRNA 通用引物PCR擴增后,得到1 500 bp左右的條帶。將測序結果與GenBank中已有的金黃色葡萄球菌16S rRNA基因序列進行同源性比對,結果表明,分離到的菌株與參考株金黃色葡萄球菌MK780062.1的同源性相近,為99%,說明本試驗分離得到的葡萄球菌為金黃色葡萄球菌。
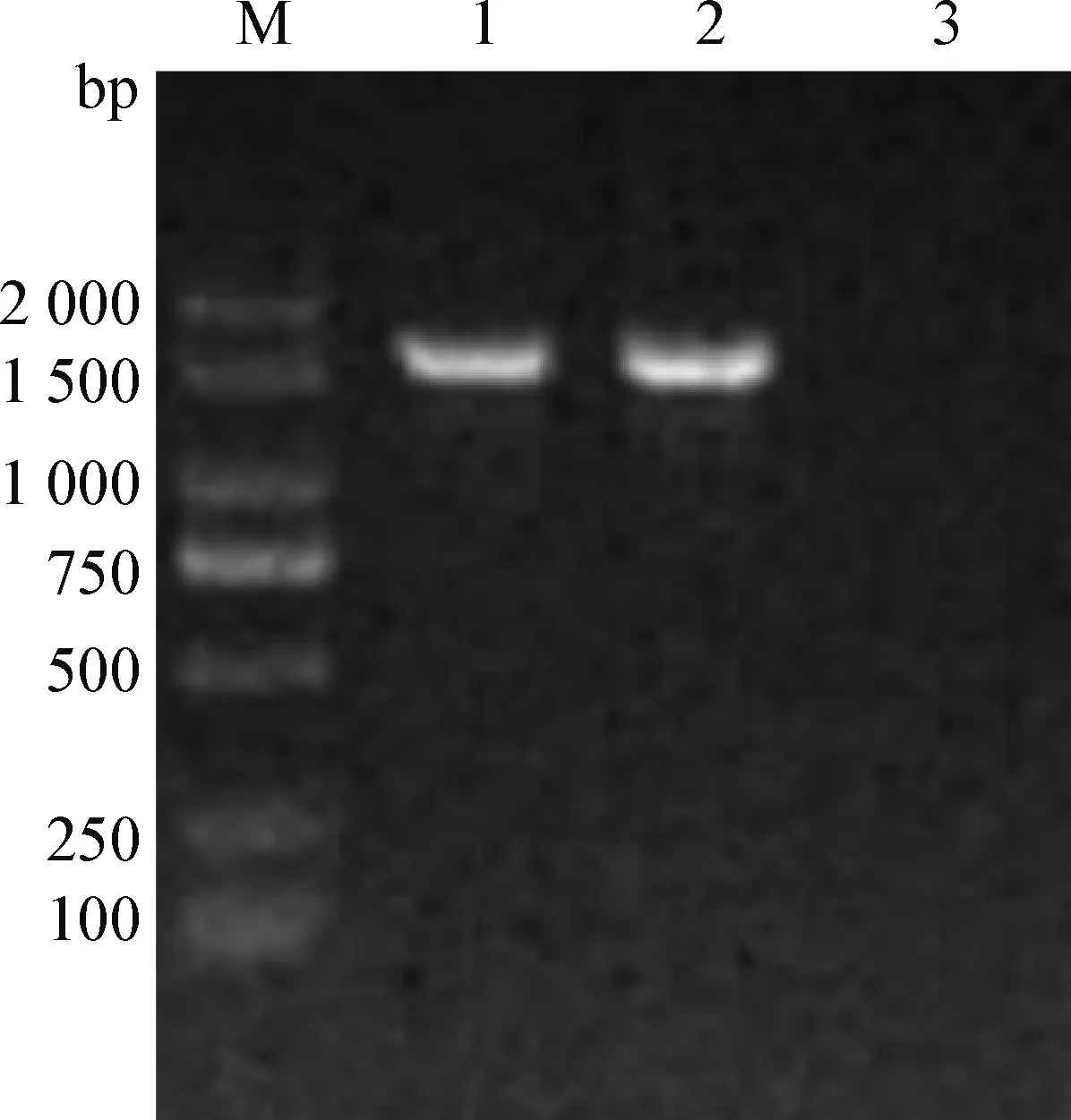
圖1 分離株的16S rRNA PCR擴增結果Fig.1 Results of the 16S rRNA PCR amplification of the isolationM.DL-2 000 DNA 相對分子質量標準; 1:金黃色葡萄球菌; 2:陽性對照; 3:陰性對照M.DL-2 000 DNA marker; 1:S. aurous; 2:Positive control; 3:Negative control
2.6 藥敏試驗 分離株對磺胺異噁唑、復方新諾明、萘啶酸、鏈霉素、四環素均不敏感;對環丙沙星敏感;對阿莫西林、氨芐西林、頭孢曲松、頭孢噻肟、頭孢他啶、甲氧芐胺嘧啶、慶大霉素、卡那霉素、呋喃妥因、氟苯尼考和丁胺卡那等不同類別抗菌藥均表現不同程度的敏感性。
2.7 MS檢測 由表2可知,5份樣品中有4份經vlhA基因PCR擴增出條帶,大小約為399 bp,與預期目的片段大小相符,表明擴增樣品為MS陽性。目的片段測序結果經 MegAlign 分析,顯示其與GenBank中已上傳的 MS 序列的同源性在94%左右,表明該陽性樣品確實為滑液囊支原體。
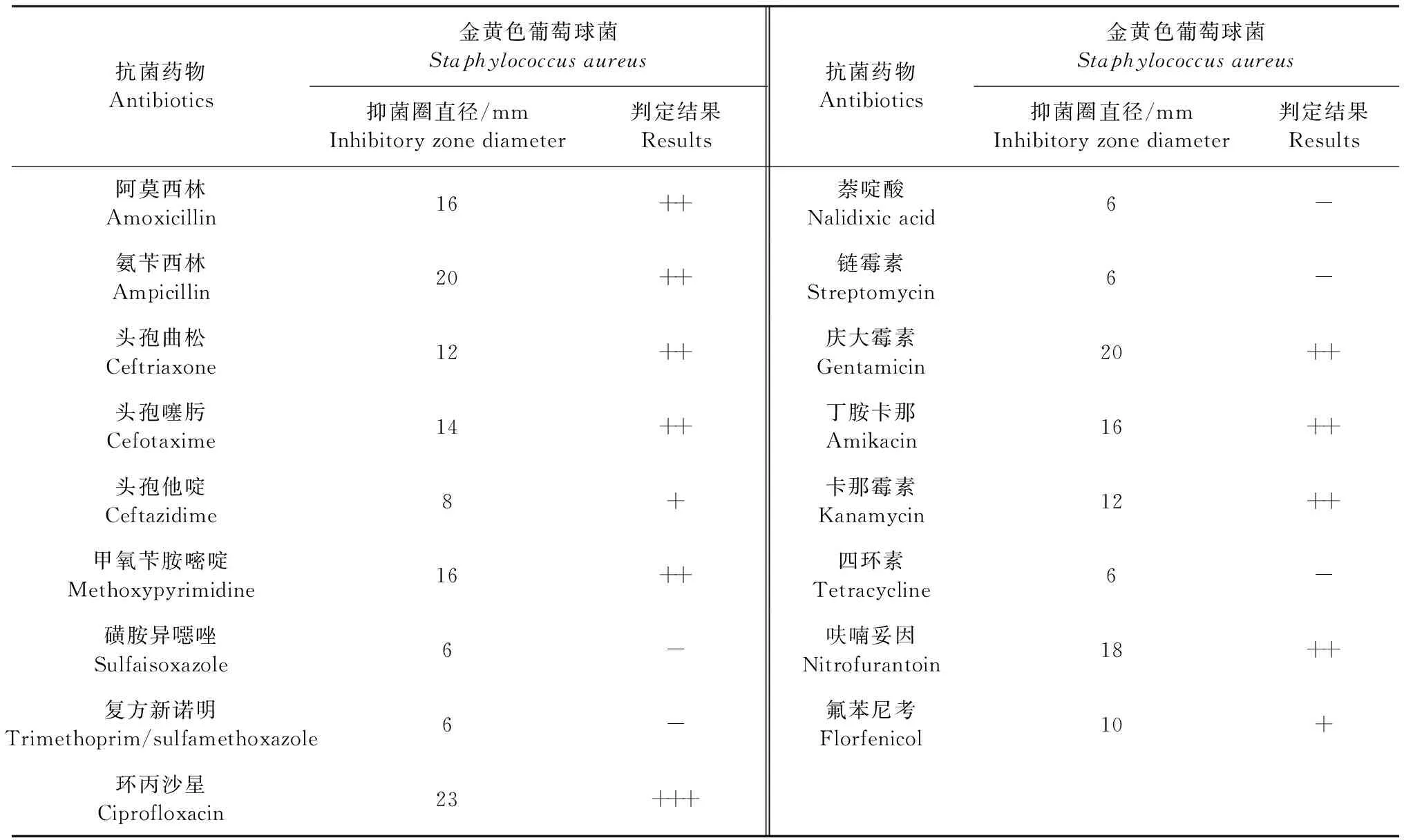
表2 金黃色葡萄球菌藥敏試驗結果Table 2 Results of Staphylococcus aureus to 17 kinds of antibiotics

圖2 MS vlhA基因的PCR檢測結果Fig.2 PCR amplification of MS vlhA geneM:DL-2 000 DNA 相對分子質量標準; 1:MS陰性對照; 2:MS陽性對照; 3~4,6~7:陽性樣品MS引物基因的擴增; 5:陰性樣品MS引物基因的擴增M:DL-2 000 DNA marker; 1:MS negative control; 2:MS positive control; 3-4,6-7:MS gene fragment of positive samples; 5:MS gene fragment of negative samples
2.8 序列分析 由圖3可知,陽性樣品MS-1基于vlhA基因的保守區域的氨基酸殘基與國外參考株存在明顯的遺傳進化差異,與國內的參考株幾乎都處于同一分支上,未呈現出明顯的地域性,除與KU572366株遺傳關系較遠,據悉KU572366株屬于E基因群,而其余國內參考株屬于K基因群。MS-1的序列與MS-H疫苗株序列(CP021129)的遺傳距離遠,處在不同的進化分支上,且CP021129與KU72366株的遺傳關系近。所以可判定本試驗檢測到的MS陽性樣品不是由疫苗株感染所致,且不屬于E基因群。

圖3 基于vlhA基因序列的系統進化發育樹Fig.3 Phylogenetic tree based on vlhA gene sequence▲:本次試驗的測序樣品▲:Sequenced sample in this experiment
3 討論
雞關節炎病是家禽養殖過程中較為常見的疾病之一,威脅著養殖業的健康發展。隨著我國養殖業的發展、養殖水平的提高,由營養因素引起的雞關節炎病較為少見,但由禽呼腸孤病毒、滑液囊支原體、金黃色葡萄球菌、大腸埃希菌、沙門菌等病原單一或混合感染引起的雞關節炎病時有發生[10]。不同病原引起的臨床癥狀也較為相似,但僅憑肉眼無法確定發病病原,因此需依靠實驗室技術進行鑒定。無菌采集病雞的病變部位并進行病原菌的分離鑒定、16S rRNA 基因序列測定和vlhA基因檢測,結果表明該雞場暴發雞關節炎病的原因是由金黃色葡萄球菌和滑液囊支原體混合感染。
金黃色葡萄球菌是一種條件性致病菌,廣泛存在于雞舍地面、空氣等環境中[1,11];同時也是一種人獸共患病原菌,可引起人和多種動物的敗血癥。此外被感染的家禽還可表現關節炎等癥狀,本試驗從病雞的壞死股骨頭部位分離出金黃色葡萄球菌,這與姬忠華等[12]的研究結果相符。此外,創傷感染是金黃色葡萄球菌引起雞關節炎的主要原因[4],同時立體籠養的養殖方式在一定程度上促進細菌在雞體內增殖,造成細菌性股骨頭壞死的發生[13]。結合雞場養殖情況及雞群發病情況可初步判定該雞群感染金黃色葡萄球菌的病程較長。凝固酶是金黃色葡萄球菌的主要致病因子,凝固酶試驗是判定葡萄球是否具有致病性的重要試驗。吳勝等[14]、張曉梅等[15]的研究發現,小鼠腹腔接種金黃色葡萄球菌數小時后逐漸表現出精神不濟、敗血癥等癥狀,隨著病程的發展而死亡,結合本試驗分離獲得的葡萄球菌的凝固酶試驗為陽性,說明該分離菌株具有一定的致病能力。針對金黃色葡萄球菌的治療,目前最好的方法就是使用抗菌藥,但是抗菌藥的過度使用會導致細菌的耐藥性增加,而該發病雞群的葡萄球菌分離菌株對鹽酸頭孢噻呋和大觀林可霉素不敏感,再結合本試驗藥敏結果可知,該分離菌株已產生多重耐藥情況。建議雞場在投喂藥物前,根據藥敏試驗結果合理選擇用藥。本試驗藥敏結果顯示,分離菌株對環丙沙星、氨芐西林等藥物較為敏感,可考慮作為治療該病的首選藥物。
MS主要引起雞和火雞的滲出性滑膜炎、腱鞘炎等。雞群一旦感染MS,便會終生帶菌,可通過蛋源垂直傳播或者接觸污染源水平傳播,且該病發展緩慢,病程較長。結合雞場實際情況,即發病蛋雞是從其他雞場引種過來的、雞場未免疫過疫苗以預防滑液囊支原體病,且vlhA基因序列分析表明該MS陽性樣品與疫苗株親緣關系遠,推斷該雞群在引種前已有部分雞只感染MS,成為病原攜帶雞,再通過污染飼料、飲水等方式傳播該病,造成同群健康雞只感染。目前,我國MS的防治尚未大規模的使用MS疫苗,也尚無有效的特異性治療方式,多以藥物治療和及時淘汰發病雞群為主要手段。通過vlhA基因序列構建進化樹分析可知,我國MS流行株的基因型與其他國家的差異較大,而本試驗中檢測到的陽性樣品MS-1屬于K基因群,屬于國內的流行毒株,可考慮用國內流行血清型毒株制備針對性疫苗進行MS的防治[16]。
綜上可知,該雞群暴發關節炎病的主要原因是在引種前已有部分蛋雞感染MS,再加上轉群過后,雞舍溫度、環境的變化或是工作人員暴力抓雞等因素引起雞群強烈的應激反應,致使機體抗體能力下降,并通過創傷繼發感染金黃色葡萄球菌導致發病。結合雞場的實際情況,建議采取以下幾種方式進行后續防治工作:(1)及時淘汰發病雞群,并進行無害化處理,對暫未發病雞群考慮用血清學檢測的方法淘汰陽性雞,有效控制MS污染;(2)加強飼養管理、提供良好的飼養環境,嚴格執行生物安全管理措施;(3)慎重引種,應從未發生過該病的正規雞場引種(引種前進行血清學檢測);(4)定期對環境進行消毒;(5)針對發病雞群用藥時,應結合藥敏試驗的結果合理用藥,并注意藥物輪換使用,避免產生耐藥菌株;(6)考慮長期投喂具有預防作用的抗菌藥的替代物——益生菌;(7)今后對雞只進行轉群時應做好轉群前的準備,如消毒擬轉入雞舍、準備抗應激藥物等,注意減少抓雞過程的應激,做好轉群后的飼養管理等。

