蒙古櫟體細胞胚胎發生技術研究
李美瑩,李 前,金子涵,劉春萍,陸秀君
(沈陽農業大學 林學院,遼寧 沈陽 110866)
蒙古櫟Quercusmongolica是殼斗科Fagaceae櫟屬Quercus落葉喬木,廣泛分布于寒溫帶、溫帶和暖溫帶[1]。蒙古櫟是國家二級珍貴樹種,同時也是我國東北地區主要的次生林樹種[2]。蒙古櫟具有很高的應用價值,是我國主要的用材樹種之一;也可作為經濟林樹種,木材可用來制作精美的葡萄酒桶[3];同時蒙古櫟種實可提取單寧,具有良好的清熱解毒功效,藥用和食用價值較高[4]。
蒙古櫟生長周期長,結實晚,產量低,種子有大小年,良種匱乏。此外種子貯藏困難,容易受到多種昆蟲侵害,因此蒙古櫟種子園建立較為困難[5]。體細胞胚胎發生是木本植物大規模繁殖的重要方式之一[6],具有繁殖速度快、數量多、能形成完整植株和再生率高等優點[7]。近年來,關于櫟屬植株體細胞胚胎發生的報道有很多,Kim等[8]于1997年首次以生長在韓國的栓皮櫟Quercusvariabilis合子胚為外植體,成功誘導出體細胞胚。張存旭[9]在2003年以陜西省栓皮櫟天然林中的未成熟合子胚為外植體成功誘導出體細胞胚。2009年魏爽[10]以采集于沈陽農業大學天柱山的遼東櫟Q.liaotungensis未成熟合子胚為外植體成功誘導出體胚。廖婧[11]以麻櫟成熟合子胚為外植體成功誘導出體細胞胚。張翠葉[12]以川滇高山櫟Q.aquifolioides未成熟合子胚為外植體成功進行體胚誘導。但目前沒有關于蒙古櫟體細胞胚胎發生形成再生植株及體細胞胚胎發生最佳培養條件的研究報道。
本文對蒙古櫟體細胞胚胎發生進行了初步研究,探究胚性愈傷組織的最佳誘導條件,旨在建立蒙古櫟體細胞胚胎發生體系,獲得蒙古櫟再生植株,為工廠化育苗等提供技術支持和理論基礎。
1 材料與方法
1.1 材 料
2017年、2018年的6月25日至9月10日,分別在沈陽農業大學校園內、遼寧省實驗林場(撫順清原灣甸子鎮)地車溝工區采集優良蒙古櫟植株的未成熟種子。采集的種子放入4 ℃冰箱備用。
1.2 方 法
1.2.1 初代培養
1.2.1.1 最佳取材時間的確定
2018年6月25日至9月10日,每15 d在同一株母樹采集未成熟種子,設置6種取材時間。采集的未成熟種子在流水下沖洗1 h后移至超凈臺。用75%酒精消毒30 s,無菌水沖洗3~5次,然后用0.1%升汞消毒12 min,并不斷地搖動瓶身,使外植體與消毒液充分接觸,最后用無菌水沖洗3~5次,用解剖刀切開種子,將下胚軸及胚根緊貼培養基的方式進行接種。啟動培養基選用MS+瓊脂6 g·L-1+蔗糖30 g·L-1+水解酪蛋白0.5 g·L-1,添加激素2,4-D(0.1、0.5、1 mg·L-1)和6-BA(0、0.5、1、2 mg·L-1)。
1.2.1.2 適宜光照條件的篩選
將上述啟動培養材料分別設置光照培養16 h·d-1(光照強度2 000~3 000 lx)和全程暗培養。
1.2.1.3 種源對體胚誘導的影響
將8月下旬在沈陽農業大學校園內、遼寧省實驗林場(撫順清原灣甸子鎮)地車溝工區采集未成熟蒙古櫟種子,分別標記為種源1、種源2,培養基和培養條件同上。
每種處理接種30個外植體,重復3次。觀察愈傷組織形態并統計胚性愈傷組織的誘導率。
1.2.2 繼代培養
初代培養30 d后,選擇生長旺盛、顏色為乳黃色或乳白色的胚性愈傷組織,進行繼代培養的培養基配比篩選。以MS為基本培養基,添加瓊脂6 g·L-1、蔗糖30 g·L-1、水解酪蛋白0.5 g·L-1,添加NAA (0.1、0.5、1 mg·L-1)和6-BA(0、0.5、1、2 mg·L-1)。每種處理接種30個外植體,重復3次。30 d后觀察胚性愈傷組織增殖情況。
愈傷組織誘導率=(誘導出愈傷組織的外植體數量/接種的外植體總數)×100%
體胚誘導率=(誘導出體胚的外植體數量/接種的外植體總數)×100%
1.2.3 培養條件
培養室溫度(23±2)℃,光照強度2 000~3 000 lx,光照時間16 h·d-1,培養基pH值調至5.8。
1.3 數據處理
使用Excel對所獲得數據進行記錄、統計,使用SPSS Statistics 17.0對數據進行處理,采用Duncan多重比較法進行差異顯著性分析。
2 結果與分析
2.1 取材時間對初代培養的影響
不同取材時間對胚性愈傷組織的誘導存在顯著影響(表1)。總體來看,以7月上旬采集的種子(合子胚大小約10 mm)為外植體,體胚誘導率最高85.7%。7月下旬到9月上旬外植體的體胚誘導率逐漸下降,8月開始產生愈傷組織的時間較長。因此,在體胚誘導過程中外植體應選取7月上旬蒙古櫟未成熟合子胚。
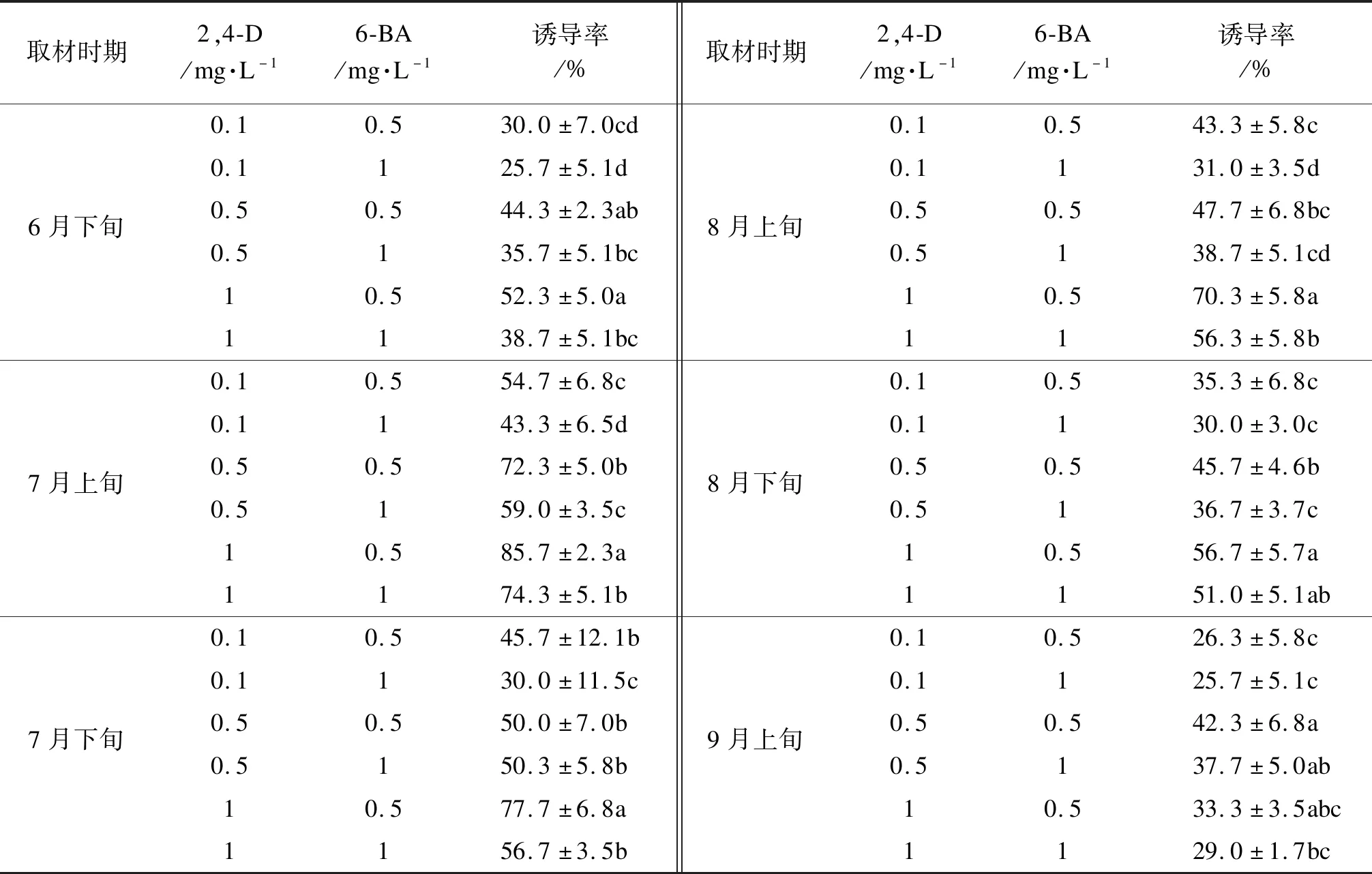
表1 取材時期對體胚誘導的影響
2.2 不同激素配比對初代培養的影響
由表2可知,不同質量濃度激素配比對體胚誘導差異顯著。當只添加2,4-D時,體胚誘導率很低。隨著6-BA質量濃度增加,體胚誘導率顯著提高,但當6-BA質量濃度超過1 mg·L-1時,體胚誘導率開始下降;當2,4-D質量濃度逐漸增加時,體胚誘導率隨之上升。由此可知,添加2,4-D和6-BA可顯著提高體胚誘導率。因此蒙古櫟未成熟合子胚的最佳誘導培養基為MS+2,4-D 1 mg·L-1+6-BA 0.5 mg·L-1+水解酪蛋白0.5 g·L-1,誘導率77.7%。
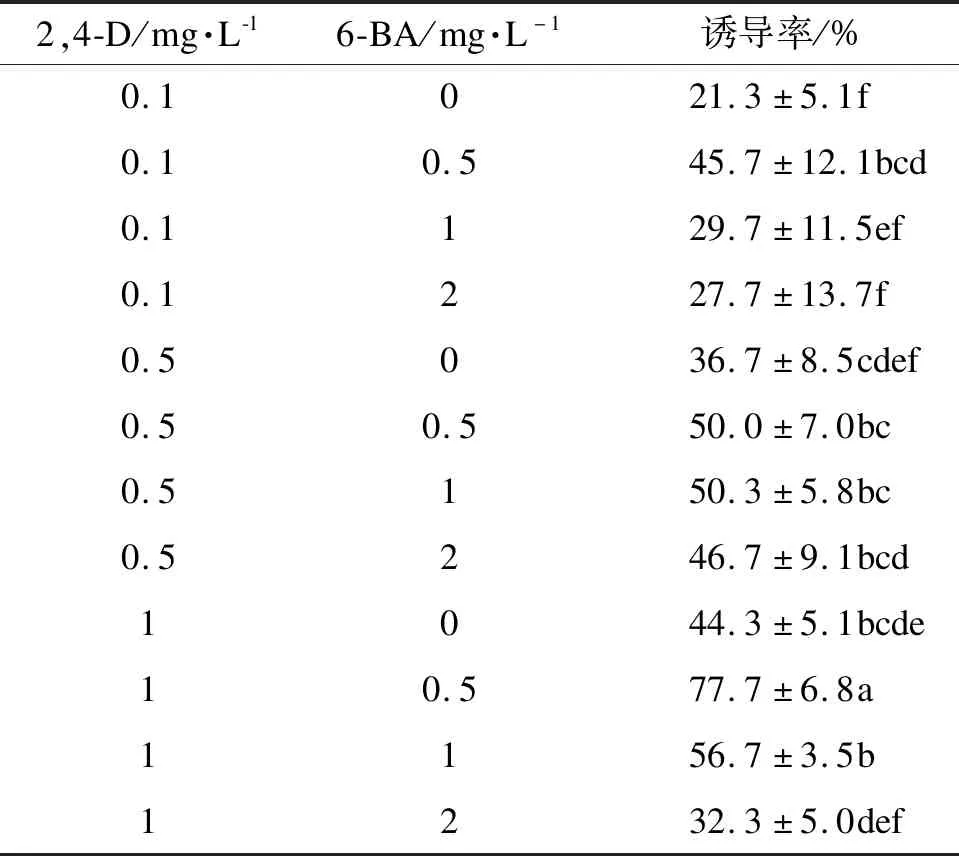
表2 不同激素配比對體胚誘導的影響
2.3 光照條件對初代培養的影響
由圖1可知,蒙古櫟未成熟合子胚誘導出的愈傷組織有兩種狀態:光照培養下(圖1a、b)呈白色團狀,表面滑膩,結構緊密,多數易形成非胚性愈傷組織;暗培養下(圖1c)愈傷組織生長健壯,呈白色顆粒狀,可多次繼代增殖培養。
由表3可知,光照培養的體胚誘導率最高76.7%,暗培養的體胚誘導率最高77.7%,兩者差異不顯著。因此為獲取胚性愈傷組織,應選用暗培養。
2.4 種源對初代培養的影響
不同種源均能誘導出胚性愈傷組織,但誘導率差異顯著(表4)。在激素配比為2,4-D 0.5 mg·L-1、6-BA 1 mg·L-1的條件下,種源2的誘導率最高49%,且高于種源1;其余3種處理下,種源1的誘導率均高于種源2,且2,4-D 1 mg·L-1、6-BA 0.5 mg·L-1的誘導率最高56.7%。由圖2可知,種源對愈傷組織的狀態也存在影響,種源2的未成熟合子胚(去子葉)在培養過程中容易褐化(圖2 a),繼續培養容易變成結構緊密的非胚性愈傷組織(圖2 b)。

注:a光照培養條件下愈傷組織結構緊實;b光照培養條件下愈傷組織表面滑膩;c黑暗培養條件下愈傷組織顏色為白色,呈現出顆粒狀,結構松散。
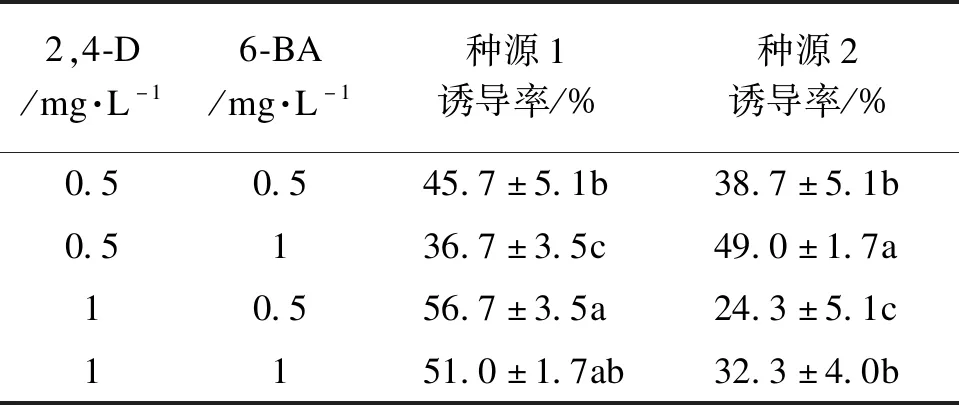
表4 不同種源對體胚誘導的影響
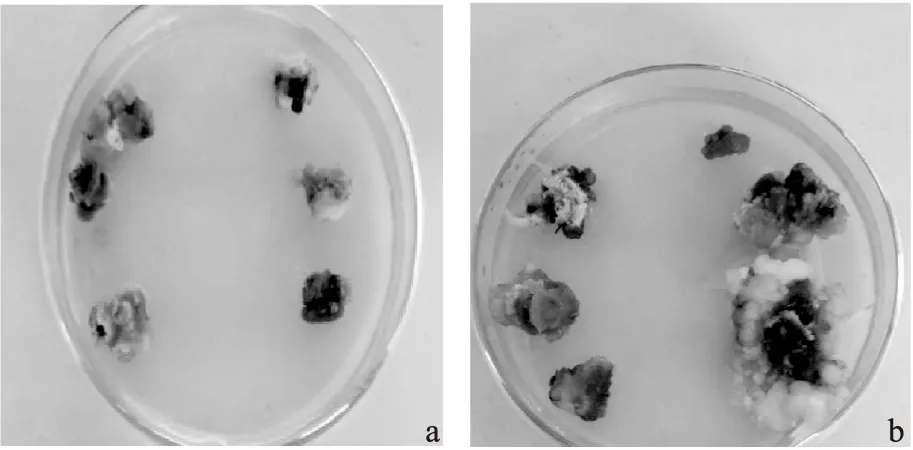
注:a種源2未成熟合子胚誘導的愈傷組織;b經過繼代的種源2的未成熟合子胚誘導的愈傷組織。
2.5 不同激素配比對繼代培養的影響
從表5可以看出,在NAA 0.5 mg·L-1、6-BA 0.5 mg·L-1的激素配比下,培養14 d即可在白色顆粒狀愈傷組織(圖3 a)和褐色顆粒狀愈傷組織(圖3 b)的表面觀察到白色透明、大小不一的球形胚(圖3 c、d),培養至第4周左右球形胚繼續生長發育變大、變多(圖3 e、f),且體胚增殖率最大72.3%。當激素質量濃度過高時,在繼代培養過程中容易變為白色或褐色緊實結構(圖3 i)的非胚性愈傷組織,在培養過程中不能繼續分化出球形胚(圖3 h)。
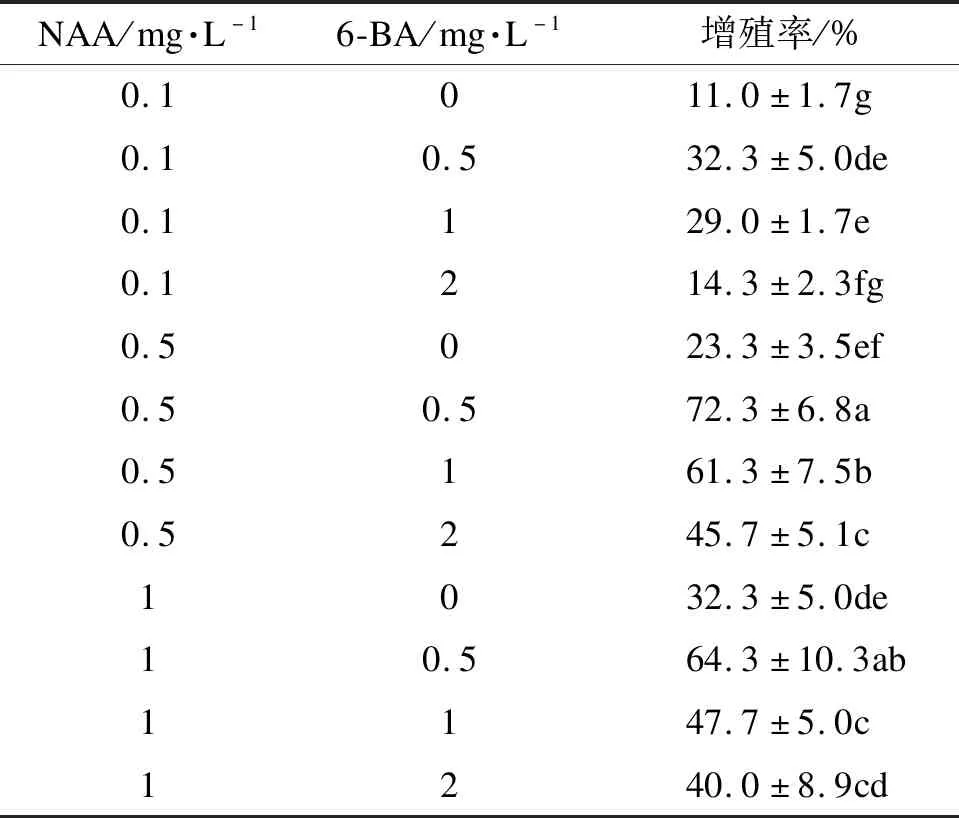
表5 NAA、6-BA對體胚增殖率的影響
3 結論與討論
7月上旬是蒙古櫟未成熟合子胚初代培養的最佳取材時期。最佳初代培養基為MS+2,4-D 1 mg·L-1+6-BA 0.5 mg·L-1+水解酪蛋白0.5 g·L-1,誘導率85.7%。取材時間對胚性愈傷組織的誘導有顯著差異;光照條件對胚性愈傷組織的誘導差異不顯著,但暗培養下生長健壯,可多次培養。不同種源對胚性愈傷組織的誘導率有顯著差異。最佳繼代培養基為MS+NAA 0.5 mg·L-1+6-BA 0.5 mg·L-1+水解酪蛋白0.5 g·L-1,增殖率72.3%,且培養4周是最佳培養時間。

注:a白色顆粒愈傷組織上誘導出的球形胚;b褐色愈傷組織上誘導出的球形胚;c繼續培養白色顆粒愈傷組織上大小不同的球形胚;d繼續培養褐色愈傷組織上大小不同的球形胚;e球形胚聚集現象;f培養4周左右白色顆粒愈傷組織上誘導出的球形胚;g培養6周左右球形胚停止生長發育;h高濃度激素培養下產生的非胚性愈傷組織;i褐色團狀非胚性愈傷組織。
影響蒙古櫟體胚誘導的原因諸多,如外植體、外源激素類型及配比、基因型以及培養環境等。本文主要研究了種源、未成熟合子胚取材時間、外源激素配比和光照條件對胚性愈傷組織誘導的影響。植物激素是體胚誘導過程中關鍵的因素,由于2,4-D是體胚發生過程中的重要激素,可單獨使用也可配合細胞分裂素使用,所以大多數植株在誘導胚性愈傷組織時會選用2,4-D[13]。張濤[14]在研究蕓芥Erucasativa體細胞胚胎發生時發現,添加2,4-D的培養基誘導蕓芥胚性愈傷組織的效果最佳,且2,4-D質量濃度過高或過低都不利于體胚發生或增殖。6-BA屬于細胞分裂素,誘導速度快,誘導率高,單獨使用時多以直接體胚發生為主。張存旭[15]在栓皮櫟體胚誘導研究中同時加入NAA和6-BA兩種激素,愈傷組織質地較好且多為胚性組織。本研究選擇2,4-D和6-BA配合使用,以間接體胚發生,能顯著提高胚性愈傷組織誘導率。成功誘導胚性愈傷組織后繼代增殖,用NAA[16]代替2,4-D,并適當降低質量濃度,成功誘導出球形胚,這與魏爽[10]在遼東櫟體胚增殖階段的結果一致。但后續隨著繼代增殖次數增多,胚性愈傷組織的胚性能力下降,這與阿拉伯橡膠樹[17]體胚發生過程得出的結論非常相似。在今后的實驗研究中,應重點探究如何保持愈傷組織胚性并及時剔除非胚性愈傷組織,在愈傷組織胚性活力較強時轉入合適的體胚誘導培養基中[18]。
一般來說,分化程度低的組織更利于體胚誘導。研究表明,合子胚是誘導植物體胚發生最理想的材料,合子胚的取材時間對體胚誘導存在一定的影響。楊玲等[19]在研究花曲柳體胚誘導中發現,未成熟合子胚的體胚誘導率明顯高于成熟合子胚。本研究表明,取材時期不但會影響誘導率,還會影響愈傷組織的質地。從實驗數據來看,7月上旬的體胚誘導率最高,該時期的外植體為未成熟合子胚,8月至9月上旬合子胚逐漸成熟,體胚誘導時間變長且誘導率逐漸下降,這與姚增玉[20]在栓皮櫟體細胞胚胎發生研究的結果一致。此外本研究發現種源對體胚誘導影響差異顯著,可見基因型對體胚誘導的重要性。
光照條件對于體胚發生也有顯著影響,且不同植株對于光的敏感性也不同。有些植株在體胚誘導過程中需要光照,如青岡櫟Cyclobalanopsisglauca在體胚誘導時,只能在光下進行,移至黑暗處則不再形成體胚[21]。而北美鵝掌楸Liriodendrontulipifera胚狀體在黑暗條件下發育健壯,在光下多形成畸形胚,且生長緩慢[22]。本研究中光照條件對體胚誘導率影響不顯著,但是在暗培養下愈傷組織生長更健壯,能長時間保持新鮮,而光下培養的愈傷組織容易發生褐化,多次繼代后易形成非胚性愈傷組織。但本研究在繼代增殖過程中只誘導出球形胚,對于繼代增殖的研究還有待于進一步完善。

