miR-30a-5p通過調節靶基因ARG1對急性缺血性腦卒中免疫應答的影響
岳岑
(廈門大學附屬第一醫院神經內科,福建 廈門 361000)
急性腦缺血發生時,外周血中相關分子參與了腦卒中的病理生理過程[1]。中樞神經系統的局部損傷會誘導血源性炎癥細胞激活,產生并釋放促炎因子和趨化因子。激活的白細胞浸潤缺血的大腦,加重炎癥程度,最終導致神經元死亡[2-3]。但缺血性腦卒中如何改變外周血的急性免疫反應,并導致腦損傷的分子機制仍未完全了解。多項微陣列研究[4-5]發現,缺血性腦卒中外周血存在明顯的基因組改變,外周血基因組分析有利于了解腦卒中病理生理過程的分子機制。MicroRNAs(miRNAs)是基因表達的主要內源性調節因子,與其靶基因的3’端非編碼區結合(3’-UTR),從而抑制或激活靶基因表達[6-7]。目前,已超過2 000種人類miRNAs被鑒定,約有30%的基因可能受到miRNAs的調控[8]。研究[9-10]表明,miRNAs在腦缺血事件中,特別是再灌注階段在大腦和外周血均有明顯變化,如miR-186-5p、miR-19a-3p、miR-32-5p、miR-30a-5p、miR-579-3p等在急性腦卒中中存在異常表達。本研究根據文獻和相關數據庫初步篩選8個候選miRNAs[9-10],采用RT-qPCR進一步驗證其在急性腦卒中患者中的表達情況及其對靶基因的調控作用,望為了解腦損傷的分子機制提供新的參考。
1 資料與方法
1.1 一般資料
本研究方案經廈門大學附屬第一醫院倫理委員會批準,受試者或監護人簽署知情同意書。選取2017年3月至2020年3月廈門大學附屬第一醫院收治的急性缺血性腦卒中患者60例為病例組。其中,男性34例,女性26例;平均年齡(61.53±6.71)歲;入院時NIHSS評分中位數為2分;病因包括大動脈粥樣硬化性腦卒中(LAA)、小動脈閉塞性腦梗死或腔隙性腦梗死(SAO)、心源性腦栓塞(CE)等;TOAST分型中,LAA 18例、SAO 30例、CE并SAO 12例。納入標準:(1)符合全國腦血管病學術會議制定的急性缺血性腦卒中診斷標準[11];(2)患者均為首次發病,并于發病24 h內入院;(3)經頭顱CT/MRI確診為腦梗死。排除標準:(1)腦出血或顱內出血,短暫性腦缺血發作;(2)腫瘤患者;(3)嚴重肝腎系統疾病者;(4)合并感染、免疫類疾病者。另選取60名同期體檢健康者作為對照組,其中男性31例,女性29例;平均年齡(60.56±5.87)歲;既往無神經系統疾病史、腫瘤病史、嚴重肝腎系統疾病及感染或免疫類等疾病。病例組和對照組性別、年齡、體質指數(BMI)、受教育年限、吸煙、飲酒情況等一般資料比較,差異無統計學意義(P>0.05),而高血壓、高血脂和冠心病差異有統計學意義(P<0.05)。見表1。
1.2 方法
1.2.1 RT-qPCR檢測miRNAs的表達水平 (1)miRNAs的篩選:根據文獻和相關數據庫初步篩選出8個候選miRNAs,分別為miR-186-5p、miR-19a-3p、miR-32-5p、miR-30a-5p、miR-579-3p、Let-7e、miR-362-3p、miR-1238-5p。(2)外周血采集和提取總RNA:抽取病例組在入院24 h內靜脈血5 mL,取樣時間為癥狀出現后13.5 h,IQR (10~18.0 h);對照組抽取體檢當天靜脈血5 mL。樣本置于EDTA抗凝管中,立于冰上30 min后,吸出上清。10 000 g離心5 min,棄沉淀。取上清保存于-80 ℃冰箱備用。miRcute血清/血漿miRNA提取分離試劑盒(DP503,天根生化,中國)提取總RNA,操作按說明書進行。用Nanodrop光譜儀(Thermo Fisher Scientific,Waltham,MA,USA)檢測RNA純度和濃度。使用逆轉錄系統將RNA反向轉錄為cDNA(Thermo Scientific,CA,USA),并保存-80 ℃冰箱備用。(3)RT-qPCR:采用CFXTM實時系統(Bio-Rad,CA) 和PCR 2 x SYBR qPCR Mix試劑盒(北京中曼生物技術有限公司)檢測miRNA的水平,擴增體系如下:PCR反應包含2 μL cDNA、0.4 μL正向引物、0.4 μL反向引物、7.2 μL H2O2和10 μL SYBR;擴增條件為25 ℃,10 min,48 ℃,30 min,95 ℃,5 min,U6作為內參基因,每個樣本檢測三次。采用2-ΔΔCt法分析miRNA表達情況[12],首先計算出每個樣品內參基因的表達量ΔCt,再計算對照組中ΔCt的均值,用觀察組每個樣品的ΔCt減去對照組的ΔCt均值,得到ΔΔCt,采用2-ΔΔCt公式計算出觀察組的表達量。miRNAs引物及擴張片段大小如下:miR-186-5p(22bp):F:5’-CAA AGA AUU CUC CUU UUG GGC U-3’,R:5’-GTG CGT GTC GTG GAG TCG-3’;miR-19a-3p(23bp):F:5’-UGU GCA AAU CUA UGC AAA ACU GA-3’R,5’-GTG CGT GTC GTG GAG TCG-3’;miR-32-5p(22bp):F:5’-UAU UGC ACA UUA CUA AGU UGC A-3’,R:5’-GAA TAC CTC GGA CCC TGC-3’;miR-30a-5p(22bp):5’-CTC AAC TGG TGT CGT GGA GT-3’,R:5’-TGG TGT CGT GGA GTC G-3’;miR-579-3p(23bp):F:5’-UUC AUU UGG UAU AAA CCG CGA UU-3’,R:5’-GAG CAG GGT CCG AGG T-3’; Let-7e(22bp):F:5’-UGA GGU AGG AGG UUG UAU AGU U-3’,R:5’-AGA GCC ACA GTC CTC TTT GC-3’;miR-362-3p(22bp):F:5’-AAC ACA CCU AUU CAA GGA UUC A-3’,R:5’-CGG CAC TGG ATA GAG ATG CG-3’;miR-1238-5p(23bp):F:5’-GUG AGU GGG AGC CCC AGU GUG UG-3’,R:5’-AGG CAC GGT GTC AGC AGG C-3’;U6 F:5’-CGC AAG GAT GAC ACG CAA ATT CG-3’,R:5’-AAC GCT TCA CGA ATT TGC GT-3’。

表1 兩組一般資料比較
1.2.2 細胞培養與細胞轉染 人急性原髓細胞(HL-60,韓國細胞庫,韓國)在24孔培養皿中以8×105個細胞/mL的密度培養。細胞均置于DMEM培養基中,輔以10%胎牛血清(FBS;Thermo Fisher Scientific,Inc.,Waltham,MA,USA)、100 U/mL青霉素和100 μg/mL鏈霉素在37 ℃、5% CO2飽和濕度的培養箱培養。以1×106個細胞/mL的密度在含有500 nM的維甲酸[13](ATRA,Sigma,MO)培養基中培養5 d以分化中性粒細胞。使用中性粒細胞明膠酶相關脂質運載蛋白(NGAL)免疫細胞化學試劑盒(Abcam,Cambridge,UK)評估中性粒細胞分化情況。將miR-30a-5p模擬物處理小鼠巨噬細胞(RAW 264.7,ATCC,VA),并檢測ARG1表達和一氧化氮(NO)含量[14]。RAW 264.7在含有10%胎牛血清的DMEM高糖培養基(Welgene,Daegu)、100 U/mL青霉素和100 μg/mL鏈霉素中培養。將密度達到1×106cells/mL的RAW 264.7細胞接種于75-T的培養瓶中于37 ℃、5% CO2飽和濕度的培養箱培養。miR-30a-5p模擬物(miR-30a-5p,5’-UGUAAACAUCCUCGACUGGAAG-3’)和miR-30a-5p陰性對照(NC,5’-ACAUCUGUAACUUGUAG- 3’)購自上海基因制藥有限公司,根據使用說明,取對數生長期的HL-60 或RAW264.7細胞接種于6孔板中,用含10%胎牛血清的DMEM培養液培養細胞,當細胞達60%融合時,采用Lipofectamine 2000 (Thermo Fisher Scientific,Inc.)將miR-30a-5p模擬物、陰性對照模擬物或mock轉染(空白對照)到HL-60 或RAW264.7細胞中,轉染48 h后,分離細胞裂解液。
1.2.3 miRNAs靶基因的預測 采用miRBase(http://www.mirbase.org/),Target Scan(http://www.targetscan.org/vert_72/)和MicroCosm Target(http://www.ebi.ac.uk)預測miRNAs的靶基因。查詢與急性腦卒中病理生理學相關的靶基因,在選擇miRNAs和靶基因后,對其進行功能研究,以檢查所選擇的miRNAs是否真的與預測靶點結合。
1.2.4 雙熒光素酶報告分析 將對數生長期的HL-60細胞接種到24孔板中(每孔1×103個細胞),待細胞達到60%融合時,將miRNA模擬物和陰性對照分別與靶基因 3’UTR野生型或突變型重組質粒共轉染。轉染48 h后,使用Renilla luciferase報告基因(pRL-CMV;Promega公司,美國威斯康星州麥迪遜市)檢測熒光素酶活性,操作按試劑盒(Promega公司)說明書進行。
1.2.5 RT-qPCR檢測外周血ARG1 mRNA 采用SuperScript? II First-Strand Synthesis System (Invitrogen,CA)對樣本總RNA進行反轉錄。使用CFXTM實時系統(Bio-Rad,CA)和Quantiect? SYBR Green PCR 試劑盒(Qiagen,CA)定量分析ARG1 mRNA表達情況,β-actin作為實驗內參,采用2-ΔΔCt法計算表達水平。RT-qPCR引物如下:ARG1(1.4kb) F: 5’-TCT GTG GGA AAA GCA AGC GA-3’,R:5’-TTG CCA AAC TGT GGT CTC CG-3’;β-actin: F:5’-GAT CAT TGC TCC TCC TGA GC-3’, R:5’-ACT CCT GCT TGC TGA TCC AC-3’。
1.2.6 Western blot 采用RIA裂解緩沖液(PRO-PREPTM,iNtRON Biotechnology,Korea)和蛋白酶抑制劑(Roche,中國)提取轉染后HL-60細胞系所用總蛋白。使用BCATM蛋白分析試劑盒(Pierce,美國)對蛋白進行定量分析。取相同量總蛋白上樣,經10% SDS-PAGE分離并轉移到PVDF膜上,在37 ℃下用5%脫脂乳封閉1 h,加入一抗(兔抗人ARG1濃度1∶1 000,β-actin濃度1∶1 000)在4 ℃下孵育過夜,隨后,將PVDF膜用TBS洗滌3次,10 min/次。加入羊抗兔二抗(1∶2 000)室溫孵育2 h,TBS洗滌3次,10 min/次。采用Fusion FX5圖像分析系統進行分析。
1.2.7 NO測定 RAW264.7細胞轉染24 h后,對NO進行測定。轉染后,用含脂多糖的新鮮培養基對細胞進行進一步處理(LPS)200 ng /mL,分別孵育0、6、24或48 h。在每個時間點收集3 mL培養基。根據制造商的說明使用Griess檢測試劑盒(Promega,WI)在每個時間點測量NO含量。
1.3 統計學分析
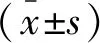
2 結果
2.1 兩組miRNAs表達水平比較
病例組和對照組miR-186-5p、miR-19a-3p、miR-32-5p、miR-362-3p和miR-1238-5p表達水平比較,差異無統計學意義(P>0.05),而miR-30a-5p、miR-579-3p和Let-7e表達水平有明顯差異(P<0.001)。見表2。

表2 兩組miRNAs表達水平比較
2.2 雙熒光素酶報告基因檢測結果
通過取交集分析發現,miR-579-3p和Let-7e沒有合適的關于急性腦卒中病理生理學及免疫調節相關的靶基因,而miR-30a-5p潛在靶基因是ARG1。ARG1由巨噬細胞產生,在炎癥反應中發揮抗炎作用,在腦卒中誘導的外周免疫反應中發揮重要作用。生物信息學預測顯示,ARG1基因的3’端非編碼區(3’UTR)包含了一個miR-30a-5p靶序列,見圖1A。在HL-60細胞系中,雙熒光素酶報告基因檢測miR-30a-5p組雙熒光素酶相對活性明顯低于NC組(P<0.05),證實ARG1是miR-30a-5p的直接靶點,見圖1。

2.3 miR-30a-5p對ARG1的調節作用
RT-qPCR檢測表明,與病例組外周血ARG1 mRNA表達水平比較,對照組明顯升高(P<0.05),見圖2A。miR-30a-5p模擬物轉染24 h后,RT-qPCR結果顯示,ARG1 mRNA表達水平較mock和NC組明顯降低(P<0.05),見圖2B。Western blot結果顯示,miR-30a-5p模擬物轉染24 h后ARG1蛋白表達水平較mock和NC組明顯降低(P<0.05),見圖2C。

2.4 miR-30a-5p對RAW 264.7細胞系中ARG1蛋白的表達和NO的調節作用
Western blot分析表明,miR-30a-5p模擬物轉染RAW264.7細胞24 h后, ARG1蛋白表達水平較mock和NC組明顯降低(P<0.05),見圖3A。另外, miR-30a-5p對LPS處理后的RAW 264.7細胞48 h后,miR-30a-5p模擬物組NO水平較mock和NC組明顯升高(P<0.05),見圖3B。

3 討論
miRNAs在急性缺血性腦卒中患者血液中比較穩定,可能作為潛在的診斷標記[15]。本研究發現8個候選miRNAs中miR-30a-5p、miR-579-3p和Let-7e表達水平在急性缺血性腦卒中外周血和較對照組存在差異(P<0.05),表明急性缺血性腦卒中發生時外周血miRNAs表達則會明顯改變。
熒光素酶報告基因檢測發現,缺血性腦卒中患者外周血ARG1 mRNA表達水平相比對照組明顯升高(P<0.05),而RT-qPCR和Western blot發現,在HL-60或RAW264.7細胞中miR-30a-5p可以抑制ARG1 mRNA及其蛋白的表達,證實ARG1是miR-30a-5p直接作用靶基因。miR-30a-5p過表達可下調人中性粒細胞和小鼠巨噬細胞ARG1蛋白表達,表明其可能通過ARG1表達調節缺血性卒中患者的外周免疫應答,并參與缺血性卒中的病理生理過程。ARG1是一種細胞質酶,主要在肝臟中表達,同時作為尿素循環的組成部分,也在外周血的免疫細胞中表達,參與機體損傷后的免疫應答[16-17]。ARG1通過消耗L-精氨酸來發揮抗炎作用,抑制Th1細胞的活力和增強Th2細胞增殖能力[18-19]。小鼠巨噬細胞中ARG1通過與iNOS競爭L-精氨酸來抑制NO的產生[20],進而抑制炎癥反應,ARG1抗炎作用的發現進一步支持了其在巨噬細胞中表現出高表達[21]。在炎癥條件下,大量的ARG1從巨噬細胞、多形核中性粒細胞和骨髓來源的抑制細胞中釋放到細胞外,進而抑制T細胞的增殖[22-23]。研究[24]表明,急性缺血性腦卒中患者的白細胞中ARG1 mRNA持續上調。急性缺血性腦卒中發生后,受損傷的大腦下游信號上調外周血中免疫細胞ARG1 mRNA水平,并下調miR-30a-5p的表達,而miR-30a-5p的下調,進一步增強了ARG1的表達。Fu等[25]研究表明,miR-30-5p水平在脊髓損傷患者明顯下調,而miR-30a-5p過表達可改善炎癥反應和氧化應激。精神類疾病患者腦組織和外周血單核細胞中,miR-30a-5p同樣明顯下調,且對該類疾病的監測具有重要作用[26]。Wang等[27]通過探討外泌體microRNAs對缺血性腦卒中早期診斷的價值時指出腦卒中急性期外泌體miR-30a-5p表達水平降低。上述研究表明,miR-30a-5p在腦卒中等炎癥的發病過程中發揮重要作用,腦卒中發生后的分子變化可能與腦組織對局部炎癥的代償反應有關,并通過中樞神經系統,作為防御機制激活對抗促炎信號途徑。此外,ARG1增加的另一個原因可能是腦卒中后引起機體免疫抑制,患者更容易感染和預后差有關[28]。中性粒細胞釋放的ARG1蛋白抑制T淋巴細胞增殖,減少淋巴細胞,研究[29]表明血液中ARG1 mRNA的表達與中風的嚴重程度和不良預后以及高中性粒細胞-淋巴細胞比例密切相關,而ARG1是miR-30a-5p的靶基因,miR-30a-5p表達的改變可能參與并作為腦卒中引起的免疫抑制的生物標志物。
綜上所述,miR-30a-5p及其靶基因ARG1是急性缺血性腦卒中重要的分子標志物之一,miR-30a-5p可能通過抑制靶向基因ARG1表達參與缺血性卒中免疫應答病理生理過程,但具體機制尚需要進一步研究證實。

