胱抑素C和腎小球濾過率與輕型卒中合并腦微出血的相關性研究
王曉迪,巴曉紅
(錦州醫科大學附屬第一醫院神經內科,遼寧 錦州 121000)
輕型卒中是缺血性卒中的特殊類型,以美國國立衛生院腦卒中量表(NIHSS)評分≤3或者≤5分作為評定標準[1];目前對于輕型卒中的治療,2018年最新指南[2]推薦輕型致殘性卒中可以行雙重抗血小板或者靜脈溶栓治療,但隨著適應癥的擴大,隨之帶來的就是更大的出血風險[3];故準確的風險評估可以為患者帶來更大的獲益。腦微出血(cerebral microbleeds,CMBs)的出現可能增加輕型卒中的抗栓風險,因此對于輕型卒中合并CMBs危險因素的探討,有助于早期識別高危風險患者,為臨床治療提供指導。CMBs是腦小血管損傷后血液滲漏,吞噬含鐵血紅素的巨噬細胞在血管周圍局灶性沉積[4];CysC (cystatin C,CysC)和GFR(glomerular filtration rate,GFR)可以較早反應腎小血管損害的指標;且腦小血管的解剖特點、功能調節及血管床的血流動力學與腎血管相似[5];因此我們推斷CysC和GFR與CMBs可能存在關聯性,有望成為輕型卒中合并微出血篩查的生物標記物,為臨床輕型卒中的治療決策提供理論基礎。
1 資料與方法
1.1 研究對象
收集2018年3月至2019年12月于我院神經內科住院的120例輕型卒中患者為研究對象,所有入組患者均于入院7 d內行頭磁共振SWI序列檢查,依據結果分為CMBs組及非CMBs組。入選標準:年齡≥18歲;所有入組患者均符合“2018年中華醫學會神經病學分會急性缺血性腦卒中”診斷標準[2]666-682,(NIHSS) 評分 ≤5分,并經CT及MRI證實;所有入組患者均于發病3 d內入院,并于7 d內行SWI檢查;臨床及人口學資料完整。排除多發性硬化、腦創傷、腦腫瘤、腦動脈瘤、動靜脈畸形以及合并嚴重的心臟病、肝腎功能衰竭、血液系統疾病等。
1.2 研究方法
所有入組患者均于入院第一日22∶00后禁食水,并于第二日清晨空腹采集靜脈化驗血CysC、GFR及其它相關實驗室指標,所有血樣均送至我院檢驗科進行統一化驗,上述指標正常值范圍參考我院標準。所有入組患者均于入院7 d內由我院美國GE公司1.5T或者德國西門子公司3.0T頭部超導磁共振(MRI)檢查,包括常規T1加權成像、T2加權成像、液體衰減反轉恢復成像、彌散加權成像、SWI序列。CMBs定義[6]為SWI上圓形或者橢圓形,最大直徑不超過10 mm的低信號病灶,與CMBs易混淆的鈣化、血管流空、部分容積效應排除在外;腦微出血根據位置可分為[7]:腦葉區域(皮質及皮質下區)、深部區域(基底節或幕下)、混合區域(腦葉和深部)。
1.3 統計學方法
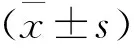
2 結 果
2.1 CMBs的發病率和分布
120例輕型卒中患者中,CMBs陽性組40例(33.3%),CMBs陰性組80例(66.7%),CMBs大部分位于混合區域,所占比例為55.0%;其次深部區域(基底節或幕下),所占比例為32.5%;腦葉區域,所占比例為12.5%。
2.2 兩組間臨床資料的比較
兩組間年齡、高血壓病史、既往卒中史、CysC、GFR、腦白質疏松(LA)及腔隙性腦梗死(LI)差異有統計意義(P<0.05);而性別、糖尿病病史、吸煙史、高脂血癥病史、肌酐、血紅蛋白、低密度脂蛋白、白細胞及總膽固醇差異無統計學意義(P>0.05)。
2.3 CMBs相關因素的Logistic回歸分析
將是否發生CMBs作為因變量,單因素Logistic回歸分析中P<0.05變量均納入為自變量,進行多因素Logistic回歸分析,得出年齡、高血壓病、CysC以及GFR為CMBs的獨立危險因素(P<0.05),見表1。
2.4 CysC水平、GFR與CMBs數量之間Pearson相關分析
將CysC及GFR水平與CMBs數量之間分別進行Pearson相關分析,CysC與CMBs數量呈正相關(r=0.422,P=0.007),表明CysC水平越高,CMBs數量越多;GFR水平與CMBs數量之間無相關性(r=-0.264,P=0.100),見表2。

表2 CysC及GFR水平與CMBs數量Pearson相關分析
3 討 論
腦微出血在老年人中比較常見,且與認知功能,特別是執行功能[8]顯著相關,CMBs不僅可以導致患者全面生活能力下降,還可以作為指導缺血性卒中患者抗栓、溶栓安全性的重要因子。雙抗治療在輕型卒中已達成共識,有研究發現[9-10]抗血小板治療的患者中伴有CMBs的出血發病率高,因此對于輕型卒中合并CMBs患者相關危險因素的評估,具有一定的臨床意義。Kato等[11]基于日本人群為研究對象的研究報道缺血性卒中患者CMBs發病率為14.6%;Artit P等[12]以泰國人群為對象研究中,急性腦梗死合并CMBs的發病率為20.0%;在本研究中,輕型卒中患者合并CMBs的發病率高達33.3%,本研究結果顯著高于Kato和Artit 等的研究結果。這可能是由于Kato和Artit 研究均應用磁共振T2WI序列,對CMBs檢出率較低;而本研究主要采用磁共振SWI序列識別CMBs, SWI序列具有高信噪比、高分辨率、完全流動補償的特點,對CMBs診斷具有高度特異性及敏感性[13]。
本研究發現CysC和GFR均是輕型卒中合并CMBs的獨立危險因素;CysC水平與CMBs數量之間呈正相關。有文獻報道[14-17]大腦與腎臟的小血管病變存在密切相關性,主要通過解剖及血管調節機制,包括高灌注壓,終末低阻力血管結構以及一氧化氮在維持腎小球或腦穿通動脈微循環的作用方面都有相似之處。亦有文獻發現腎功能不全與缺血性卒中合并CMBs存在著密切的關系[18]。但大多數研究均基于以肌酐為基礎的腎功能指標,如GFR、肌酐與尿蛋白比值,由于這些腎功能指標容易受到年齡、性別、種族、營養狀況以及肌肉體積[19]、炎癥的影響[20];所以本研究納入CysC作為評價腎功能新指標,最主要的是它受外界因素影響小,且較肌酐更敏感,可以發現亞臨床腎功能不全。CysC[21]廣泛存在于細胞外液中,是一種半胱氨酸蛋白酶抑制劑,參與細胞外基質產生和降解的動態平衡,當CysC水平增高時,對組織蛋白酶活性的抑制就會減弱,導致蛋白酶活性增加,最終造成病理損害,隨之會釋放大量炎癥因子,誘導多種組織蛋白酶的大量增加,組織蛋白酶抑制劑進而增加,導致CysC水平下降,促使蛋白酶和其抑制劑達到平衡,可見CysC不僅僅代表腎功能損害的指標,還參與炎性反應過程[22]。眾所周知,GFR下降也可作為腎臟疾病預測的最佳指標,以反映腎臟的血管損害。國內[22]934-937國外[23]已有研究顯示GFR與缺血性卒中發病率、預后顯著相關。
本研究還發現年齡和高血壓病也是輕型卒中合并CMBs的獨立危險因素。可能是由于年齡越大,血管壁彈性降低,血管壁較脆弱,血液滲出,進而導致CMBs的形成[24];長期高血壓可引起腦微血管動脈硬化以及動脈壁脂質變性、纖維化,最終導致微小血管破裂,血液外滲,CMBs形成[25]。
綜上所述,CysC水平和GFR與輕型卒中患者合并CMBs密切相關,可作為反映輕型卒中是否伴發CMBs的一個生物學標記物;且CysC水平可以反映輕型卒中患者腦微出血的嚴重程度,對 CMBs 有較好的診斷價值,能夠進一步指導輕型卒中患者臨床治療決策,值得推廣應用。

