哮喘-慢阻肺重疊患者血清中性粒細胞相關因子表達水平
路靚,李鑫,李清嵐,陸思靜
(1.錦州醫科大學;2.錦州醫科大學附屬第一醫院,遼寧 錦州 121000)
支氣管哮喘(asthma)、慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是兩種常見的呼吸系統疾病。這兩種疾病發病機制、臨床特征、治療手段均不相同,然而臨床上一些患者同時出現哮喘及慢阻肺癥狀,這些病人被歸為支氣管哮喘-慢性阻塞性肺疾病重疊[1](asthma-chronic obstructive pulmonary disease overlap,ACO)。在一些特殊的患者身上,隨著其病程的延長、疾病的發展以及年齡的增高,哮喘和COPD會發生相互轉變、相互影響和相互作用,導致部分發展為ACO[2]。ACO同時具備哮喘和COPD的特征,患者常有頻繁的急性加重、更差的生活質量,病情進展迅速且預后差,死亡率高。而ACO作為近些年提出的新概念,很多發病機制尚不清楚。GINA指出,與哮喘和 COPD 相關的炎性標志物包括呼出氣一氧化氮、血嗜酸粒細胞、痰中炎性細胞、IL-6、IL-13、髓過氧化物酶、中性粒細胞等[3]。中性粒細胞及其相關細胞因子被發現與慢阻肺的氣道炎性浸潤相關[4],但其在ACO炎癥過程中的作用尚待明確。研究ACO相關炎性標志物對ACO的診斷以及提高臨床治療效果具有重要意義。當氣道炎癥發生時,中性粒細胞會通過產生白介素-8(interleulin-8,IL-8)增強自身的趨化聚集[5],有研究表明IL-8能對COPD病情嚴重程度進行有效區分[6];白介素-17a(interleulin-17a,IL-17a)作為前炎性細胞因子,可募集并活化中性粒細胞[7],介導局部炎癥反應和組織損傷,導致肺組織結構功能破壞;氣道上皮Toll樣受體家族可以誘導產生多種炎癥因子參與氣道炎癥,而主要由中性粒細胞產生的乳鐵蛋白(lactoferrin,LF)則可以通過影響TLR4信號通路調節炎癥反應[8]。IL-8、IL-17a及LF作為中性粒細胞相關炎癥因子均可參與氣道炎癥反應,然而現存對IL-8和IL-17a在ACO相關炎癥機制的研究較少,且尚未發現對LF在ACO中所起作用的相關研究。因此,探究IL-8、IL-17a及LF這3種中性粒細胞相關炎癥因子在ACO患者血清中的表達水平很有必要。
本研究通過比較中性粒細胞相關因子IL-8、IL-17a、LF在ACO、COPD、哮喘急性期及ACO治療后患者血清表達水平,進一步探討中性粒細胞相關細胞因子IL-8、IL-17a、LF在ACO診治中的臨床意義。
1 資料與方法
1.1 一般資料
選取2017年11月至2019年4月錦州醫科大學附屬第一醫院呼吸科就診的ACO、COPD及哮喘急性期患者,按照納入及排除標準共入選ACO患者32例,COPD患者30例,哮喘患者25例。同時于我院體檢中心收集同時期健康人 20例為對照組,收集病例資料,抽取外周靜脈血10 mL用于細胞因子的檢測。ACO患者規范化治療1個月后再次抽取靜脈血。其中納入標準如下:(1)ACO患者入組標準:所有患者均為在我院行肺功能檢查及支氣管舒張試驗,參照2017年西班牙慢阻肺指南及哮喘管理指南關于ACO的共識[9]并結合實際情況制定診斷標準如下:支氣管舒張試驗強陽性,即FEV1改善值>400 mL且改善率>15%; 40歲前有哮喘病史;過敏史;有2次及以上支氣管舒張試驗結果為陽性,即 FEV1 改善值大于200 mL,且改善率大于12%。在滿足COPD診斷標準前提下,符合其中一條診斷標準即可入組;(2)ACO急性期患者入組后需于我院呼吸科病房或門診行規范治療,1個月后隨訪;(3)COPD及哮喘患者分別按照2017年GOLD和GINA制定的診斷標準入組;對照組為體檢結果正常的健康人;(4)針對所有入組患者,均已向其告知參與研究事實并簽署知情同意書。排除標準:(1)合并有支氣管擴張癥、肺纖維化、肺動脈高壓、肺結核等肺部疾病者;(2)合并惡性腫瘤,嚴重的心、肝、腎疾病者,或存在精神、神經性疾病所致的認知、交流障礙及自身免疫性疾病者;(3)2 w內有應用激素(包括全身應用及局部吸入糖皮質激素)、抗白三烯受體拮抗劑及茶堿類等相關藥物的用藥史。
1.2 方法
患者晨起空腹抽取肘正中靜脈血10 mL置于EDTA抗凝管中,立即送錦州醫科大學附屬第一醫院變態反應與臨床免疫研究中心,將血樣在2000 rpm下離心 20 min,取上清液置于凍存管中,-80 ℃冰箱保存。待樣本集齊后,室溫解凍樣本血清,采用ELISA法檢測樣本血清中IL-17a、IL-8、LF的含量。ELISA試劑盒購于上海紀寧公司,操作嚴格按照說明書進行。
1.3 統計學方法
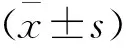
2 結 果
2.1 入組患者一般資料比較
本研究共納入107例患者,分別比較得出4組之間性別、年齡、身高、體重差異均無統計學意義(P均>0.05),說明4組實驗數據間具有可比性,見表1。
2.2 ACO、COPD、哮喘急性期及健康對照組3種細胞因子濃度的比較
通過分析比較得出4組之間血清IL-8、IL-17a和LF水平均有顯著的統計學差異(P<0.01);其中經兩兩比較,ACO組血清IL-8濃度高于哮喘組和對照組,但明顯低于COPD組,哮喘組IL-8水平明顯高于對照組,差異均有統計學意義(P<0.01);ACO組血清IL-17a水平較哮喘組高,有統計學差異(P<0.05),哮喘組IL-17a濃度平均水平雖略高于COPD組,但無統計學差異(P>0.05),不過兩者均高于健康人水平(P<0.01);ACO組血清LF含量低于哮喘組,差異有統計學意義(P<0.05),而哮喘組和COPD組LF濃度差異無顯著統計學意義(P>0.05),但均明顯低于對照組(P<0.01),見表2、表3。
2.3 ACO治療前后3種細胞因子濃度的比較
通過配對t檢驗分析得出,ACO急性加重期患者血清IL-8、IL-17a的表達水平顯著高于臨床穩定期,血清LF則低于穩定期表達水平,差異均有統計學意義(P<0.01),見表4。

表1 入組患者的一般情況比較

表2 ACO、COPD、哮喘急性期及健康對照組3種細胞因子濃度的比較

表3 ACO、COPD、哮喘組及對照組3種細胞因子濃度的兩兩比較

表4 ACO治療前后3種細胞因子濃度的比較
3 討 論
慢性氣道炎癥是哮喘和慢阻肺共同特征,哮喘主要為嗜酸性粒細胞活化參與介導,慢阻肺以中性粒細胞浸潤為主,同時由多種炎癥因子參與。有學者曾提出“荷蘭學說”[10],該學說認為,由于遺傳及周圍環境影響因素不同,慢性非特異性肺疾病可發展為哮喘、COPD或兩者兼有。有研究發現部分哮喘患者與COPD患者相比細胞分類基本相同,部分重癥、難治性或激素抵抗型哮喘患者肺組織中性粒細胞浸潤明顯增加,可能提示病情發展更加迅速,激活的中性粒細胞可以引起氧自由基和多種水解酶的釋放,中性粒細胞表達CD11b/CD18增加,若控制不佳,長期的炎癥細胞及因子的侵襲可導致氣道不可逆氣流受限,從而向COPD轉變。這是ACO可能的發病原因。故而從中性粒細胞浸潤的氣道炎癥機制入手,尋找ACO特征的炎性標志物對ACO的識別、診斷、治療具有重要作用意義。
IL-8具有強大的趨化作用,激活并使中性粒細胞及肺泡巨噬細胞聚集于氣道黏膜,釋放自由基及炎癥因子,引起肺血管內皮及肺泡上皮損傷,使血管通透性增加,炎癥反應加重,引起氣道高反應,使支氣管平滑肌痙攣、小氣道阻力增加。在IL-8與IL-6等細胞因子共同作用下,還能夠增強中性粒細胞的釋放蛋白酶的能力,促進成纖維細胞增殖,抑制細胞外基質的分解,使其沉積,從而導致氣道重構。本研究發現,血清IL-8表達水平在ACO、COPD、哮喘急性加重期組及健康對照組間存在顯著差異,其中ACO急性加重期患者外周血IL-8表達水平高于哮喘急性發作期患者,但低于COPD急性加重期患者。IL-8是在干擾素-α、白介素-1等作用下由單核巨噬細胞、內皮細胞、成纖維細胞及Th細胞等合成的炎癥因子,作用于中性粒細胞產生趨化作用[11],通過與中性粒細胞表面特異性受體結合,激活免疫炎癥反應,使中性粒細胞脫顆粒,釋放溶酶體,釋放氧自由基和蛋白水解酶等,還可以自分泌方式募集中性粒細胞,增強中性粒細胞活性,并延長其壽命,如此循環反復,致使氣道炎癥持續進行。因此IL-8的升高導致氣道中性粒細胞炎癥和氣道持續損傷,而COPD以中性粒細胞浸潤為主,血清IL-8在COPD患者中明確升高。有研究報道,非Th2相關細胞因子如IL-8在ACO患者血清濃度高于嗜酸性粒細胞參與介導為主的哮喘患者[12]。這與實驗結果相符。ACO兼有COPD和哮喘疾病的特征,中性粒細胞炎癥可能比COPD弱而強于哮喘。
IL-17a主要由Th17細胞產生,作為一種前炎性細胞因,它募集中性粒細胞的能力極強,能夠誘導氣道上皮細胞以及平滑肌細胞產生多種炎性因子。 IL-17a與Th2類細胞因子在黏液大量分泌、平滑肌細胞增生、氣道增厚和氣道炎癥中有協同作用,并可通過促進氣道上皮細胞產生趨化生長因子等引起中性粒細胞浸潤型炎癥。本研究顯示,ACO急性期患者血清IL-17a含量明顯高于COPD和哮喘組,COPD組和哮喘組差異無統計學差異。分析原因,有研究表明將卵清蛋白致敏小鼠Th17分泌的 IL-17a轉移到野生型小鼠中,隨后用卵清蛋白激發,可以導致小鼠肺中的中性粒細胞和嗜酸性粒細胞浸潤增加[13]。中性粒細胞還可以激活基質金屬酶、白三烯等促進嗜酸性粒細胞的增殖。結合上述實驗結果,IL-17a可能通過引起中性粒細胞及嗜酸性粒細胞炎癥反應,參與ACO相關免疫炎癥反應。
LF是一種多功能蛋白,具有調節免疫、抗菌抗病毒作用,中性粒細胞是目前發現含LF最多的細胞。血液中的LF主要來源于中性粒細胞,骨髓和子宮內膜也可分泌少量乳鐵蛋白。LF可以抑制炎癥區域中IL-8的轉錄和表達,調節炎癥細胞的聚集,還可抑制肥大細胞和嗜酸性粒細胞的趨化。本次研究結果顯示3個患病組患者血清LF表達水平均較健康對照組明顯下降,其中ACO急性期患者LF含量明顯低于COPD和哮喘組,COPD組與哮喘組間無明顯統計學差異。有研究顯示乳鐵蛋白可促進T淋巴細胞的成熟,通過誘導CD4+的表達,進而使未成熟T淋巴細胞分化為CD4+T淋巴細胞亞群,調節T淋巴細胞功能,改變Th1和Th2間的平衡,從而使炎癥因子釋放減少,緩解炎癥反應的進行[14]。本研究驗證了LF作為抑炎因子的作用,ACO、COPD及哮喘患者外周血LF含量明顯減少的原因可能由于LF在抑制氣道炎癥的過程中消耗過多,也可能由于該類患者體內LF分泌缺陷。
ACO患者治療前后比較結果可見3種中性粒細胞相關細胞因子均在ACO急性加重的炎癥途徑中發揮著不可或缺的作用。這也提示可以將血清IL-8、IL-17a及LF濃度檢測作為ACO患者治療效果的觀察指標,可以動態監測上述指標用于指導和調整臨床治療方案。另外,在研究ACO炎癥機制的基礎上,已有正在嘗試應用特異性中性粒細胞靶向治ACO;也有通過補充乳鐵蛋白加強抗炎作用以緩解慢性氣道炎癥的嘗試,但療效尚需驗證。
綜上所述,本研究證實中性粒細胞相關因子IL-8、IL-17a、LF在ACO、COPD及哮喘中發揮的重要作用,作為生物標記物可對3種疾病有一定的鑒別意義。IL-8、IL-17a、LF表達水平在ACO急性發作期與穩定期有明顯差異,可作為ACO治療效果的觀察指標,為其診斷和治療提供依據。但是本實驗研究對象樣本較少,且可能存在未發現實驗處理誤差等因素影響,因此針對ACO炎癥機制的研究仍需要在臨床上進行大數據樣本的實驗研究。

