circSEC31A調控miR-324-5p對脂肪干細胞增殖、凋亡和成骨分化的影響
劉暢,張榮明
(錦州醫科大學附屬第一醫院燒傷整形外科,遼寧 錦州 121000)
脂肪移植是一種成熟的外科手術,在整形外科主要應用于快速修復缺損組織,是公認的具備再生特性的整形修復方式[1]。然而在脂肪移植中,脂肪細胞的存活成為手術治療效果的關鍵[2]。脂肪干細胞是脂肪細胞的前體,能夠分化為脂肪細胞、骨細胞、軟骨細胞、神經細胞等,還能通過旁分泌途徑調控多種生物學功能[3-4]。脂肪干細胞在增強脂肪移植效果中發揮著重要作用[5]。近期研究顯示在成骨定向培養基誘導脂肪干細胞分化的細胞中存在171個circRNAs上調,119個circRNAs下調,其中circSEC31A為上調最為明顯,然而其具體作用機制尚未進一步研究[6]。circRNAs是一類環狀非編碼RNA,沒有游離的5'或3'末端,能夠抵抗核酸外切酶誘導的降解,具有較好的穩定性[7]。目前研究顯示circRNAs不僅能夠調節細胞的增殖、分化、凋亡、侵襲、遷移、自噬和耐藥等生物學功能,還參與了腫瘤、免疫性疾病和代謝性疾病的調控[8-9]。研究顯示脂肪干細胞外分泌的circ_0000250能夠調控miR-128-3p/SIRT1通路參與糖尿病小鼠的傷口愈合[10]。然而circSEC31A在脂肪干細胞中發揮的作用及機制尚未闡明,因此本研究通過在脂肪干細胞中分別轉染sh-circSEC31A和LV-circSEC31A后,探討circSEC31A對脂肪干細胞增殖、凋亡和成骨分化的作用和機制。
1 材料和方法
1.1 主要試劑
DMEM培養基購自美國Gibco公司;胎牛血清購自索萊寶科技有限公司;CCK-8試劑盒、Annexin V-FITC 細胞凋亡檢測試劑盒、ECL化學發光試劑盒、磷酸鹽緩沖液、SDS-PAGE電泳液、胰蛋白酶和青霉素-鏈霉素購自中國碧云天生物技術有限公司;TRIzol試劑和SYBRGreen購自美國Promega公司;lipofectamine 3000和RNA反轉錄試劑盒購自日本TaKaRa公司;引物由生工生物工程(上海)股份有限公司合成;兔抗人RUNX2、OPN、GAPDH和HRP 標記的羊抗兔IgG購自美國Abcam公司;陰性對照shRNA(negative control-shRNA,sh-NC)、sh-circSEC31A、空載慢病毒(LV-NC)、LV-circSEC31A、miR-324-5p 陰性對照組(miR-NC)、miR-324-5p mimics和miR-324-5p inhibitors購自中國上海Genepharm公司。
1.2 方法
1.2.1 脂肪干細胞培養與轉染
脂肪干細胞由前期課題組分離并鑒定,細胞采用含10%胎牛血清的DMEM細胞培養基于37 ℃、5% CO2恒溫培養箱中培養,每2 d換液1次,細胞融合率達到80%后傳代,取第三代對數生長期細胞,采用lipofectamine 3000對sh-NC、sh-circSEC31A、LV-NC、LV-circSEC31A、miR-NC、miR-324-5p mimics和miR-324-5p inhibitors進行轉染。
1.2.2 RT-qPCR
采用TRIzol提取細胞中的總RNA,使用TaqMan MicroRNA Assay試劑盒檢測miR-324-5p的表達水平,并使用Applied Biosystem 7500進行qPCR,U6作為內參。使用PrimeScript TM RT試劑盒從總RNA合成第一鏈互補DNA,并使用SYBR Green PCR Master Mix進行qPCR,以GAPDH為內參,按2-ΔΔCt法計算相對表達量。
1.2.3 CCK-8方法檢測細胞增殖
取對數生長期脂肪干細胞,以2×103個/孔密度接種到96孔培養板中,每組設置5個復孔,在培養箱中分別培養0、1、2和3 d后,加入10 μL CCK-8,繼續放回培養箱中培養2 h后,采用酶標儀測量450 nm處的吸光度。
1.2.4 流式細胞儀細胞凋亡檢測
采用PBS重懸細胞,加入10 μL Annexin V-FITC和5 μL碘化丙啶染色液(0.25 mg/mL),輕輕混勻,室溫避光孵育10 min,用流式細胞儀進行檢測。
1.2.5 雙熒光素酶報告
將野生型(wild-type,WT)或突變型(mutant,MUT)circSEC31A克隆到pmirGLO質粒受體中,同時將miR-324-5p mimics或miR-NC導入脂肪干細胞中,共培養48 h后采用雙熒光素酶受體分析系統測量雙熒光素活性。
1.2.6 Western blot法
采用RIPA細胞裂解液冰上裂解各組細胞,使用BCA 試劑盒測定檢測蛋白濃度。使用10%SDS-PAGE凝膠分離等量(50 μg)的蛋白質樣品,110 V電泳,250 mA電轉至PVDF膜,5%脫脂奶粉37 ℃封閉2 h。分別加入RUNX2、OPN和GAPDH一抗4 ℃孵育過夜,TBST洗膜3×10 min,二抗37 ℃孵育1 h,TBST洗膜3×30 min,ECL顯影。并使用Image J軟件分析蛋白條帶灰度值,以GAPDH作內參計算目的蛋白的相對表達量。
1.3 統計學分析
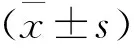
2 結 果
2.1 circSEC31A對脂肪干細胞增殖和成骨分化的影響
在轉染sh-circSEC31A后脂肪干細胞中circSEC31A的表達水平較轉染sh-NC明顯降低(P<0.01),見圖1A;進一步在細胞中轉染LV-circSEC31A后,circSEC31A的表達水平較轉染LV -NC明顯升高(P<0.01),見圖1B。在脂肪干細胞增殖上,轉染sh-circSEC31A后細胞的增殖能力明顯降低(P<0.01),見圖1C,轉染LV-circSEC31A后細胞的增殖能力明顯增強(P<0.01),見圖1D。在脂肪干細胞成骨分化上,轉染sh-circSEC31A后細胞中成骨分化相關分子RUNX2和OPN的mRNA和蛋白水平降低(P<0.001),見圖1E、圖1F;轉染LV-circSEC31A后細胞中成骨分化相關分子RUNX2和OPN的mRNA和蛋白水平升高(P<0.001),見圖1G、圖1H。這提示低表達circSEC31A能夠抑制脂肪干細胞增殖和成骨分化,過表達circSEC31A能夠促進脂肪干細胞增殖和成骨分化。
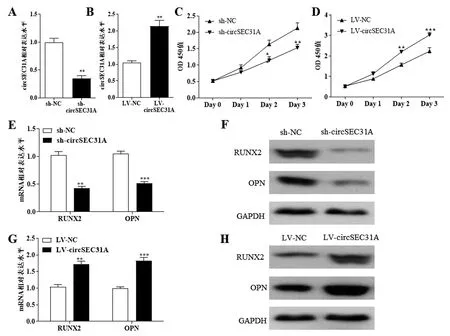
與sh-NC或LV-NC組相比,**P<0.01;***P<0.001
2.2 circSEC31A對脂肪干細胞凋亡的影響
轉染sh-circSEC31A后細胞的凋亡率明顯升高(P<0.01),見圖2A,轉染LV-circSEC31A后細胞的凋亡率明顯降低(P<0.05),見圖2B。這提示低表達circSEC31A能夠促進脂肪干細胞凋亡,過表達circSEC31A能夠抑制脂肪干細胞凋亡。
2.3 circSEC31A能夠靶向結合miR-324-5p
為進一步探討circSEC31A調控脂肪干細胞增殖、凋亡和成骨分化的作用機制,circSEC31A和miR-324-5p的靶點結合情況詳見圖3A;雙熒光素酶結果顯示:circSEC31A-WT組中轉染miR-324-5p mimics后雙熒光素活性明顯下降(P<0.001),見圖3B;在circSEC31A-MUT組中轉染miR-324-5p mimics后雙熒光素活性未見明顯改變(P>0.05),見圖3B;進一步在脂肪干細胞中轉染sh-circSEC31A后能夠明顯促進miR-324-5p的表達水平(P<0.01),見圖3C;在轉染LV-circSEC31A后能夠明顯抑制miR-324-5p的表達水平(P<0.05),見圖3D;同時在脂肪干細胞中轉染miR-324-5p mimics后能夠明顯促進miR-324-5p的表達水平(P<0.01),見圖3E;轉染miR-324-5p inhibitors后能夠明顯抑制miR-324-5p的表達水平(P<0.01),見圖3E。這提示circSEC31A可能通過靶向結合miR-324-5p調控脂肪干細胞增殖、凋亡和成骨分化。
2.4 circSEC31A通過調控miR-324-5p影響脂肪干細胞增殖、凋亡和成骨分化
在脂肪干細胞中共轉染LV-circSEC31A和miR-324-5p mimics后,脂肪干細胞增殖能力和單獨轉染LV-NC組未見明顯差異(P>0.05),見圖4A;在共轉染LV-circSEC31A和miR-324-5p inhibitors后,脂肪干細胞增殖能力較單獨轉染LV-circSEC31A后進一步加強(P<0.05),見圖4B;在脂肪干細胞中共轉染LV-circSEC31A和miR-324-5p mimics能夠逆轉單獨轉染LV-circSEC31A對脂肪干細胞中成骨分化相關分子RUNX2和OPN的mRNA和蛋白表達水平(P>0.05),見圖4C、圖4D;共轉染LV-circSEC31A和miR-324-5p inhibitors能夠進一步加強單獨轉染LV-circSEC31A對脂肪干細胞中成骨分化相關分子RUNX2和OPN的mRNA和蛋白表達水平(P<0.01),見圖4E、圖4F;在脂肪干細胞凋亡上,共轉染LV-circSEC31A和miR-324-5p mimics后脂肪干細胞凋亡率和單獨轉染LV-NC組未見明顯差異(P>0.05),見圖4G;在共轉染LV-circSEC31A和miR-324-5p inhibitors后脂肪干細胞凋亡率較單獨轉染LV-circSEC31A后進一步降低(P<0.05),見圖4H。
這提示過表達circSEC31A通過靶向調控miR-324-5p促進脂肪干細胞增殖和成骨分化,抑制細胞凋亡,見圖4。
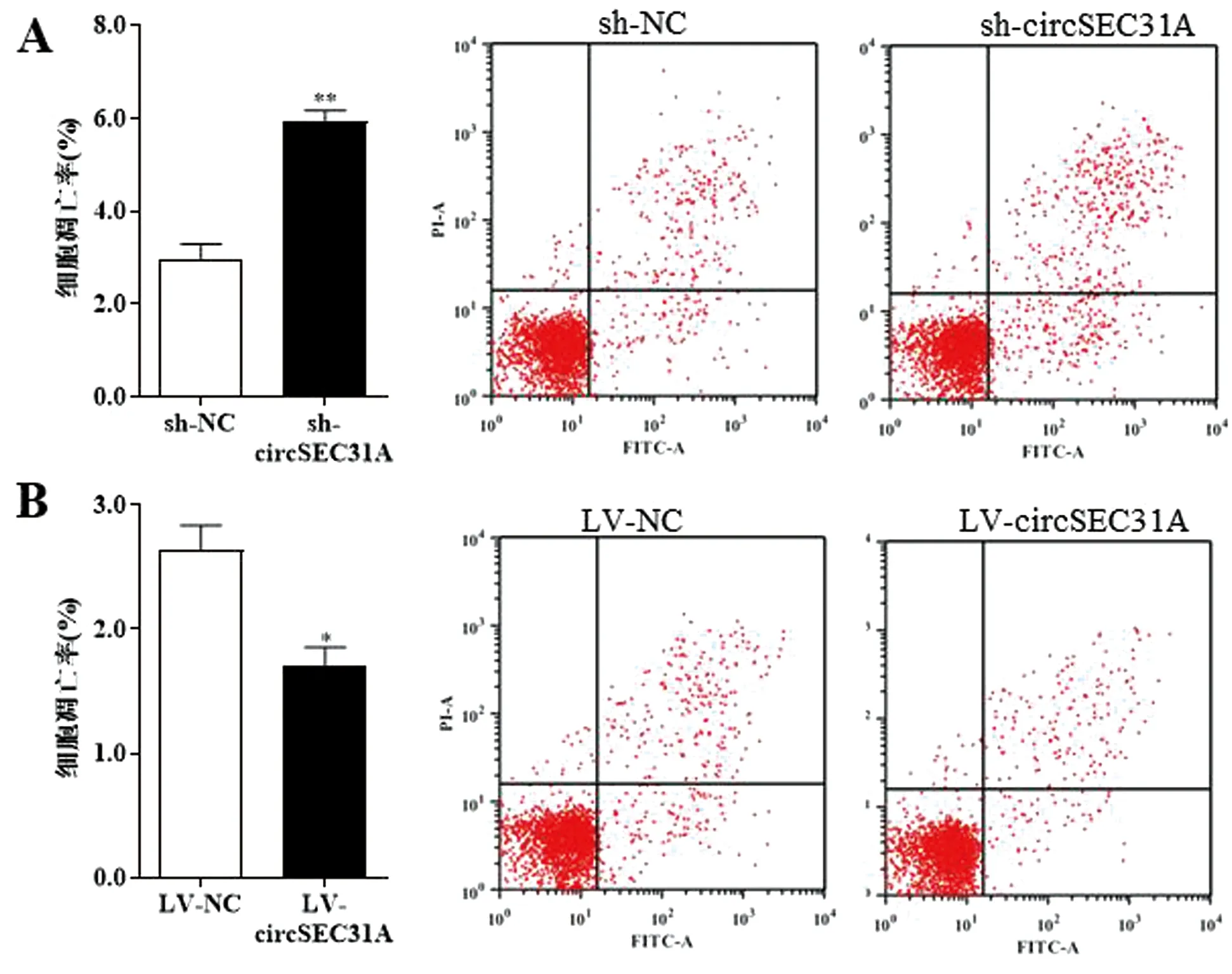
與sh-NC或LV-NC組相比,*P<0.05;**P<0.01

與miR-NC,sh-NC或LV-NC組相比,*P<0.05;**P<0.01;***P<0.001;與miR-NC組相比,##P<0.01
3 討 論
脂肪干細胞在整形外科中的應用越來越受到重視,目前脂肪干細胞可以應用到軟組織填充、創面修復、骨與軟骨缺損和皮膚年輕化等多方面的治療[11]。然而脂肪干細胞的存活依舊是治療效果的關鍵。在脂肪移植中脂肪細胞的存活率在40%~50%左右,當脂肪細胞壞死后會出現感染、炎癥、鈣化等多種嚴重并發癥,給治療效果和患者治療后的體驗帶來嚴重挑戰[12]。臨床上為提高脂肪存活率一般通過脂肪采集、脂肪處理和移植區域填充保證脂肪細胞存活[13]。研究顯示采用殼聚糖支架、硫化氫、米諾環素、人參皂甙等多種方式能夠提高脂肪干細胞的存活率[14]。因此,探尋提高脂肪干細胞存活率的方式在整形外科脂肪移植中具有重要意義。
研究顯示circSEC31A在成骨定向培養基誘導脂肪干細胞分化的細胞中明顯高表達,其作用機制尚未明確[6]289-302。在本研究中采用sh-circSEC31A和LV-circSEC31A分別低表達和過表達脂肪干細胞中circSEC31A的表達水平,結果顯示低表達circSEC31A能夠明顯抑制脂肪干細胞的增殖、成骨分化和促進細胞凋亡,過表達circSEC31A能夠明顯促進脂肪干細胞的增殖、成骨分化和抑制細胞凋亡。這體現circSEC31A在調控脂肪干細胞增殖、凋亡和成骨分化中發揮重要作用。研究顯示circCDR1能夠通過調控miR-7/GDF5/SMAD和p38 MAPK介導牙周膜干細胞的成骨分化[15]。也有研究顯示circRFWD2和circINO80能夠靶向結合miR-6817-5p調控NELL-1誘導的脂肪干細胞成骨分化[16]。然而circSEC31A參與調控脂肪干細胞生物學功能的機制有待進一步研究。
circSEC31A作為circRNAs一類分子,其主要調控方式是通過ceRNA機制靶向結合miRNAs[17]。數據庫預測(https://circinteractome.nia.nih.gov)結果顯示circSEC31A能夠靶向結合的miRNAs包括miR-1179、miR-1253、miR-1263、miR-197、miR-324-5p、miR-383、miR-409-3p、miR-502-5p、miR-587、miR-607、 miR-616和miR-766 。研究顯示miR-324-5p能夠通過靶向結合KLF3調控脂肪干細胞的分化和小鼠中脂肪的積累[18]。本研究雙熒光素酶結果顯示circSEC31A能夠靶向結合miR-324-5p,同時過表達circSEC31A能夠抑制脂肪干細胞中miR-324-5p的表達水平,低表達circSEC31A能夠促進脂肪干細胞中miR-324-5p的表達水平。研究顯示miR-150能夠靶向調控Notch3介導脂肪干細胞的成脂分化[19]。也有研究顯示miR-145-5p能夠靶向結合Sema3a抑制導脂肪干細胞的成骨分化[20]。這提示circSEC31A可能通過靶向結合miR-324-5p調控脂肪干細胞增殖、凋亡和成骨分化。
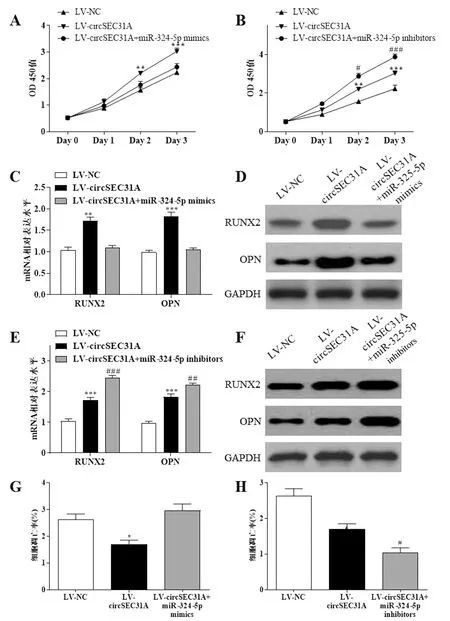
與LV-NC組相比,*P<0.05;**P<0.01;***P<0.001;與LV-circSEC31A組相比,#P<0.05;##P<0.01;###P<0.001
在進一步的回復實驗中,為驗證circSEC31A通過靶向結合miR-324-5p調控脂肪干細胞增殖、凋亡和成骨分化,在脂肪干細胞中共轉染LV-circSEC31A和miR-324-5p mimics后能夠反轉單獨轉染LV-circSEC31A對脂肪干細胞增殖、凋亡和成骨分化的影響;共轉染LV-circSEC31A和miR-324-5p inhibitors后能夠進一步加強單獨轉染LV-circSEC31A對脂肪干細胞增殖、凋亡和成骨分化的影響。這顯示circSEC31A能夠通過靶向調控miR-324-5p參與脂肪干細胞增殖、凋亡和成骨分化,circSEC31A可能成為干預脂肪干細胞生物學功能的靶點。

