卵巢癌組織中miR-377的表達及其與臨床病理參數的關系
楊曉東
卵巢癌為危害女性健康的三大婦科腫瘤之一,在婦科惡性腫瘤中病死率居首[1]。據國際癌癥研究機構2016年癌癥統計數據,卵巢癌是美國癌癥相關死亡的第五大常見原因,2016年估計有22 280例新病例和14 240例死亡[2]。在中國,卵巢癌的發病率和死亡率在過去10年中再度增加[1,3]。由于卵巢解剖位置的隱蔽性及早期癥狀不明顯,70%~80%病人確診時已屬晚期,這給卵巢癌的診斷、治療提出了不小的挑戰。臨床工作中,CA125已成為卵巢癌術前診斷、評估療效、監測復發、預測預后的指標之一,但其敏感性不高,特異性不強,難以起到早期診斷的作用[4-5]。因此探索卵巢癌的致病因素及尋找特異性早期診斷的分子標志物成為卵巢腫瘤基礎與臨床研究的熱點。
目前,microRNA已成為腫瘤的新型潛在診斷生物標志物[1]。其中,miR-377是DLK1-DIO3基因簇區域中54個miRNAs中的一員,這一54miRNAs基因簇是人類基因組中目前所知的最大的miRNAs基因簇[6]。研究[7-8]發現miR-377可以通過調節信號通路參與多種人類腫瘤疾病的生物學過程,其中包括胰腺癌、胃癌等。但miR-377在卵巢癌病人中表達及其與臨床病理參數的關系尚待深入。因此研究選取50例卵巢癌病人,考察其腫瘤組織與同期正常卵巢組織miR-377的表達,進一步探究miR-377的表達與臨床病理相關參數及預后的關系。現作報道。
1 資料與方法
1.1 一般資料 收集我院2013年1月至2014年1月手術治療的卵巢癌病人卵巢腫瘤組織標本50例(卵巢癌組)。年齡34~68歲;收集的所有腫瘤組織參照《惡性腫瘤TNM分期》:Ⅰ期7例,Ⅱ期19例,Ⅲ期16例,Ⅳ期8例;高分化10例,中分化17例,低分化23例。納入標準:(1)術前明確診斷為卵巢惡性腫瘤;(2)均行手術切除,術后留取組織證實為卵巢惡性腫瘤;(3)臨床病理資料完整,完成本研究中所有調查項目者。排除標準:(1)有放化療史者;(2)合并其他惡性腫瘤病人。同時收集正常卵巢組織樣本50例作為對照組。2組研究對象一般資料均具有可比性。
1.2 方法
1.2.1 樣品收集與制備 手術中收集新鮮的腫瘤標本及同期正常卵巢組織,勻漿后使用Trizol試劑(Invitrogen,USA)提取RNA。
1.2.2 RT-qPCR檢測miR-377表達 配制miRNA反轉錄反應液對上述制備的總RNA中的miRNA進行反轉錄。冰上配制miR-377的qPCR反應液,混勻后加入PCR反應管中,離心并將混合物加入多孔板,多孔板置于PCR儀中,兩步法進行退火反應:95 ℃預變性10 min,95 ℃變性15 s,60 ℃退火1 min,擴增40個循環。繪制光譜和溶解曲線,軟件分析樣品的Ct值,以U6為內參,2-△△Ct法計算miR-377表達量。實驗引物由上海生工生物公司設計合成。引物序列見表1。

表1 PCR引物序列
1.3 觀察指標
1.3.1 miR-377表達與臨床病理參數的關系 記錄病人的年齡、T分期、N分期、是否轉移、臨床分期、病理分級及卵巢癌類型,比較不同病理類型病人間miR-377表達差異,分析miR-377表達與卵巢癌發生和發展的關系。
1.3.2 miR-377表達與卵巢癌預后的關系 術后隨訪5年,每6個月隨訪1次,采用電話隨訪或病人回院復查相結合的隨訪方式。根據miR-377表達情況分為高表達組和低表達組2個亞組,以miR-377/U6=1為標準,相對表達量>1記為“+”,即高表達,相對表達量<1記為“-”,即低表達。以此為基礎,考察miR-377表達與卵巢癌病人的臨床病理參數的關系。繪制2組術后5年生存曲線圖,比較2個亞組生存率分布。
1.3.3 多因素COX回歸分析 采用多因素COX回歸分析,評價miR-377是否可以作為卵巢癌預后的獨立危險因素。
1.4 統計學方法 采用獨立樣本t檢驗、秩和檢驗和χ2檢驗;Kaplan-Meier法建立生存模型,行Log-rank檢驗分析生存率差異;采用多因素COX回歸分析卵巢癌預后的獨立危險因素。
2 結果
2.1 miR-377表達與臨床病理參數的關系 與對照組比較,卵巢癌組miR-377表達降低,差異有統計學意義(P<0.01)(見表2)。不同T分期、N分期、臨床分期及是否轉移的卵巢癌病人,其miR-377表達差異有統計學意義(P<0.05~P<0.01)。不同年齡、病理分級及卵巢癌類型卵巢癌病人的miR-377表達差異無統計學意義(P>0.05)(見表3)。
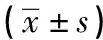
表2 卵巢癌組與對照組miR-377表達比較

表3 miR-377表達與臨床病理參數的關系[n;百分率(%)]
2.2 miR-377表達與卵巢癌預后的關系 50例卵巢癌病人中miR-377低表達者34例,高表達者16例。Kaplan-Meier法繪制卵巢癌病人5年總生存曲線(見圖1)。由圖可見,miR-377低表達與高表達卵巢癌病人的5年總生存率分別為55.9%、75.0%,差異有統計學意義(χ2=12.61,P<0.01)。說明miR-377高表達者生存曲線圖優于低表達者,miR-377低表達影響卵巢癌預后及生存率。

2.3 多因素COX回歸分析 本研究以上述卵巢癌病人為樣本,建立COX比例風險回歸模型。應變量為卵巢癌病人預后(分別賦值1=死亡,0=生存,生存時間t)。自變量為病人的T分期、N分期、是否轉移、臨床分期、病理分級及miR-377表達。回歸過程采用后退法,α出=0.05。
結果顯示,T分期、N分期、是否轉移及miR-377表達進入回歸結果。相對危險度(OR)依次為2.459、2.365、2.517、2.048。其中T分期、N分期、是否轉移可簡稱TNM分期。提示TNM分期及miR-377表達為預后的獨立危險因素(P<0.01)(見表4)。

表4 多因素COX回歸分析
3 討論
卵巢癌是婦科生殖道三大惡性腫瘤之一,其發病率雖然位居子宮頸癌和子宮體癌之后,但其死亡率卻居于首位。不同期別卵巢癌其生存率差異極大,早期卵巢癌病人通過手術、化療其5年生存率能達到90%以上,但晚期卵巢癌病人5年生存率僅20%~30%[9-10]。化療是目前卵巢癌有效的輔助治療手段,而化療藥的不良反應常限制其用藥劑量和時程,使得化療藥難以清除體內的腫瘤細胞,導致臨床上腫瘤治療的失敗及病人預后不佳。基因靶向治療可降低藥物的不良反應,已成為當今研究的熱點。與卵巢癌發生發展密切相關的癌基因及抑癌基因已被逐步發現[11-12],但它們的異常傳導途徑在腫瘤侵襲轉移中的機制還有待進一步研究,且由于腫瘤的發生機制復雜,在惡性腫瘤中存在基因突變,抗單基因的抑制劑或者單抗藥物的應用范圍并不廣,使基因藥物的應用受到限制。基于此,目前急需研發一靶多向的基因治療方法。
MEG3是目前腫瘤研究最為廣泛的轉錄體RNA[13],miR-377位于MEG3的下游,被證實參與細胞周期調控、分化、衰老及凋亡等生物學過程[14-15],尤其是作為一種重要的抑癌基因廣為研究[16]。本文選擇miR-377基因,考察其于卵巢癌組織的表達水平。結果發現,與對照組比較,卵巢癌組miR-377表達顯著降低,與已有的胰腺癌[7]、胃癌[8]研究一致。進一步研究發現,卵巢癌組miR-377表達與腫瘤的TNM分期、臨床分期、病理分級有關,但與病人的年齡、卵巢癌類型等臨床病理參數無關。同時對卵巢癌病人進行5年隨訪,其5年生存曲線顯示miR-377低表達者5年生存率顯著低于高表達者,提示miR-377的表達影響卵巢癌的生存率。
預后在腫瘤治療中至關重要[17]。因預后的影響因素眾多,卵巢癌病人的預后評估始終是臨床上面臨的難題[18]。目前,臨床分期常被認為是卵巢癌等惡性腫瘤預后的危險因素[4,19]。且據報道,miR-377發揮抑癌基因作用[7-8,20]。本文COX回歸分析顯示,miR-377低表達與TNM分期是卵巢癌預后的獨立危險因素。這可能是由于隨臨床分期的推進,接受手術治療的卵巢癌病人更容易復發所致。同時,上述研究表明miR-377低表達與卵巢癌的生存率降低有關,推測miR-377低表達可用于預測卵巢癌病人的預后情況。
綜上所述,miR-377在卵巢癌病人組織中的表達顯著降低,miR-377表達水平與卵巢癌病人的TNM分期、臨床分期及病理分級有關,且miR-377低表達與TNM分期可視為卵巢癌預后的獨立危險因素。提示miR-377可作為評估卵巢癌病理參數程度和病人預后的有效生物學標志物。

