川芎嗪對(duì)脂多糖誘導(dǎo)的人臍靜脈內(nèi)皮細(xì)胞高通透性的保護(hù)作用研究
張?jiān)葡觯?婷,葉苗苗,王元元,陶 靜,李 言
肺微血管內(nèi)皮細(xì)胞作為保護(hù)肺臟的第一道門戶,其屏障功能在其中發(fā)揮著至關(guān)重要的作用。在感染性疾病誘發(fā)的急性肺損傷(ALI)時(shí),脂多糖(lipopolysaccharide,LPS)引起肺內(nèi)微血管內(nèi)皮細(xì)胞與中性粒細(xì)胞黏附增加以及巨噬細(xì)胞細(xì)胞炎癥因子的釋放,細(xì)胞骨架相關(guān)信號(hào)通路被激活,下游肌動(dòng)蛋白細(xì)胞骨架重構(gòu),從而導(dǎo)致內(nèi)皮細(xì)胞損傷繼而引發(fā)肺內(nèi)微血管內(nèi)皮屏障破壞。因此,通過LPS建立在體或離體炎癥模型[1-2]成為研究ALI的常用實(shí)驗(yàn)方法。
Ras相關(guān)的C3肉毒素底物1(ras-related C3 botulinum toxin substrate 1,Rac1)是小G蛋白家族成員之一,其活性形式Rac1-GTPase能夠?qū)?xì)胞骨架的調(diào)節(jié)產(chǎn)生重要影響。Rac1通過作用下游靶點(diǎn)cAMP依賴的蛋白激酶A(PAK)激活LIM激酶(LIMK)[3],LIMK通過磷酸化抑制絲切蛋白(cofilin)誘導(dǎo)的肌動(dòng)蛋白解聚,間接促進(jìn)肌動(dòng)蛋白應(yīng)力纖維形成、細(xì)胞骨架重構(gòu),繼而引發(fā)細(xì)胞通透性的改變[4]。川芎嗪(tetramethylpyrazine,TMP)的化學(xué)成分是四甲基吡嗪,主要來源于中國(guó)傳統(tǒng)中藥川芎的根莖提取物,可以通過抑制炎癥反應(yīng)減輕機(jī)體膿毒癥癥狀[5],臨床上廣泛應(yīng)用于擴(kuò)張血管、改善微循環(huán)等方面[6]。課題組前期實(shí)驗(yàn)研究發(fā)現(xiàn)TMP可以降低通路中相關(guān)蛋白的表達(dá)來減弱LPS對(duì)內(nèi)皮細(xì)胞骨架的損傷[7]。但是TMP對(duì)于Rac1/LIMK1信號(hào)通路上游分子的調(diào)控機(jī)制并不確定。為此本實(shí)驗(yàn)通過檢測(cè)TMP在人臍靜脈內(nèi)皮細(xì)胞(human umbilical vein endothelial cells,HUVECs)體外模型上引起的通透性的改變,以明確TMP對(duì)LPS誘導(dǎo)損傷血管內(nèi)皮細(xì)胞后通透性升高的改善情況;Western blotting檢測(cè)Rac1/LIMK1信號(hào)通路相關(guān)蛋白表達(dá)情況;從分子水平探討Rac1/LIMK1信號(hào)通路是否參與LPS誘導(dǎo)的內(nèi)皮細(xì)胞損傷,探討TMP干預(yù)Rac1/LIMK1信號(hào)通路的具體分子學(xué)機(jī)制。
1 材料與方法
1.1 主要試劑及材料 健康足月剖宮產(chǎn)新生兒臍帶,標(biāo)本取自蚌埠醫(yī)學(xué)院第一附屬醫(yī)院產(chǎn)科(均征得產(chǎn)婦同意);鹽酸TMP(中國(guó)食品藥品檢定研究院);LPS(0111美國(guó)SIGMA公司);ECM培養(yǎng)基(ScienCell公司);胰酶、4%多聚甲醛(Biosharp公司);基質(zhì)膠(CORNING公司);FITC標(biāo)記葡聚糖(美國(guó)SIGMA公司);Transwell培養(yǎng)板(CORNING公司);Rac1活性檢測(cè)試劑盒、LIMK1、p-LIMK1抗體(Abcam公司);β-actin(ABclonal公司)。
1.2 實(shí)驗(yàn)方法
1.2.1 HUVECs原代培養(yǎng)以及傳代培養(yǎng) 無菌條件下,取約15 cm的新生兒臍帶,37 ℃預(yù)熱的PBS沖洗3次。注入預(yù)熱的0.25%胰酶消化液15~20 mL,置37 ℃培養(yǎng)箱中孵育4~6 min,充分消化臍靜脈內(nèi)皮。收集消化液,用ECM完全培養(yǎng)基沖洗臍靜脈管腔,收集胰酶-ECM培養(yǎng)基混合液于離心管,1 000 r/min離心10 min,棄上清液。加入3 mL完全培養(yǎng)液,用吹打管吹打均勻,按1×105個(gè)接種于25 cm2培養(yǎng)瓶,置于5%CO2、37 ℃培養(yǎng)箱中培養(yǎng)3~5 d,達(dá)到70%~80%融合后,棄去培養(yǎng)瓶中的舊培養(yǎng)液,0.25%胰酶消化、傳代培養(yǎng),經(jīng)Ⅷ因子抗體免疫組織化學(xué)鑒定為血管內(nèi)皮細(xì)胞后,將2~3代用于實(shí)驗(yàn)。
1.2.2 內(nèi)皮細(xì)胞鑒定 用ECM不完全培養(yǎng)基稀釋的基質(zhì)膠(1∶8)包被六孔板內(nèi)的無菌蓋玻片,PBS沖洗3次晾干待用;取2~3代對(duì)數(shù)生長(zhǎng)期的HUVECs,0.25%胰酶消化并1 000 r/min離心5 min,ECM培養(yǎng)基重懸細(xì)胞并計(jì)數(shù),以每孔3×105個(gè)細(xì)胞接種于蓋玻片上;37 ℃細(xì)胞培養(yǎng)箱內(nèi)培養(yǎng),細(xì)胞融合80%以上程度時(shí)棄去舊培養(yǎng)基,PBS沖洗2次,冷丙酮固定10 min;PBS沖洗2次,3%H2O2常溫孵育30 min;PBS沖洗2次,加入1∶100Ⅷ因子兔抗人抗體,4 ℃濕盒內(nèi)孵育12 h;PBS沖洗2次,滴加山羊抗兔IgG,常溫孵育20 min;混合DAB試劑盒內(nèi)A、B、C液各1滴于1 mL PBS緩沖液中,常溫染色20 min,PBS緩沖液清洗2次;蘇木精復(fù)染5 min;無水乙醇脫水2次,每次2 min;二甲苯透明2次,每次2 min;中性樹膠封片;顯微鏡下觀察并采集圖像。
1.2.3 細(xì)胞分組 正常對(duì)照組(不做藥物及損傷處理)、LPS組(LPS 1 μg/mL作用12 h)、TMP低、中、高劑量防治組(TMP終濃度分別為60、120、240 μg/mL作用12 h后+LPS 1 μg/mL繼續(xù)作用12 h)、純TMP組(TMP 240 μg/mL作用24 h)。
1.2.4 HUVECs體外模型的構(gòu)建及通透性檢測(cè) Transwell上構(gòu)建HUVECs單層模型:Transwell板由上、下室兩部分構(gòu)成。上室底是由透明聚酯薄膜構(gòu)成(孔徑0.4 μm),下室是24孔培養(yǎng)板。細(xì)胞按5×103接種在Transwell上室濾膜,濾膜提前12 h鋪被ECM不完全培養(yǎng)基稀釋的基質(zhì)膠(1∶8)包被處理,培養(yǎng)4~5 d待細(xì)胞完全融合為單層后進(jìn)行藥物干預(yù)分組處理。在Transwell上室加入用ECM不完全培養(yǎng)基配制的異硫氰酸螢光素-右旋糖酐(FITC-Dextran)溶液(500 μg/mL)100 μL,在Transwell下室加入ECM不完全培養(yǎng)基600 μL,在37 ℃、5%CO2細(xì)胞培養(yǎng)箱內(nèi)孵育1 h后,從每個(gè)嵌套小室上層和下層分別取液100 μL,加入黑色96孔板中,用Synerge Ⅱ多功能酶標(biāo)儀(BioTek公司,美國(guó))測(cè)定Transwell小室上下雙層液體中的熒光強(qiáng)度值,激發(fā)光波長(zhǎng)495 nm,發(fā)射光波長(zhǎng)520 nm。內(nèi)皮細(xì)胞單層對(duì)右旋糖苷通透性的大小用通透系數(shù)(Pa)表示,計(jì)算公式為:Pa=(下室熒光強(qiáng)度值)×(下室液體體積)/FITC孵育時(shí)間(s)/濾膜面積(cm2)/上室熒光強(qiáng)度值。實(shí)驗(yàn)結(jié)果以Pa%表示,Pa%=(實(shí)驗(yàn)樣品組Pa/實(shí)驗(yàn)對(duì)照組Pa)×100%。
1.2.5 體外模型的跨內(nèi)皮細(xì)胞電阻值(TEER)測(cè)定 將RE1600上皮細(xì)胞電壓電阻儀的兩片電極分別置于濾膜表面及濾膜下,12只Transwell上室加入ECM完全培養(yǎng)基200 μL,下室加入ECM完全培養(yǎng)液1 000 μL,用RE1600上皮細(xì)胞電壓電阻儀測(cè)量每個(gè)Transwell小室的基礎(chǔ)電阻值,Transwell上室接種細(xì)胞懸液后,分別在12、24、36、48、60、72、84、96、108、120 h測(cè)量電阻值,TEER按以下公式計(jì)算:TEER(單位:Ω×cm2)=(內(nèi)皮細(xì)胞電阻值-基礎(chǔ)電阻值)×Transwell上室濾膜的底面積(0.33 cm2),然后繪制TEER-時(shí)間曲線。當(dāng)TEER達(dá)到標(biāo)準(zhǔn)值并穩(wěn)定后,上室內(nèi)更換為相應(yīng)實(shí)驗(yàn)培養(yǎng)液,下室內(nèi)更換為ECM完全培養(yǎng)基。置CO2培養(yǎng)箱。在加入干預(yù)因素后0、12和24 h測(cè)定各孔的TEER值,并繪制各組TEER值變化曲線。
1.2.6 各組細(xì)胞蛋白表達(dá)檢測(cè)實(shí)驗(yàn)
1.2.6.1 細(xì)胞分組與蛋白收集 根據(jù)Rac1活性檢測(cè)試劑盒說明書,將2~3代HUVECs接種于細(xì)胞培養(yǎng)瓶中,待細(xì)胞融合90%以上作分組藥物干預(yù)(分組情況同通透性檢測(cè)實(shí)驗(yàn)),每個(gè)細(xì)胞培養(yǎng)瓶中加入1 mL 1× Assay Buffer-蛋白酶抑制劑混合液(1 000∶1),冰上裂解20 min;收集混合液,1 000 r/min離心5 min;取上清液至新EP管中;BCA法定量各組上清液中蛋白含量,2 000 μg/mL。
1.2.6.2 Rac1-GTPase下拉實(shí)驗(yàn) 取500 μL各組蛋白上清樣品,1×Assay Buffer調(diào)節(jié)體積至1 mL;取40 μLPAK1 PBD瓊脂糖珠漿液加入各組蛋白樣品中;4 ℃震蕩孵育1 h;19 ℃ 14 000 r/min離心10 s,沉淀瓊脂糖珠;吸出上清液轉(zhuǎn)移至新的EP管中;500 μL 1× Assay Buffer洗滌瓊脂糖珠3次,每次離心后小心吸出上清液,保留珠粒沉淀;將珠粒沉淀重懸于40 μL SDS-PAGE蛋白上樣緩沖液(2×)中,混勻后快速離心10 s,蛋白樣本于PCR儀中95 ℃ 5 min加熱變性。所得樣品直接Western blotting檢測(cè)。
1.2.6.3 Western blotting檢測(cè)各組細(xì)胞蛋白表達(dá) 制作SDS-聚丙烯酰胺凝膠,每孔加入30 μg蛋白樣品,經(jīng)Bio-Rad電泳儀進(jìn)行電泳,轉(zhuǎn)膜,5%BSA封閉1~2 h,TBST稀釋一抗(Rac1 1∶1 000、LIMK1 1∶1 500、p-LIMK1 1∶1 500、β-actin 1∶10 000)4 ℃孵育過夜,TBST液洗膜20 min后二抗孵育1 h,再經(jīng)TBST洗膜30 min;最后加入顯影液上機(jī)曝光檢測(cè)目的蛋白相對(duì)表達(dá)量。
1.3 統(tǒng)計(jì)學(xué)方法 采用方差分析和q檢驗(yàn)。
2 結(jié)果
2.1 正常HUVECs形態(tài)學(xué)觀察以及細(xì)胞鑒定結(jié)果 使用0.25%胰酶灌注成功將HUVECs消化下來,12 h后倒置顯微鏡下觀察發(fā)現(xiàn)大多數(shù)細(xì)胞處于貼壁狀態(tài),亮空泡狀的無活性細(xì)胞較少(見圖1A)。原代培養(yǎng)4 d后觀察內(nèi)皮細(xì)胞融合為單層,密度可高達(dá)90%以上,細(xì)胞形態(tài)呈飽滿的不規(guī)則鋪路石狀緊密排列(見圖1B)。鏡下觀察細(xì)胞質(zhì)內(nèi)大量黃褐色顆粒聚集于細(xì)胞核周圍(見圖1C),Ⅷ因子相關(guān)抗原蛋白呈陽性表達(dá),可證明培養(yǎng)的細(xì)胞為內(nèi)皮細(xì)胞。
2.2 各組細(xì)胞通透性檢測(cè)結(jié)果 與正常對(duì)照組相比,LPS組Pa升高明顯(P<0.01);與LPS組相比,3組TMP防治組Pa呈下降趨勢(shì)(P<0.05~P<0.01),并且具有一定的濃度依賴性(見表1)。
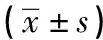
表1 各組間內(nèi)皮細(xì)胞單層通透性比較

2.3 TEER測(cè)定結(jié)果 細(xì)胞接種Transwell小室12 h內(nèi),TEER值受細(xì)胞貼壁影響明顯升高,12~84 h這一階段細(xì)胞TEER值呈穩(wěn)定趨勢(shì)增長(zhǎng)[12、24、36、48、60、72 h分別為4.59±0.53、5.69±0.10、6.58±0.51、7.63±0.60、9.01±0.19、(10.28±0.60)Ω×cm2],84 h后細(xì)胞TEER值增長(zhǎng)明顯減緩[84、96、108 h分別為12.55±0.19、13.54±1.26、(13.60±0.33)Ω×cm2](F=189.042,P<0.05,MS組內(nèi)=0.301)。LPS作用12 h時(shí),與正常對(duì)照組相比,LPS組TEER值顯著性降低(P<0.05);與LPS組相比,TMP中、高劑量防治組TEER顯著升高(P<0.05~P<0.01)(見表2)。
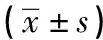
表2 LPS作用12 h前后各處理組TEER值變化情況比較
2.4 各處理組細(xì)胞蛋白樣品中目的蛋白表達(dá)情況 與正常對(duì)照組比較,LPS組Rac1-GTPase、Rac1、LIMK1、p-LIMK1蛋白表達(dá)均明顯上調(diào)(P<0.01);TMP高劑量防治組與LPS組比較,Rac1-GTPase、Rac1、LIMK1、p-LIMK1蛋白表達(dá)均明顯下調(diào)(P<0.05~P<0.01)(見圖2、表3)。
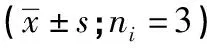
表3 各組Rac1-GTPase、Rac1、LIMK1、p-LIMK1蛋白相對(duì)表達(dá)量比較
3 討論
內(nèi)皮細(xì)胞是血管表面與血液和組織之間形成的一道單層界面,是調(diào)節(jié)血管滲透的一道重要屏障[8],肺微血管內(nèi)皮細(xì)胞受損作為ALI發(fā)病的最初環(huán)節(jié),可以繼發(fā)導(dǎo)致肺微血管內(nèi)皮細(xì)胞屏障功能受損,從而引起肺泡毛細(xì)血管壁通透性增加。而這種內(nèi)皮屏障功能對(duì)維持循環(huán)穩(wěn)定以及組織器官正常功能具有重要意義[9]。內(nèi)皮細(xì)胞或是其他種類的真核細(xì)胞,其完整的細(xì)胞形態(tài)都離不開細(xì)胞骨架架構(gòu)出的一道復(fù)雜且嚴(yán)謹(jǐn)?shù)牧Ⅲw網(wǎng)狀結(jié)構(gòu)。當(dāng)細(xì)胞受到LPS刺激時(shí),細(xì)胞骨架相關(guān)信號(hào)通路被激活,導(dǎo)致細(xì)胞骨架相關(guān)蛋白表達(dá)發(fā)生變化,細(xì)胞骨架重構(gòu),最終導(dǎo)致內(nèi)皮細(xì)胞通透性增高。

測(cè)定TEER以及熒光標(biāo)記大分子物質(zhì)通透性是檢測(cè)內(nèi)皮細(xì)胞屏障系統(tǒng)的常用方法。使用這2種方法聯(lián)合檢測(cè)可以減少人為因素的干預(yù)以及細(xì)胞早期通透性變化信息的丟失[10]。我們選擇用基質(zhì)膠提前包被內(nèi)皮細(xì)胞的體外生長(zhǎng)環(huán)境模擬細(xì)胞-基底膜的黏附連接,通過檢測(cè)內(nèi)皮細(xì)胞時(shí)間-TEER值的變化判斷細(xì)胞的融合情況,對(duì)細(xì)胞間緊密連接完整性進(jìn)行評(píng)估。在接種細(xì)胞84 h后TEER值增長(zhǎng)速度明顯減慢進(jìn)入“平臺(tái)期”,細(xì)胞發(fā)生接觸抑制。但是細(xì)胞TEER值進(jìn)入“平臺(tái)期”的時(shí)間節(jié)點(diǎn)會(huì)隨著細(xì)胞接種數(shù)目的增多而相應(yīng)的縮短。LPS作用之前,各組細(xì)胞TEER值沒有顯著性差異,加入LPS作用12 h后,與正常組相比,LPS組TEER值下降明顯。國(guó)內(nèi)外相關(guān)研究[7,11]發(fā)現(xiàn)TMP在抗炎、內(nèi)皮細(xì)胞保護(hù)等方面具有良好的效果,我們?cè)趦?nèi)皮細(xì)胞體外模型中加入不同劑量的TMP(60、120、240 μg/mL)進(jìn)行預(yù)保護(hù)處理,結(jié)果發(fā)現(xiàn),與LPS組相比,TMP中、高劑量防治組TEER值顯著升高。另外,在各組細(xì)胞對(duì)FITC-葡聚糖的通透系數(shù)百分比Pa檢測(cè)實(shí)驗(yàn)結(jié)果中發(fā)現(xiàn),LPS組Pa較正常組明顯增高;TMP低、中、高劑量防治組Pa較LPS組相比呈不同程度降低。可以說明LPS對(duì)內(nèi)皮細(xì)胞屏障造成較明顯破壞,而TMP在改善LPS對(duì)內(nèi)皮細(xì)胞屏障的破壞上發(fā)揮了積極的作用。
Rac1是細(xì)胞骨架相關(guān)通路中重要的上游分子,作為小G蛋白家族成員之一,能夠與GTP/GDP結(jié)合,對(duì)下游信號(hào)通路產(chǎn)生on/off效應(yīng)[12]。Rac1-GTPase還可以通過作用下游靶點(diǎn)PAK1激活LIMK。關(guān)于LIMK1對(duì)細(xì)胞骨架,涉及到的比較經(jīng)典的兩個(gè)通路是Rac1/PAK/LIMK1/Cofilin信號(hào)通路以及RhoA/ROCK/LIMK1/cofilin信號(hào)通路。LIMK1是磷酸化cofilin的重要激酶,LIMK1的活性形式p-LIMK1可以將cofilin N端第三位絲氨酸磷酸化,p-cofilin為cofilin的失活態(tài),從而cofilin誘導(dǎo)的肌動(dòng)蛋白解聚減少,聚合態(tài)的肌動(dòng)蛋白增加,引起細(xì)胞骨架重構(gòu)[13]。WOO等[14]在LPS誘導(dǎo)的大鼠成纖維細(xì)胞中發(fā)現(xiàn)LPS引起Rac1激活,并且呈時(shí)間依賴性。在我們的Western blotting實(shí)驗(yàn)檢測(cè)中發(fā)現(xiàn),LPS組較正常組Rac1-GTPase活性蛋白表達(dá)上調(diào),并且TMP高劑量保護(hù)組中Rac1-GTPase活性蛋白表達(dá)較LPS組下降。對(duì)各組總蛋白的Western blotting檢測(cè)發(fā)現(xiàn),LPS組較正常組p-LIMK1蛋白表達(dá)升高,TMP中、高劑量保護(hù)組較LPS組的p-LIMK1蛋白表達(dá)則出現(xiàn)下調(diào),結(jié)合上述通透性實(shí)驗(yàn)相關(guān)數(shù)據(jù)可以說明TMP對(duì)LPS誘導(dǎo)的內(nèi)皮細(xì)胞屏障功能損傷的保護(hù)作用可能與其下調(diào)Rac1/LIMK1信號(hào)通路中Rac1-GTPase活性蛋白、LIMK1磷酸化蛋白表達(dá)有關(guān)。對(duì)于TMP是否參與其他骨架蛋白相關(guān)信號(hào)通路的調(diào)節(jié)有待進(jìn)一步研究證實(shí)。

