不同溫度和酸濃度下蔗糖轉(zhuǎn)化反應(yīng)速率的研究和對(duì)比
馮金濤,姚翠霞
(臨沂大學(xué)化學(xué)化工學(xué)院,山東臨沂 276000)
蔗糖廣泛存在于許多植物中,是各種食品中常用的甜味劑,也是自然界中分布較廣的非還原性二糖。蔗糖在酸或者蔗糖酶的作用下,水解生成葡萄糖和果糖,其水解產(chǎn)物具有還原性,該反應(yīng)是化學(xué)動(dòng)力學(xué)較早經(jīng)過(guò)定量研究的反應(yīng)之一。反應(yīng)進(jìn)行的快慢以及反應(yīng)過(guò)程的機(jī)理研究是化學(xué)動(dòng)力學(xué)的研究范疇。化學(xué)動(dòng)力學(xué)的基本任務(wù)之一就是了解各種因素對(duì)化學(xué)反應(yīng)速率的影響,為人們提供選擇和掌控反應(yīng)進(jìn)行的主動(dòng)權(quán)。在化學(xué)反應(yīng)的動(dòng)力學(xué)研究中,速率常數(shù)k是一個(gè)非常重要的物理量[1]。人們可以根據(jù)速率常數(shù)k的數(shù)值大小直接對(duì)反應(yīng)的快慢進(jìn)行判斷。
1 材料與方法
1.1 試劑
蔗糖、二次蒸餾水、鹽酸水溶液(1 mol/L和 3 mol/L)。
1.2 儀器與設(shè)備
WZZ-2S型自動(dòng)旋光儀(上海儀電物理光學(xué)儀器有限公司)、水浴鍋、分析天平、玻璃攪拌棒、具塞三角瓶、移液管、秒表和燒杯。
1.3 實(shí)驗(yàn)方法
本文分別配制不同濃度的酸和蔗糖溶液。以蔗糖溶液配制為例,先用分析天平稱取15 g的蔗糖,放入100 mL燒杯中,再加入75 mL二次蒸餾水,得到質(zhì)量摩爾濃度為0.58 mol/kg的蔗糖溶液。在酸的催化下,蔗糖轉(zhuǎn)化為葡萄糖和果糖,在反應(yīng)過(guò)程中,水分子的消耗相對(duì)于水的濃度來(lái)說(shuō)是微不足道的,水的濃度可近似為恒定不變,因此該反應(yīng)可以近似作為一級(jí)反應(yīng)處理。根據(jù)一級(jí)反應(yīng)及蔗糖轉(zhuǎn)化反應(yīng)的動(dòng)力學(xué)特征,可得到反應(yīng)系統(tǒng)的旋光度隨反應(yīng)時(shí)間t的函數(shù)關(guān)系,見(jiàn)式(1)。以ln(αt-α′)對(duì)t做直線,該直線斜率的相反數(shù)為所求反應(yīng)的速率常數(shù)。反應(yīng)速率受溫度、濃度、催化劑和壓力等因素的影響。在實(shí)驗(yàn)過(guò)程中,壓力為當(dāng)前大氣壓恒定不變,本文主要考慮溫度和酸的濃度對(duì)蔗糖轉(zhuǎn)化反應(yīng)速率的 影響。
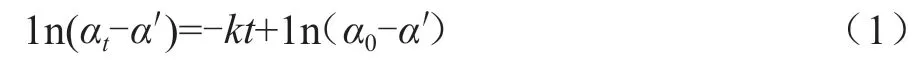
式中:α0為初始旋光度;αt為t時(shí)刻的旋光度;a'代表反應(yīng)完全之后溶液的旋光度。實(shí)驗(yàn)過(guò)程中,為了減少溫度不穩(wěn)定對(duì)測(cè)量結(jié)果的影響,用移液管取30 mL蔗糖溶液置于100 mL具塞三角瓶中。移取30 mL HCl溶液于另一只100 mL具塞三角瓶中,將蔗糖溶液和鹽酸溶液分別恒溫水浴15 min,取出兩只三角瓶,將鹽酸和蔗糖溶液充分混合,將混合液裝滿旋光管。擦凈后置于旋光儀中,蓋上槽蓋。實(shí)時(shí)監(jiān)測(cè)反應(yīng)體系的旋光度隨時(shí)間的變化,每隔3 min記錄1次數(shù)據(jù),每組實(shí)驗(yàn)記錄8次。反應(yīng)過(guò)程中體系的溫度由恒溫水浴中的水循環(huán)通過(guò)旋光管外層套管實(shí)現(xiàn)。將剩余反應(yīng)混合液置于60 ℃水浴中,恒溫30 min加速反應(yīng),然后在實(shí)驗(yàn)溫度下冷卻10 min,按上述步驟測(cè)定其旋光度,其旋光度即為α’。
2 結(jié)果與分析
在溫度為30 ℃,鹽酸濃度為1 mol/L的條件下,通過(guò)實(shí)驗(yàn)數(shù)據(jù)繪制反應(yīng)體系的旋光度隨時(shí)間的變化曲線,如圖1所示。圖中2條擬合線分別來(lái)自同一型號(hào)的兩臺(tái)旋光儀。從數(shù)據(jù)處理結(jié)果可以看出,在相同的初始條件下,通過(guò)計(jì)算得到的蔗糖轉(zhuǎn)化反應(yīng)的速率常數(shù)分別為0.009 69 min-1和0.010 28 min-1。為了降低實(shí)驗(yàn)設(shè)備帶來(lái)的系統(tǒng)誤差,取2次實(shí)驗(yàn)的平均值作為相同條件下蔗糖轉(zhuǎn)化反應(yīng)的速率常數(shù),其他溫度及濃度條件下的速率常數(shù)均采用這種方法來(lái)處理。
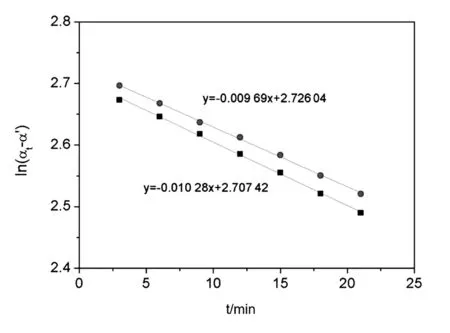
圖1 不同溫度和酸濃度條件下蔗糖轉(zhuǎn)化反應(yīng)數(shù)據(jù)處理對(duì)比圖
2.1 溫度的影響
(1)控制反應(yīng)物鹽酸的濃度為3 mol/L。當(dāng)實(shí)驗(yàn)溫度為20 ℃時(shí),如表1所示,A組計(jì)算得到的速率常數(shù)為0.012 120 min-1;當(dāng)反應(yīng)溫度為30 ℃時(shí),B組計(jì)算得到的反應(yīng)速率常數(shù)為0.039 675 min-1。由量子力學(xué)和統(tǒng)計(jì)熱力學(xué)可知,分子有多種運(yùn)動(dòng)形式。分子的能量由分子的平動(dòng)、振動(dòng)、轉(zhuǎn)動(dòng),電子的運(yùn)動(dòng)、核的運(yùn)動(dòng)等多種形式的能量構(gòu)成。其中分子的平動(dòng)能和轉(zhuǎn)動(dòng)能與溫度的一次方成正比。溫度越高,分子的平動(dòng)能和轉(zhuǎn)動(dòng)能越高,因此反應(yīng)物蔗糖分子的熱力學(xué)能越高,反應(yīng)速率增加。根據(jù)一級(jí)反應(yīng)的動(dòng)力學(xué)特征,蔗糖轉(zhuǎn)化反應(yīng)的半衰期可通過(guò)公式計(jì)算得到。根據(jù)反應(yīng)速率常數(shù)計(jì)算得到的不同溫度下蔗糖水解反應(yīng)的半衰期分別為57.2 min和17.5 min。
通過(guò)2組實(shí)驗(yàn)對(duì)比發(fā)現(xiàn),溫度越高,蔗糖水解反應(yīng)的速率常數(shù)越大,半衰期越小。溫度升高10 ℃,蔗糖轉(zhuǎn)化反應(yīng)的速率常數(shù)增加至3.2倍。該結(jié)論符合van,t Hoff近似規(guī)則:即溫度每升高10 ℃,反應(yīng)速率大約增加2 ~ 4 倍[2]。阿倫尼烏斯根據(jù)大量的實(shí)驗(yàn)數(shù)據(jù),總結(jié)出對(duì)于速率與溫度呈指數(shù)關(guān)系的一類反應(yīng)的溫度影響速率常數(shù)的經(jīng)驗(yàn)公式[3-5]。
Arrhenius方程為:
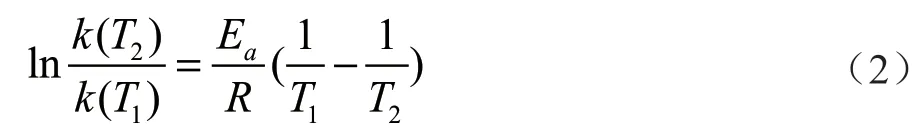
當(dāng)鹽酸的濃度為3 mol/L時(shí),20~30 ℃該反應(yīng)的活化能為87 617.5 J/mol。
(2)控制反應(yīng)物鹽酸的濃度為1 mol/L如表1所示。當(dāng)實(shí)驗(yàn)溫度為20 ℃時(shí),C組中計(jì)算得到的速率常數(shù)為0.002 925 min-1;當(dāng)反應(yīng)溫度為30 ℃時(shí),D組計(jì)算得到的反應(yīng)速率常數(shù)為0.009 985 min-1。根據(jù)反應(yīng)速率常數(shù)計(jì)算得到的蔗糖水解反應(yīng)的半衰期分別為236.9 min和69.4 min。通過(guò)實(shí)驗(yàn)對(duì)比發(fā)現(xiàn),溫度越高,速率常數(shù)越大,半衰期越小。溫度升高10 ℃,蔗糖轉(zhuǎn)化反應(yīng)速率增加至3.4倍,與 3 mol/L濃度的鹽酸組增長(zhǎng)幅度相接近,同樣符合van,t Hoff近似規(guī)則。根據(jù)阿倫尼烏斯經(jīng)驗(yàn)式,當(dāng)鹽酸的濃度為1 mol/L時(shí),20~30 ℃該反應(yīng)的活化能為 90 715.517 6 J/mol。
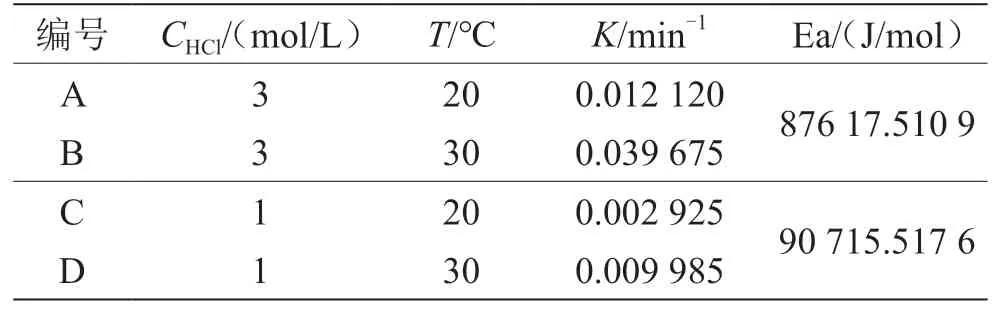
表1 不同溫度、不同鹽酸濃度下蔗糖轉(zhuǎn)化反應(yīng)的速率常數(shù)和活化能
為了衡量溫度變化對(duì)速率常數(shù)的影響程度,進(jìn)而對(duì)比不同實(shí)驗(yàn)的溫度對(duì)反應(yīng)速率的影響,本文定義了單位溫度變量所引起的速率常數(shù)的改變量。當(dāng)鹽酸濃度為1 mol/L時(shí),平均單位溫度所引起的速率常數(shù)的變化率為0.000 706。當(dāng)鹽酸濃度為 3 mol/L時(shí),平均單位溫度所引起的速率常數(shù)的變化率 為0.002 756。
2.2 催化劑濃度的影響
控制實(shí)驗(yàn)溫度為20 ℃,當(dāng)反應(yīng)物鹽酸的濃度為3 mol/L,表1中A組計(jì)算得到的速率常數(shù)為 0.012 120 min-1;當(dāng)反應(yīng)物鹽酸的濃度為1 mol/L時(shí),C組計(jì)算得到的反應(yīng)速率常數(shù)為0.002 925 min-1。 當(dāng)溫度保持20 ℃不變,將催化劑鹽酸的濃度從 1 mol/L增加至3 mol/L,反應(yīng)的速率常數(shù)增加4.1倍。控制實(shí)驗(yàn)溫度為30 ℃,當(dāng)反應(yīng)物鹽酸的濃度為3 mol/L,B組計(jì)算得到的速率常數(shù)為 0.039 675 min-1;當(dāng)反應(yīng)物鹽酸的濃度為1 mol/L時(shí),D組計(jì)算得到的反應(yīng)速率常數(shù)為0.009 985 min-1。當(dāng)溫度保持30 ℃不變,將催化劑鹽酸的濃度從1 mol/L增加至3 mol/L,反應(yīng)速率增加4.0倍。通過(guò)對(duì)比發(fā)現(xiàn),反應(yīng)溫度無(wú)論是20 ℃還是30 ℃,當(dāng)催化劑酸的濃度增加相同濃度時(shí),反應(yīng)速率常數(shù)的變化率是一樣的。
對(duì)于基元反應(yīng),活化能有明確的物理意義,就是將具有平均能量的反應(yīng)物分子變成具有平均能量的活化分子所必須給予的能量稱為活化能[6-9]。對(duì)于復(fù)雜反應(yīng),實(shí)驗(yàn)活化能沒(méi)有明確的物理意義,僅僅是組成復(fù)雜反應(yīng)的一些基元反應(yīng)活化能的組合,其組合方式取決于表觀速率常數(shù)與基元反應(yīng)速率常數(shù)之間的關(guān)系。活化能的大小可以用參與反應(yīng)的物質(zhì)的化學(xué)鍵鍵能的大小進(jìn)行估算。對(duì)于蔗糖轉(zhuǎn)化反應(yīng),在純水中反應(yīng)速率極慢,反應(yīng)的活化能較高。為使水解反應(yīng)加速,常選擇酸作為催化劑。相對(duì)于非催化蔗糖轉(zhuǎn)化反應(yīng),催化劑酸的存在提供了一種能量上有利的反應(yīng)機(jī)理,反應(yīng)途徑改變,從而使蔗糖轉(zhuǎn)化反應(yīng)能在可行的室溫溫度下進(jìn)行。從兩組數(shù)據(jù)對(duì)比可以看出,反應(yīng)物鹽酸的濃度從1 mol/L升高至 3 mol/L時(shí),活化能降低,提高了活化分子的百分?jǐn)?shù),進(jìn)而提高了反應(yīng)速率。該結(jié)論再次證明催化劑能夠改變反應(yīng)途徑,降低活化能,從而加速反應(yīng)。
為了更直觀地反映實(shí)驗(yàn)溫度和催化劑濃度對(duì)反應(yīng)速率的影響,圖2為4種不同初始條件下蔗糖轉(zhuǎn)化反應(yīng)的速率常數(shù)數(shù)值,為了方便數(shù)值的比較,將速率常數(shù)k的數(shù)值擴(kuò)大1 000倍顯示在圖中,并用k’表示,k’=k×103。當(dāng)鹽酸的濃度和實(shí)驗(yàn)溫度同時(shí)提升時(shí),蔗糖轉(zhuǎn)化的速率會(huì)大幅度提升。
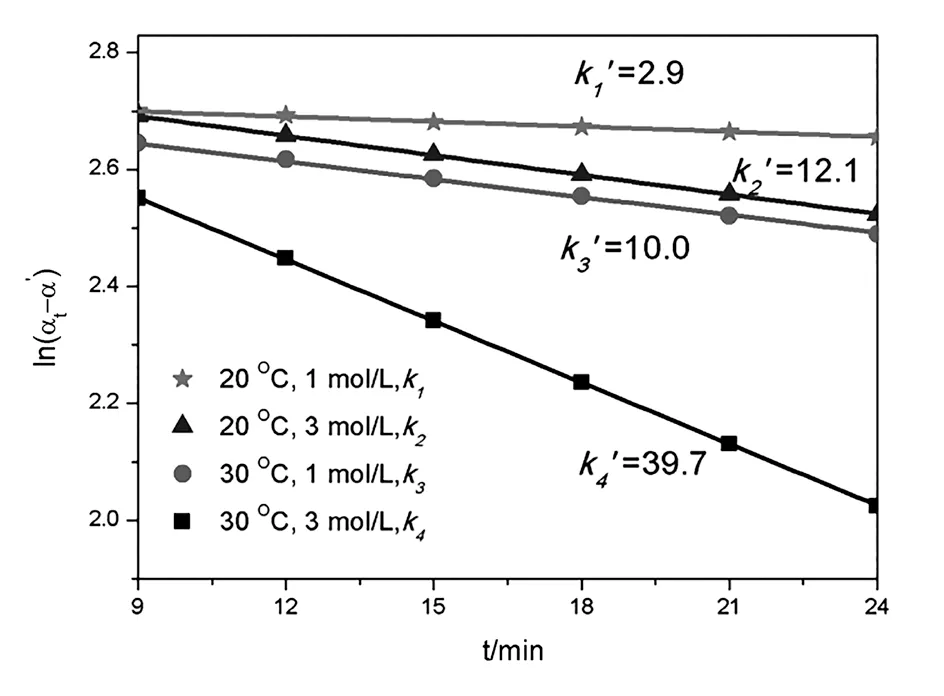
圖2 不同條件下蔗糖轉(zhuǎn)化的速率常數(shù)對(duì)比
3 結(jié)論與討論
本文檢測(cè)了蔗糖轉(zhuǎn)化反應(yīng)的速率常數(shù)在不同反應(yīng)溫度和催化劑濃度下的影響,并對(duì)所得到的速率常數(shù)進(jìn)行活化能計(jì)算,得出以下結(jié)論,該反應(yīng)符合van,t Hoff近似規(guī)則,控制催化劑濃度及溫度能夠有效降低蔗糖轉(zhuǎn)化反應(yīng)的活化能。

