滿意度函數-響應面法優化枯草芽孢桿菌發酵工藝
李 達,苗欣宇,孫慕白,牛紅紅,孫瑞悅,王景會*
(1.吉林省農業科學院 農產品加工研究所,吉林 長春 130033;2.延邊大學 食品科學與工程學院,吉林 延吉 133002)
枯草芽孢桿菌(Bacillus subtilis)是當今社會生產中廣泛使用的一種微生物,它屬于芽孢桿菌屬中的一種,在自然界環境土壤、湖泊中分布極其廣泛,生長繁殖過程中大部分菌株不會產生毒性物質,對人畜等生命幾乎無任何毒害作用,故廣受人們關注[1-3]。枯草芽孢桿菌(B.subtilis)菌體形態為桿狀,產生孢子,在微生物生長代謝過程中,分泌產生許多抗菌素[4-5]和特定的酶類[6-7]等,其菌體發酵液抑菌性能較強,對多種病原菌有抑制作用,本身所產生的芽孢使其對外界生長環境有極強抗逆性能[8]。對微生物繁殖營養條件需求簡單,分裂生長速度較快[9],因而枯草芽孢桿菌(B.subtilis)產品的生產加工工藝簡單、活菌存活率高。其菌體對外界環境高適應性[10]及發酵液對病原菌的抑制作用[11-12],可以采用不同的生產工藝,產品類型靈活多變,使其成為當今社會生產中使用廣泛的微生物菌種之一。
目前,國內外枯草芽孢桿菌(B.subtilis)微生物發酵工業中發酵液主要是分離出菌體生產微生物制劑或對其上清液進行提取純化代謝產物進而生產相關產品。LI R F等[13]通過中心組合設計(central composite design,CCD)優化了生長重要參數,使枯草芽孢桿菌DB1342對白色念珠菌的生長抑制率比優化前提高30.86%。MEENA K R等[14]通過響應面法(response surface methodology,RSM)優化枯草芽孢桿菌(B.subtilis)KLP2015生產工藝參數,使其對霉菌具有抑制作用的脂肽的產量提高1.8倍。KILANI-FEKI O等[15]通過對枯草芽孢桿菌(B.subtilis)M13培養基進行優化篩選后,使抗真菌代謝產物產量比基礎培養基提高93%以上。沈躍麗等[16]優化枯草芽孢桿菌發酵條件,對熒光假單孢菌及短小芽孢桿菌抑菌能力分別提高了42%和47%。湯穎秀[17]對誘變枯草芽孢桿菌產表面活性素工藝進行優化,比優化前產量提高了1.48倍。任玉文等[18]通過優化發酵工藝,使枯草芽孢桿菌菌體產量較優化前提高了3.95倍。孫沙沙等[19]優化了培養基及發酵工藝,使菌株對煙草野火病害抑菌圈直徑提高了25.72%。賈田惠等[20]優化了發酵過程主要因素,使對真菌抑菌圈直徑提高了72.5%。
本研究通過響應面法對1株對細菌具有較強拮抗能力枯草芽孢桿菌(B.subtilis)CGMCC5174的發酵工藝進行優化,采用細菌活菌量和抑菌物質產量為評價指標,并結合滿意度函數法,以期利用一個總體滿意度值來綜合評價發酵液中細菌活菌總量和抑菌物質產量,從而更好地預測出發酵工藝優化參數對發酵液中活菌和抑菌物質產量的影響。
1 材料與方法
1.1 材料與試劑
1.1.1 菌株
枯草芽孢桿菌(Bacillus subtilis)CGMCC5174:吉林省農業科學院農產品加工研究所;大腸桿菌(Escherichia coli)CMCC44825:廣東微生物種質資源庫。
1.1.2 化學試劑
胰蛋白胨、酵母粉、牛肉膏、瓊脂(均為生化試劑)、氯化鈉、葡萄糖(均為分析純):上海鼎國生物技術有限公司。
1.1.3 培養基
營養瓊脂平板[21]:胰蛋白胨10 g/L、牛肉膏3 g/L、氯化鈉5 g/L、瓊脂15 g/L,去離子水定容至1 L,用1 mol/L NaOH溶液調節培養基pH值至7.4,121 ℃滅菌15 min。
LB液體培養基[22]:胰蛋白胨10 g/L、酵母粉5 g/L、氯化鈉10 g/L、葡萄糖3 g/L,去離子水定容至1 L,用1 mol/L NaOH溶液調節培養基pH值至6.4,121 ℃滅菌15 min。
1.2 儀器與設備
XSP-2C生物顯微鏡:日本Olympus公司;PB-10型酸度計:德國賽多利斯公司;MLS-3780高壓滅菌器:日本Sanyo公司;Cary 300 UVVIS分光光度計:美國Varian公司;BCN-1360B型無菌超凈工作臺、HZQ-Q振蕩培養箱:哈爾濱市東聯電子技術開發有限公司;D3024R 實驗臺式高速冷凍型離心機:大龍興創實驗儀器(北京)股份公司;DHP-9272電熱恒溫培養箱、JWS24型電熱恒溫水浴鍋:上海一恒科學儀器有限公司;Forma-80 ℃905-ULTS超低溫冰箱:賽默飛世爾(蘇州)儀器有限公司。
1.3 試驗方法
1.3.1 菌株培養液的制備
枯草芽孢桿菌CGMCC5174種子培養液的制備:菌株甘油凍干管從-80 ℃低溫冰箱中取出,放在37 ℃恒溫水浴中迅速溶解。從凍干管中取出1 mL菌液加入到裝液量為10 mL/250 mL LB培養液中,37 ℃、200 r/min振蕩培養24 h后,得到種子培養液,放入-4 ℃備用。
枯草芽孢桿菌CGMCC5174培養液的制備:從種子培養液中取出1.5 mL菌液加入裝液量為100 mL/250 mL LB培養液中,37 ℃、150 r/min振蕩培養8 h,再重復上述步驟活化2次,得到菌株CGMCC5174培養液,放入-4 ℃備用。
大腸桿菌(Escherichia coli)CMCC44825培養液的制備:大腸桿菌甘油凍干管-80 ℃低溫冰箱中取出,37℃恒溫水浴迅速溶解。從凍干管中取出2 mL菌液加入裝液量為10 mL/250 mL LB培養液中,37 ℃、170 r/min振蕩培養24 h。再從培養瓶中取出1 mL菌液加入裝液量為100 mL/250 mL LB培養液中,37 ℃、170 r/min振蕩培養14 h,得到菌株CMCC 44825培養液,放入-4 ℃備用。
1.3.2 抑制致病菌能力檢測[23]
取枯草芽孢桿菌CGMCC517培養液在8 000 r/min條件下離心10 min,取上清液,將濾紙片(直徑8 mm)浸泡于分離得到的上清液中15 min。取大腸桿菌CMCC44825菌液50 μL,均勻涂布于營養瓊脂平板上,靜置20 min,放上準備好的濾紙片,37 ℃恒溫靜置培養16 h,觀察抑菌情況。用游標卡尺測抑菌圈的直徑,以抑菌圈直徑大小表示抑菌活性(抑菌圈直徑>8 mm,判為有抑菌作用;抑菌圈直徑<8 mm,判為無抑菌作用)。
1.3.3 枯草芽孢桿菌活菌數的測定[24]
采用平板稀釋計數法測定發酵液中枯草芽孢桿菌活菌數,對操作方法稍作改動。使用無菌移液槍取出1 mL充分搖勻的枯草芽孢桿菌CGMCC517發酵液,沿試管壁緩慢注入裝有9 mL無菌生理鹽水的試管中,放到振蕩器充分混合均勻。按著上一步驟,依次制備10倍稀釋的發酵液樣品,共稀釋8個試管,分別標注1~8號。分別從4、7、8號管中吸取100 μL置于營養瓊脂平板上,均勻涂布,放入培養箱37 ℃恒溫靜置培養16 h,取出后點數平板上單菌落數目,計算枯草芽孢桿菌活菌數。
1.3.4 發酵工藝優化單因素試驗
按1.3.1中枯草芽孢桿菌試驗培養液的培養工藝,分別設置初始pH值為(5.4、6.4、7.4、8.4、9.4),裝液量(25 mL/250 mL、50mL/250mL、75mL/250mL、100mL/250mL、125mL/250mL),接種量為(0.5 mL/100 mL、1.5 mL/100 mL、3.5 mL/100 mL、5.5 mL/100 mL、7.5 mL/100 mL),培養溫度(32 ℃、37 ℃、42 ℃、47 ℃、52 ℃),轉速(100 r/min、150 r/min、200 r/min、250 r/min、300 r/min),培養時間(8 h、14 h、20 h、26 h、32 h),考察初始pH值、裝液量、接種量、培養溫度、轉速、培養時間對枯草芽孢桿菌活菌量及抑菌圈直徑的影響。
1.3.5 發酵工藝優化響應面試驗
(1)Plackett-Burman試驗設計
在單因素試驗基礎上,以枯草芽孢桿菌活菌量及抑菌圈直徑為響應值,選取6個因素初始pH值(A)、轉速(B)、培養溫度(C)、裝液量(D)、接種量(E)、培養時間(F)進行Plackett-Burman(PB)試驗[14]。對6個因素的最優培養條件范圍分別取高、低兩個水平,PB 試驗設計因素與水平見表1。
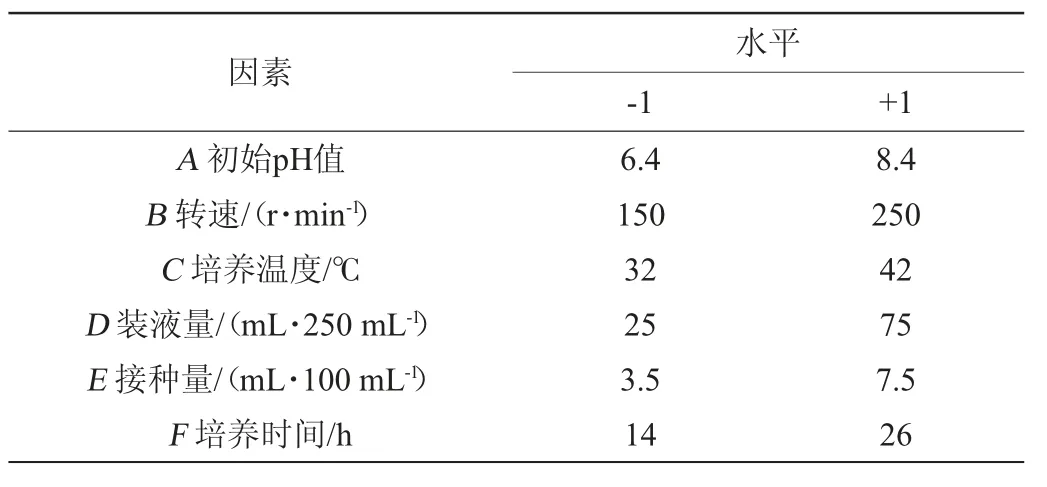
表1 發酵工藝優化Plackett-Burman試驗設計因素與水平Table 1 Factors and levels of Plackett-Burman experiments design for fermentation process optimization
(2)Box-Benhnken試驗設計
根據上述Plackett-Burman(BB)試驗結果,選擇出對結果顯著性影響因素搖瓶轉速(X1)、裝液量(X2)與培養時間(X3)進行Box-Benhnken試驗優化,BB試驗因素及水平見表2。
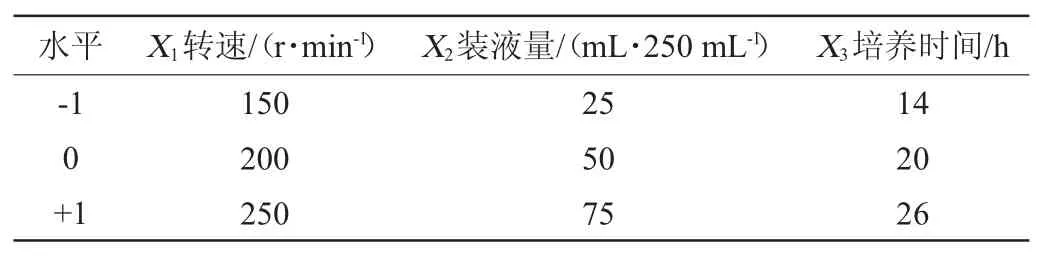
表2 發酵工藝優化Box-Benhnken試驗設計因素與水平Table 2 Factors and levels of Box-Benhnken experiments design for fermentation process optimization
1.3.6 滿意度函數-響應面設計[25]
在單因素試驗的基礎上,通過Plackett-Burman試驗,選擇分析結果較為顯著的因素,以活菌量(Y1)和抑菌圈直徑(Y2)為響應值,為找到合理的優化條件,采用滿意度函數法將兩種響應值進行綜合分析,進行發酵工藝條件的優化。采用一種高可取性的總體滿意度值統計分析法見式(1):
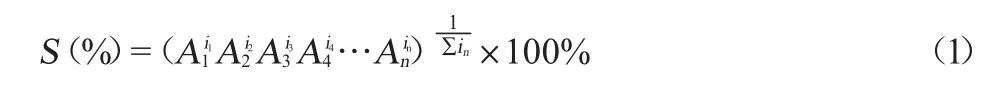
式中:S為總體滿意度值;in為第n個數據響應值的權;An為第n個數據響應的滿意度值,An定義見式(2):
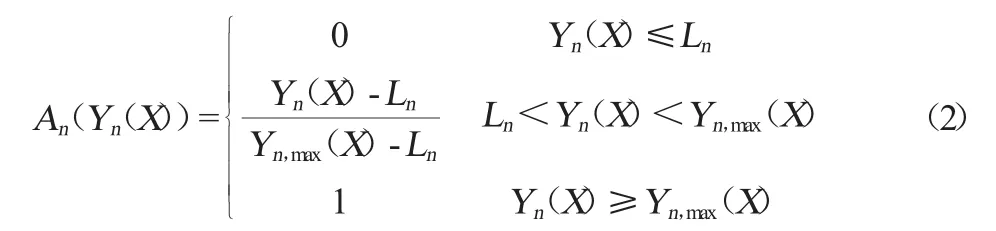
式中:Yn(X)為第n個響應值,Ln為第n個響應值的規定下限,Yn,max(X)為第n個響應值所不能超過的最大上限。
在整個試驗中,發酵液中活菌量對數值均>6.0,抑菌圈直徑>20 mm,因此在滿意度函數計算中,分別規定發酵液中活菌量對數值下限為6.0,抑菌圈直徑下限為20 mm,活菌量對數值不可能超過最大上限9.0,抑菌圈直徑不可能超過最大上限30 mm,即可定義滿意度函數為式(3)和(4)。
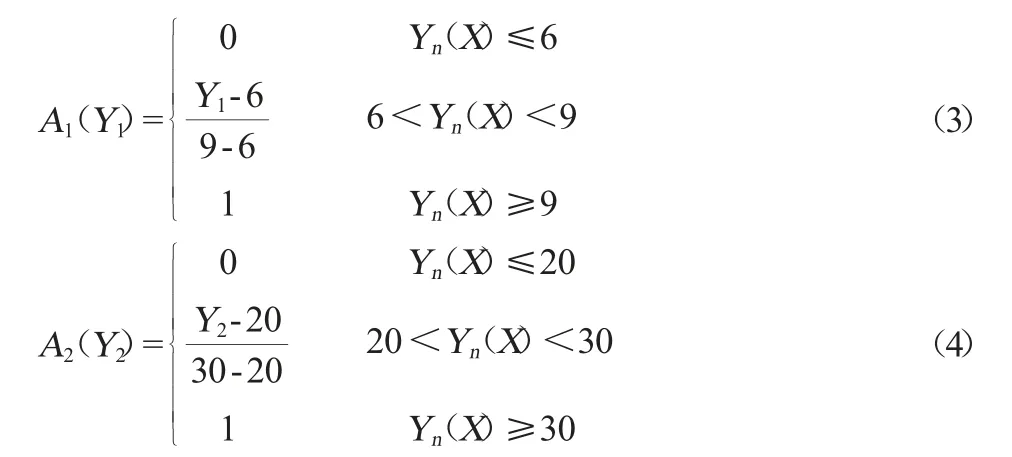
式中:A1和A2分別為發酵液中活菌量和抑菌圈徑的滿意度。取每個滿意度函數的權為1,總體滿意值為S(%)=100%。
1.3.7 數據處理
應用Sigmaplot 14.0、SPSS 21.0對單因素試驗數據進行分析和數據處理,Minitab 19.0進行Plackett-Burman 試驗和滿意度函數分析法-響應面分析數據處理。
2 結果與分析
2.1 發酵工藝優化單因素試驗
2.1.1 初始pH值的影響
培養基中微生物生長繁殖和菌體代謝產物生物合成都有其最適合和能夠耐受的外界環境pH范圍[26]。初始pH值會影響到培養基中菌體細胞膜上的電荷狀態,引起細胞膜的滲透性發生不可逆性改變,進而對培養細菌的吸收營養物質和特定代謝產物能力產生影響,并對發酵液中代謝產物的穩定性同樣有影響[27]。初始pH值對發酵液中活菌量及抑菌能力影響結果見圖1。
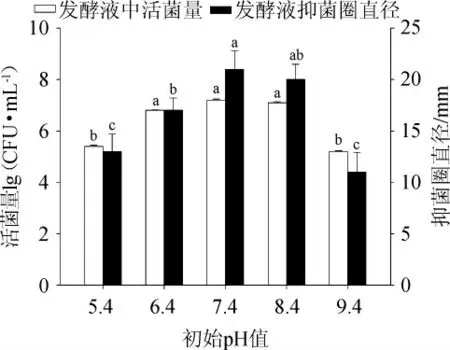
圖1 初始pH值對菌株CGMCC5174發酵性能的影響Fig.1 Effect of initial pH on fermentation performance of strain CGMCC5174
由圖1可知,菌株CGMCC5174初始活菌量對數值為4.27,在初始pH值5.4~9.4范圍內,菌株都有不同程度的增長,但在初始pH值5.4、9.4生長情況不理想,與其他條件差異性顯著(P<0.05)。在范圍7.4~8.4范圍內,菌株抑菌圈直徑之間差異性不顯著(P>0.05)。初始pH值7.4時菌液活菌量對數值為7.2±0.04及抑菌圈直徑為(21.0±1.8)mm,顯著高于其他條件抑菌圈直徑(P<0.05),這是因為初始pH值為7.4時培養環境促進了枯草芽孢桿菌的營養吸收,促進了菌株的生長繁殖,進而分泌出大量的抗菌代謝產物;但初始pH值<7.4或>7.4時都會影響菌株的生理狀態,降低其生長繁殖速度,大大降低其分泌代謝產物的能力。因此,選擇最適初始pH值為7.4。
2.1.2 搖瓶轉速的影響
枯草芽孢桿菌屬于好氧微生物,搖瓶培養可方便地控制通氣量,操作簡單,微生物細胞生長較好[26,28]。搖瓶轉速對發酵液中活菌量及抑菌能力影響結果見圖2。

圖2 搖瓶轉速對菌株CGMCC5174發酵性能的影響Fig.2 Effect of rotating speed on fermentation performance of strain CGMCC5174
由圖2可知,搖瓶轉速<200 r/min時,培養液中枯草芽孢桿菌無法與溶解的氧充分接觸,活菌量及菌株產生抑菌性代謝產物都比較低;而搖瓶轉速>200 r/min時,對細菌細胞容易產生機械損傷,降低了發酵液中活菌量,進而降低細菌代謝產物能力;搖瓶轉速為200 r/min時,發酵液中活菌量具有顯著優勢(P<0.05),200 r/min,250 r/min相對于其他條件抑菌圈直徑顯著優勢(P<0.05),但這兩組之間抑菌圈直徑差異不顯著(P>0.05)。因此,選擇最佳搖瓶轉速為200 r/min。
2.1.3 培養溫度的影響
培養溫度通過影響菌株生長繁殖過程中蛋白質和酶的合成與活性,及其他各種生理代謝反應,從而影響到菌體的生理活動[26,29]。培養溫度對發酵液中活菌量及抑菌能力影響結果見圖3。由圖3可知,42 ℃培養溫度對發酵活菌量影響具有顯著優勢(P<0.05),適宜的生長溫度可以加快細菌細胞分裂,提高發酵液中活菌含量。37 ℃培養溫度對發酵液抑菌圈直徑影響具有顯著優勢(P<0.05),對代謝產物影響較小,可以保持代謝產物抑菌活性。因此,選擇最佳培養溫度為37 ℃。
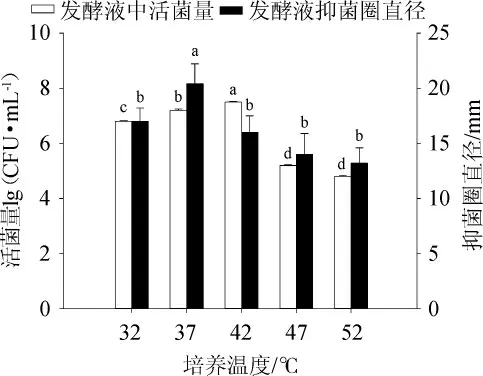
圖3 培養溫度對菌株CGMCC5174發酵性能的影響Fig.3 Effect of culture temperature on fermentation performance of strain CGMCC5174
2.1.4 裝液量的影響
裝液量直接影響到培養液中溶氧量的濃度,而好氧微生物枯草芽孢桿菌在生長繁殖階段還是分泌抑菌代謝產物階段都需要充足的氧氣供應[30]。裝液量對發酵液中活菌量及抑菌能力影響結果見圖4。
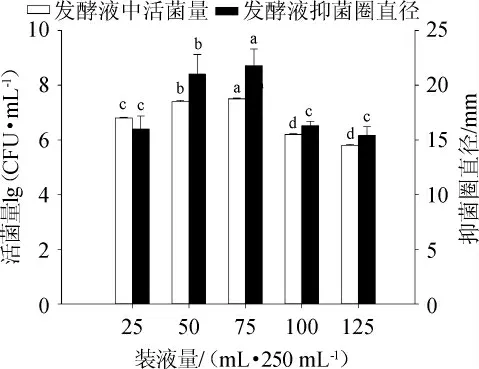
圖4 裝液量對菌株CGMCC5174發酵性能的影響Fig.4 Effect of loaded liquid on fermentation performance of strain CGMCC5174
由圖4可知,裝液量為75 mL/250 mL時菌液活菌量及抑菌圈直徑顯著高于其他條件(P<0.05)。裝液量在25~75 mL/250 mL時,培養液中菌株生長速度會加速,因此產生抑菌代謝產物的活性也會增加;但裝液量>75 mL/250 mL后,培養環境中溶氧量降低,進而使枯草芽孢桿菌活菌量和抑菌代謝產物活性降低。因此,選擇最佳裝液量為75 mL/250 mL。
2.1.5 接種量的影響
接種量對發酵液中活菌量及抑菌能力影響結果見圖5。由圖5可知,接種量5.5 mL/100 mL、7.5 mL/100mL時菌液活菌量及抑菌圈直徑顯著高于其他條件(P<0.05),但這兩組相互之間活菌量及抑菌圈直徑差異不顯著(P>0.05)。接種量在1.5~7.5 mL/100 mL時,發酵液中活菌量升高,接種量>7.5 mL/100 mL后,發酵液中活菌量增緩,與5.5 mL/100 mL之間沒有顯著性差異(P>0.05),可能是因為隨著接種量的增加,培養環境中的營養消耗太快,導致枯草芽孢桿菌增殖過慢,菌株的代謝產物能力也下降[31]。因此,選擇最佳接種量為5.5 mL/100 mL。
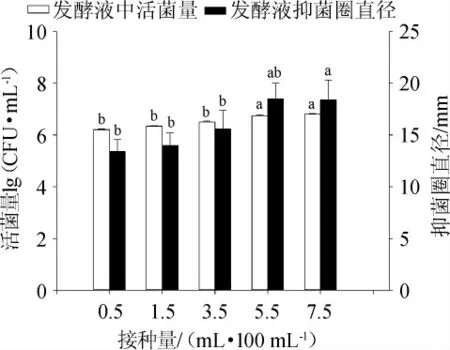
圖5 接種量對菌株CGMCC5174發酵性能的影響Fig.5 Effect of inoculum on fermentation performance of strain CGMCC5174
2.1.6 培養時間的影響
培養時間有利于微生物生長繁殖及其代謝產物富集,枯草芽孢桿菌長時間培養后,抑菌有效成分累積達到理想狀態,但到一定程度后,增速變緩,經濟效益降低[32]。發酵時間對發酵活菌量及抑菌能力影響結果見圖6。由圖6可知,培養時間為8~14 h對發酵活菌量呈現顯著增長(P<0.05),使細胞生長繁殖由快速生長轉為穩定發育期;培養26 h條件對發酵液抑菌圈直徑顯著優勢(P<0.05),活菌生長繁殖進入穩定發育,但其代謝產物產量同時在增加,但培養時間>26 h之后,培養液中代謝產物累積產量會制約細胞維持抑菌物質合成的高效率,抑菌產物生產速率平緩降低。因此,選擇最佳培養時間為20 h。
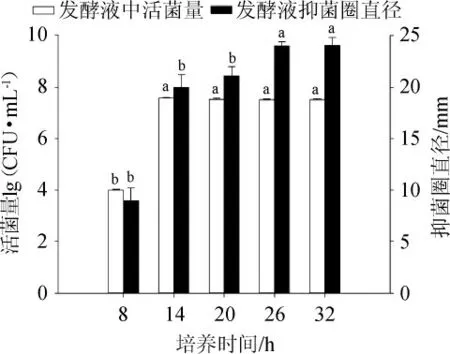
圖6 培養時間對菌株CGMCC5174發酵性能的影響Fig.5 Effect of fermentation time on fermentation performance of strain CGMCC5174
2.2 發酵工藝優化Plackett-Burman試驗
在單因素試驗基礎上,以活菌量(Y1)和抑菌圈直徑(Y2)為響應值,選取初始pH值(A)、轉速(B)、培養溫度(C)、裝液量(D)、接種量(E)、培養時間(F)6個因素,按照Plackett-Burman試驗設計,在不同發酵培養條件下進行試驗,結果見表3。
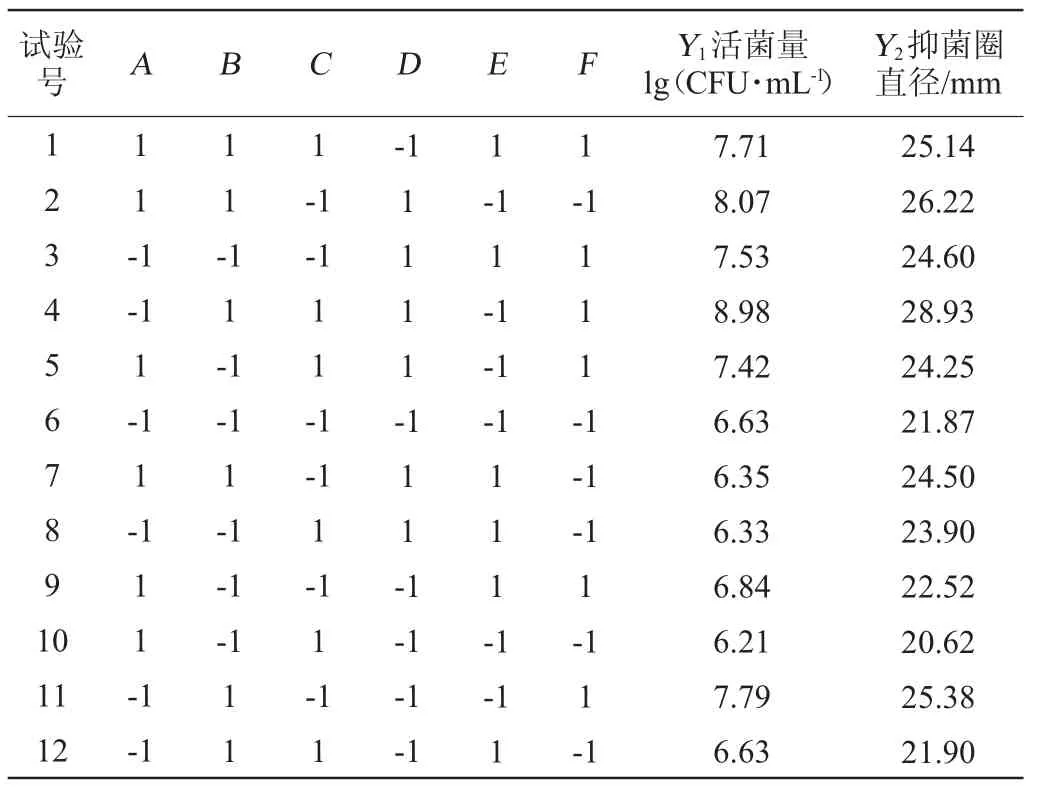
表3 發酵工藝優化Plackett-Burman試驗設計結果Table 3 Results of Plackett-Burman experiments design for fermentation process optimization
用Minitab19.0軟件對表2試驗數據進行處理,分析各因素的顯著性,結果分別見表4和5。由表4和5可知,當以活菌量為響應值時,轉速與培養時間有顯著影響(P<0.05);當以抑菌圈直徑為響應值時,轉速、裝液量與培養時間具有顯著影響(P<0.05)。
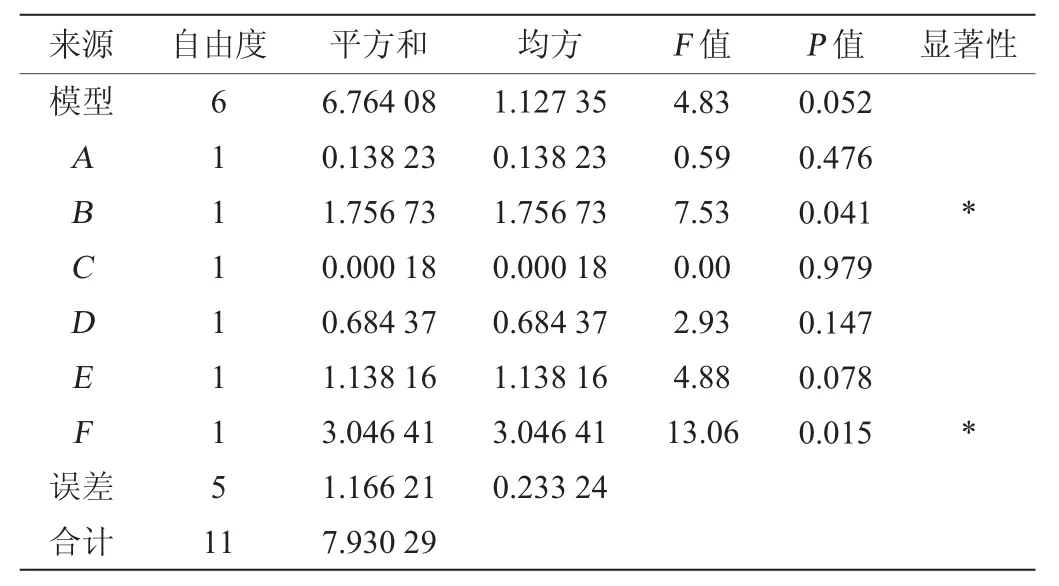
表4 以活菌量為響應值Plackett-Burman試驗結果方差分析Table 4 Variance analysis of Plackett-Burman experiments results using viable bacteria as response value
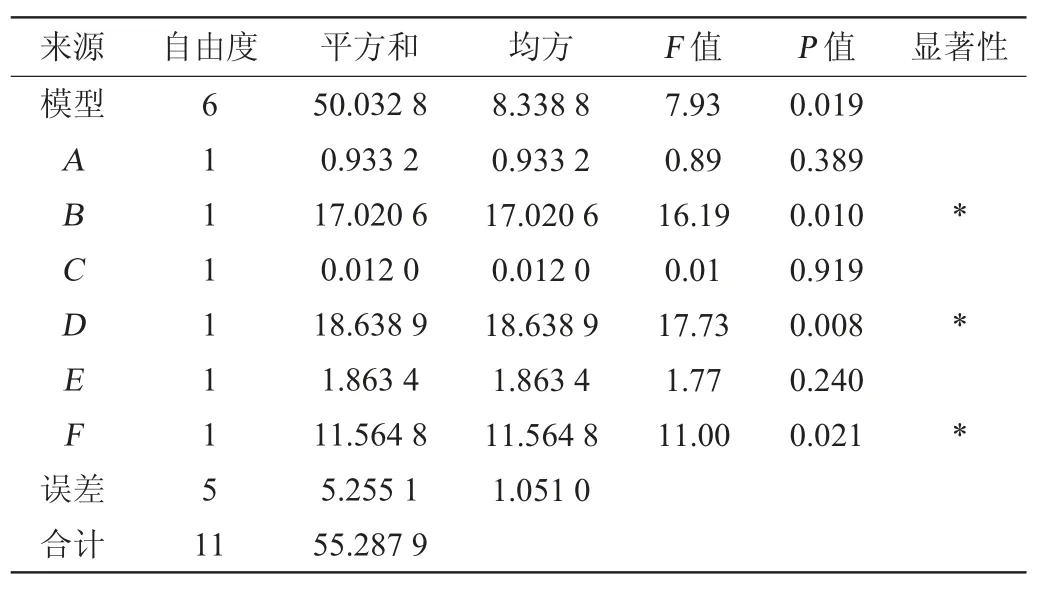
表5 以抑菌圈直徑為響應值Plackett-Burman試驗結果方差分析Table 5 Variance analysis of Plackett-Burman experiments results using inhibition zone diameter as response value
2.3 發酵工藝優化Box-Benhnken試驗設計
將總體滿意度值S作為綜合響應指標,采用Box-Benhnken試驗對發酵條件進行優化,BB試驗設計及結果見表6,方差分析結果見表7。
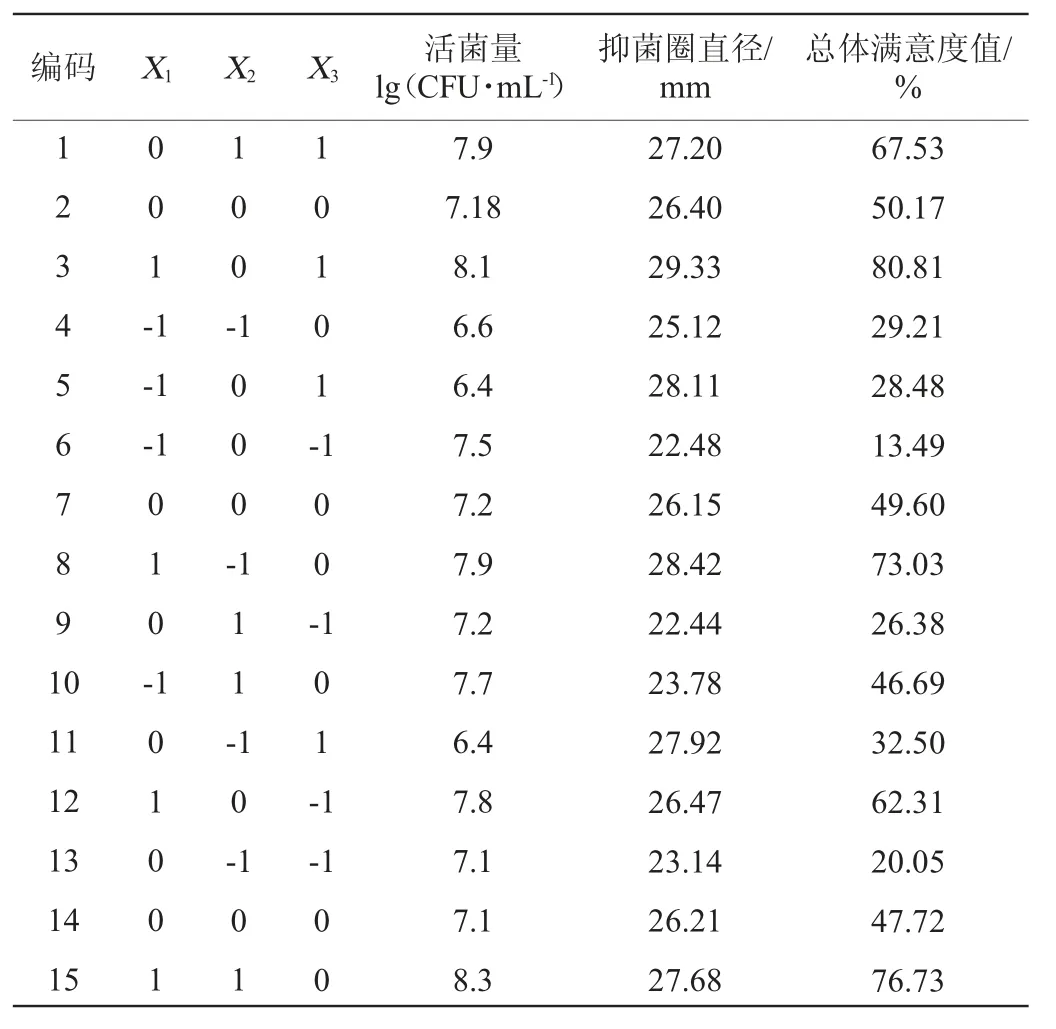
表6 發酵工藝優化Box-Benhnken試驗設計結果Table 6 Results of Box-Benhnken experiments design for fermentation process optimization
用Minitab 19.0軟件對試驗數據進行處理,得到相應的多元擬合回歸方程為S=26.253+1.551X1-0.2X2+2.3X3+0.710X12-0.713X22-0.365X32+0.150X1X2-0.692X1X3-0.005X2X3
由表7可知,該回歸模型中的F=52.35,P<0.05,表明該多元回歸方程模型效果顯著,擬合度較佳。其中X1、X2和X3均對響應值有顯著性影響(P<0.05),XX3的交互作用對響應值有顯著性影響(P<0.05),X1與X2、X2和X3的交互作用均對總體滿意度值影響不顯著(P>0.05)。
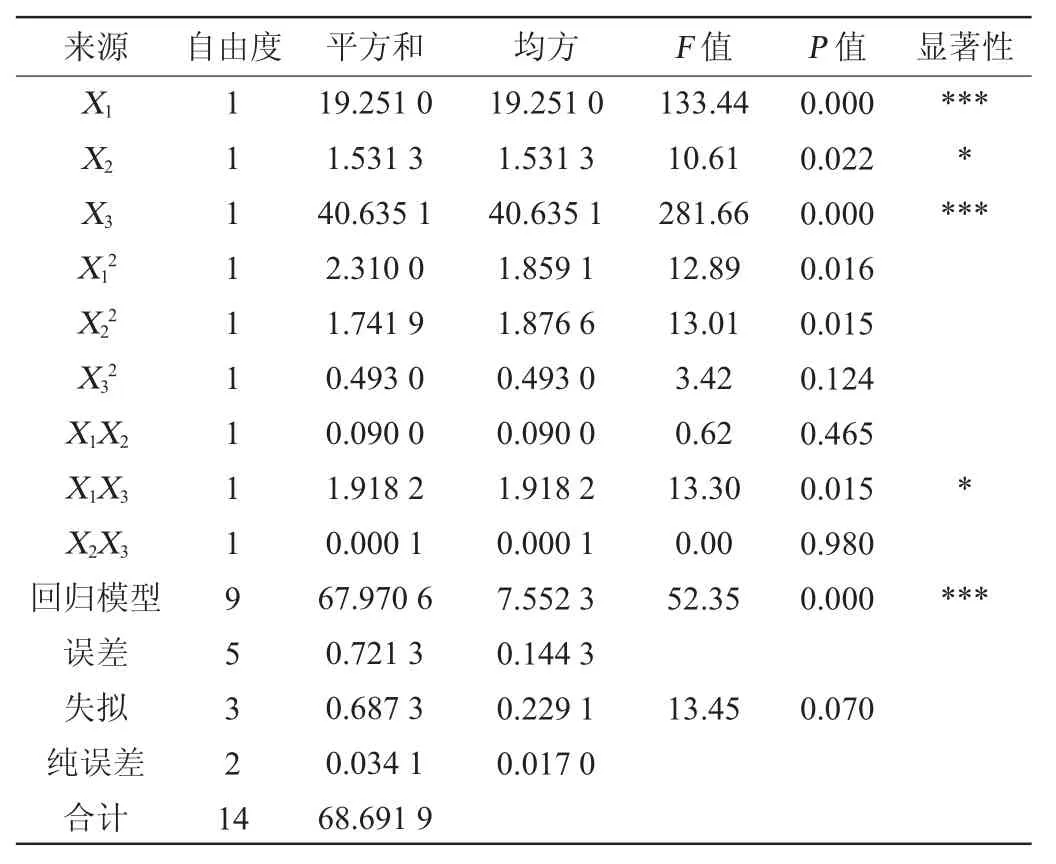
表7 回歸模型方差分析Table 7 Variance analysis of regression model
由表7可知,失擬項檢驗的F=13.45,P=0.07>0.05,說明該模型擬合程度良好,可以預測發酵工藝最佳條件。由響應面分析預測枯草芽孢桿菌生產的最佳效果為總體滿意度為93.95%,最佳發酵工藝條件為搖瓶轉速248.75 r/min、裝液量74.21 mL/250 mL、培養時間25.31 h。在此優化條件下,發酵液中活菌量對數理論值為8.19,發酵液抑菌圈直徑理論值為28.9 mm。
結合實際生產工作情況,調整枯草芽孢桿菌發酵工藝為:搖瓶轉速250 r/min、裝液量75 mL/250 mL、培養時間25 h。在此工藝條件下進行3次平行驗證試驗,得到發酵液中活菌量對數實際值為8.03±0.6,抑菌圈直徑實際值為(28.2±1.3)mm,分別較優化前提高了1.32倍、1.73倍。結果表明,采用滿意度函數-響應面發多枯草芽孢桿菌發酵生產活菌菌體和抑菌物質工藝的優化是可行的。
3 結論
兼顧枯草芽孢桿菌CGMCC5174微生物菌體和發酵液中的抑菌物質兩者的生產,避免資源浪費,增加生產效益,降低環境污染。分析了工藝單因素下的最佳生產條件,并結合PB試驗、滿意度函數分析及響應面分析方法,避免了多個預定指標的相互影響,排除客觀噪聲污染,這是一種快速、經濟、重復性良好的生產試驗設計方法。最后,枯草芽孢桿菌CGMCC5174最佳發酵工藝條件為:初始pH值為7.4,裝液量75 mL/250 mL,接種量為5.5 mL/100 mL,培養溫度37 ℃,轉速為250 r/min,培養時間25 h。在此最佳發酵條件下,活菌量對數值為8.03±0.6,抑菌圈直徑為(28.2±1.3)mm,分別較優化前提高了1.32倍、1.73倍。

