大腸桿菌CRISPR/Cas9基因編輯系統的建立及驗證
卞曉萍,劉 青,孔慶科,羅洪艷,李 沛
(西南大學 動物科技學院,重慶 北碚 400700)
目前廣泛應用于大腸桿菌基因敲除的方法有噬菌體重組酶介導的λ-Red重組系統,該技術的原理是將一段攜帶有靶基因兩側各40~60 bp 同源序列的 PCR 產物或合成的寡核苷酸片段,通過電轉化法導入宿主菌內,然后在Red重組酶的作用下,使導入宿主菌內的線性 DNA 片段與基因組上的特定靶序列進行高效的同源重組,從而將靶基因置換下來[1-2]。雖然λ-Red同源重組系統是細菌基因敲除的有力技術,但是通過FLP重組酶去除抗生素標記會在細菌的基因組上留下FRT疤痕[3]。在標準λ-Red同源重組系統中,每個轉入的線性 DNA 片段均編碼一個選擇性的抗生素抗性標記,其兩側的FLP位點是 FRT疤痕的來源。如果使用該方法在同一個細菌中引入多個突變,則每次突變成功后遺留下的FRT疤痕都會影響下一個突變的成功率,比如:FLP重組酶可能會消除基因組上任意兩個相鄰的FRT位點,得到并非我們想要的突變;同時,過多的疤痕會使宿主菌的基因組變得不穩定,有可能發生基因組的重排[4]。本研究應用的無痕缺失方法與此相反,不會留下任何疤痕。除了λ-Red重組系統,自殺質粒介導的同源重組基因敲除方法也應用較為廣泛,但該方法對某些保守且敲除困難的基因篩選效率極低,這也限制了該技術的應用。
在細菌和古細菌中發現的CRISPR(clustered regularly interspaced short palindromic repeats)與Cas蛋白共同作用可協助細菌抵御外源質粒、噬菌體等的侵害。其中,在嗜熱鏈球菌(Streptococcusthermophilus)中發現的Ⅱ型 CRISPR/Cas9系統組分較為簡單,操作較容易,是目前研究的熱門工具,也是本研究所應用的CRISPR/Cas系統。CRISPR/Cas9系統需要轉錄兩個RNA片段,一個是前體CRISPR(precursorCRISPR RNA,pre-crRNA),另一個是轉錄激活 RNA(trans-activating RNA,tracrRNA)。這兩個RNA通過堿基配對形成二聚體,與Cas9蛋白結合,形成復合物;然后,在pre-crRNA的介導下發揮Cas9蛋白的HNH與RuvC活性,切割基因組特定位置的DNA,形成DNA雙鏈斷裂[8]。JINEK等[9]將pre-crRNA和tracrRNA加工成一條單鏈RNA嵌合體,稱之為gRNA。CRISPR/Cas9中gRNA的3′端還有一段小的前間區序列鄰近基序( protospacer adjacent motifs,PAM),目前證明PAM一般為NGG,是CRISPR/Cas9系統的必備區域。因為Cas9蛋白的切割作用不僅依靠crRNA序列與目標序列的堿基匹配,還要依靠與目標序列緊鄰的PAM序列。若沒有PAM序列或者該序列發生改變,那么Cas9蛋白就不能發揮作用,這也將限制CRISPR/Cas9系統的作用,使其不能應用在任意序列上,但是這種機制也使該系統能分清自身和外來的入侵者。基于CRISPR/Cas9這一優越的基因編輯工具,本研究以大腸桿菌W3310為背景菌株,建立大腸桿菌CRISPR/Cas9基因編輯系統,對其waaL和wecA基因進行敲除,從而為大腸桿菌工程菌的構建奠定基礎。
1 材料與方法
1.1 菌株、質粒、培養基和抗生素E.coliTop10和E.coliW3110由本實驗室保存。pCas9-CR4(#62655)、pKDsgRNA-p15(#62656)購自Addgene,其中,pKDsgRNA-p15是溫敏型質粒;pKDsgRNA-Kan、pKDsgRNA-kan-DwaaL、pKDsgRNA-kan-DwecA由本研究構建,pSW3337-kan由本實驗室保存。培養基為LB培養基。抗生素:氨芐青霉素(ampicillin)終質量濃度100 mg/L,卡那霉素(kanamycin)終質量濃度50 mg/L,氯霉素(chloramphenicol)終質量濃度25 mg/L,強力霉素(doxycycline)終質量濃度1 mg/L,阿拉伯糖終濃度0.2%。
1.2 主要試劑胰蛋白胨、酵母提取物、氯化鈉和瓊脂粉購自英國 OXOID公司;氯霉素、氨芐青霉素、卡那霉素、Tet啟動子誘導劑強力霉素和阿拉伯糖購自生工生物工程(上海) 股份有限公司;Gibson assembly?master mix購自美國 NEB 公司;PrimerStar高保真酶購自大連寶生物公司;2×prime mix、DNA 產物純化試劑盒、質粒提取試劑盒及Marker Ⅲ購自天根生化科技(北京)有限公司。
1.3 PCR引物根據GenBank中公布的W3110菌株waaL和wecA的基因序列,用Snapgene軟件設計引物(表1),并送往生工生物工程(上海) 股份有限公司合成。
1.4 pKDsgRNA-kan-DwaaL質粒的構建原質粒pKDsgRNA-p15是壯觀霉素抗性,為了后續的研究方便,將其換成卡那霉素抗性,并命名為pKDsgRNA-kan。通過網站http://crispor.tefor.net/crispor.py設計waaL基因的Spacer,然后將Spacer的20 bp序列加入引物gRNA-DwaaL-1F的5′端。以質粒pKDsgRNA-kan為模板,gRNA-DwaaL-1F和pair with F、pair with R和gRNA-DwaaL-2R為引物,使用PrimerStar高保真酶PCR擴增片段1和片段2。PCR產物經核酸凝膠電泳鑒定、回收后,用環形PCR法連接片段1和片段2[10]。獲得的產物電轉化至E.coliTop10感受態細胞中,小提質粒,用測序引物pKD_Seq5測序鑒定。將構建好的質粒命名為pKDsgRNA-kan-DwaaL。
1.5waaL基因同源修復供體DNA片段的擴增以E.coliW3110基因組為模板,DwaaL-1F和DwaaL-1R、DwaaL-2F和DwaaL-2R為引物,使用PrimerStar高保真酶PCR擴增片段3和片段4。PCR產物經核酸凝膠電泳鑒定、回收后,以DwaaL-1F和DwaaL-2R為引物,使用PrimerStar高保真酶將片段3和片段4用重疊延伸PCR法擴增同源修復供體DNA片段。
1.6 感受態細胞的制備及細菌的轉化按照《分子生物學實驗技術》中的方法制備E.coliW3110電轉化感受態細胞。將pCas9-CR4質粒轉化至該感受態細胞中,制備含有pCas9-CR4質粒的E.coliW3110電轉化感受態細胞。將質粒pKDsgRNA-kan-DwaaL轉化至感受態細胞中,最后制備同時含有pCas9-CR4和pKDsgRNA-kan-DwaaL質粒的E.coliW3110電轉化感受態細胞。本次制備感受態與前兩次不同,感受態細胞在30℃生長至D600=0.8,然后加入終濃度0.2%的阿拉伯糖,繼續培養30 min,以誘導重組酶基因的表達,最后再制備電轉化感受態細胞[11]。將200~1 000 ng供體DNA加入到感受態細胞中,電轉產物復蘇后,稀釋100倍,涂布于含卡那霉素、氯霉素以及強力霉素(1 mg/L)的LB平板上,30℃過夜培養,用引物DwaaL-1F和DwaaL-2R鑒定單克隆。

表1 引物序列
1.7 pKDsgRNA-kan-waaL質粒的消除將鑒定正確的突變株轉接至LB液體培養基中,置于37℃過夜培養以消除pKDsgRNA-kan-DwaaL溫敏質粒。圖1為敲除模式示意圖。
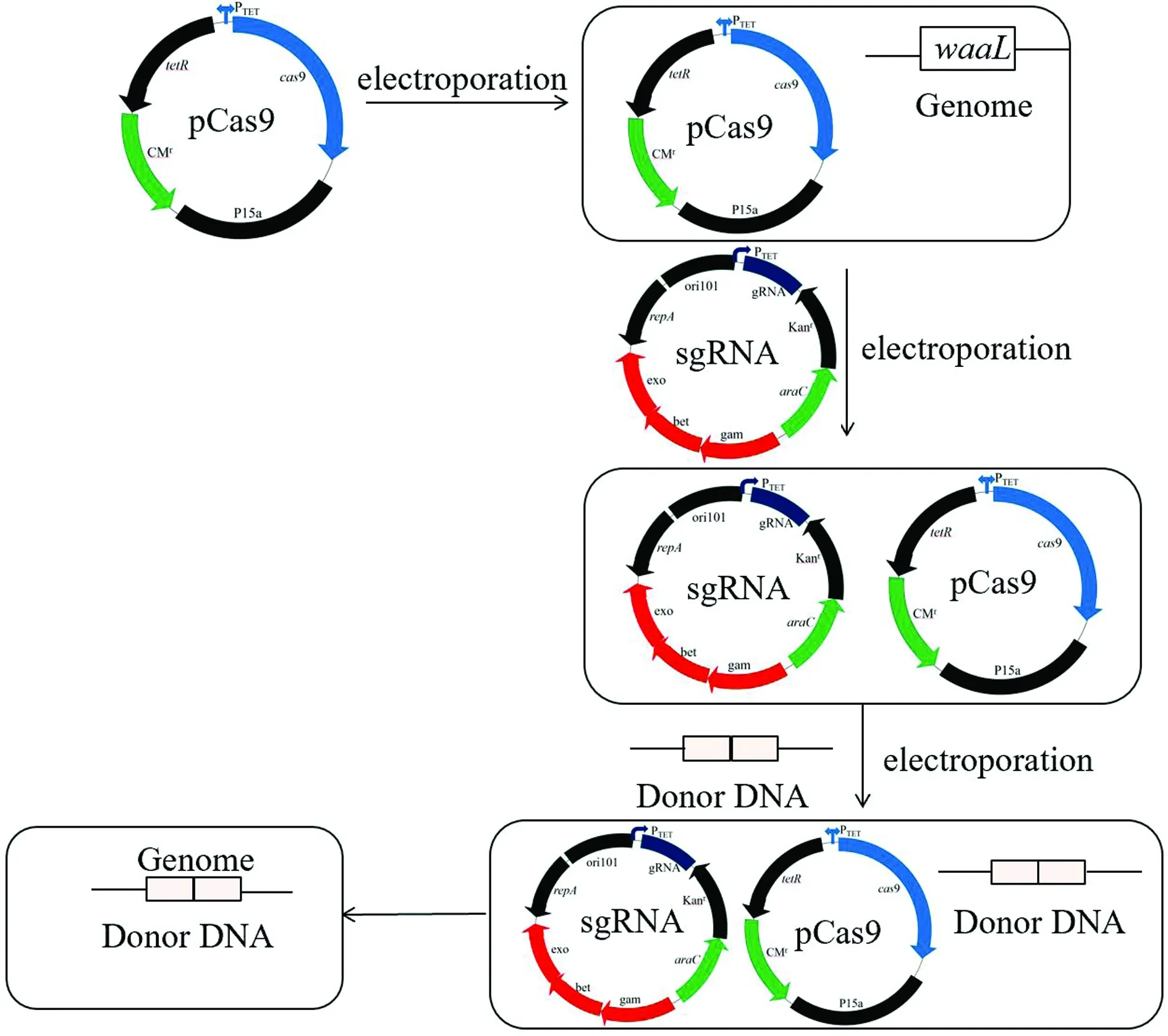
圖1 CRISPR/Cas9系統敲除基因示意圖[10]
1.8wecA基因的敲除為驗證該系統能夠有效地應用于大腸桿菌的基因敲除,用同樣的方法將大腸桿菌W3110的wecA基因進行敲除。
1.9 pCas9-CR4質粒的消除由于pCas9-CR4質粒是p15a的復制子,而pKDsgRNA-kan質粒上的Spacer是針對p15a的復制子,因此將pKDsgRNA-kan質粒轉入已敲除目的基因的宿主菌中,涂布于只含卡那霉素的LB瓊脂平板上,置于30℃培養。挑取轉化子檢測其對氯霉素的抗性,若對氯霉素敏感,則已消除pCas9-CR4質粒。隨后37℃過夜培養即可消除轉入的pKDsgRNA-kan溫敏質粒。
2 結果
2.1 pKDsgRNA-kan質粒的構建以pKDsgRNA-p15為模板,pKDsgRNA-2F和pKDsgRNA-2R為引物擴增pKDsgRNA載體DNA片段a;以pSW-3337-kan為模板,pKDsgRNA-1F-kan和pK-DsgRNA-1R為引物擴增卡那霉素基因 DNA片段b(圖2)。將擴增產物經核酸凝膠電泳鑒定、回收后,用環式PCR法連接2個DNA片段,連接產物轉化至E.coliTop10感受態細胞中。小提質粒,命名為pKDsgRNA-kan,并將其送至生工生物工程(上海) 股份有限公司測序,測序結果與預期序列一樣,可用于下一步試驗。
M.DNA Marker;1.DNA fragment a;2.DNA fragment b
2.2 pKDsgRNA-kan-waaL質粒的構建用PrimerStar高保真酶擴增片段1、片段2(圖3),產物經核酸凝膠電泳鑒定、回收后,用Gibson assembly?master mix組裝,組裝產物轉化到E.coliTop10感受態細胞中,小提質粒,命名為pKDsgRNA-kan-waaL,并將其送至生工生物工程(上海) 股份有限公司測序,測序結果顯示Spacer與gRNA序列與預期序列一樣(圖4),可用于下一步試驗。
M.DNA Marker;1.DNA fragment 1;2.DNA fragment 2
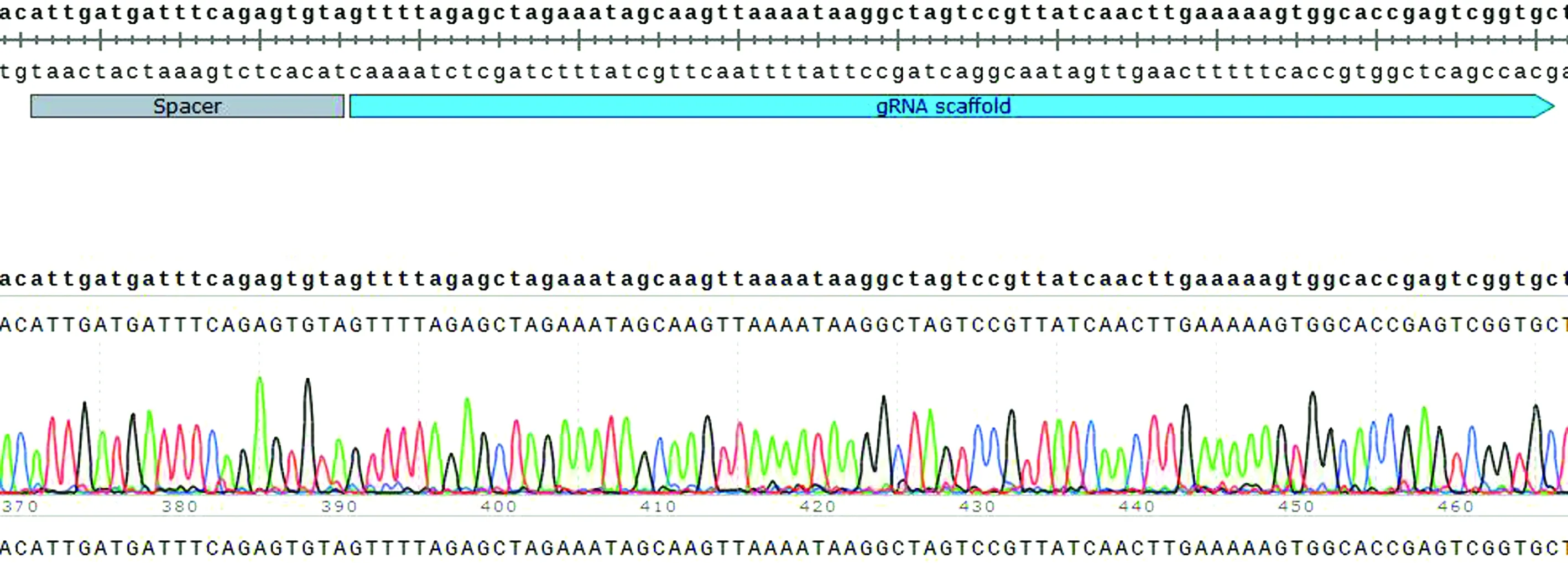
圖4 pKDsgRNA-kan-DwaaL質粒Spacer與gRNA測序圖
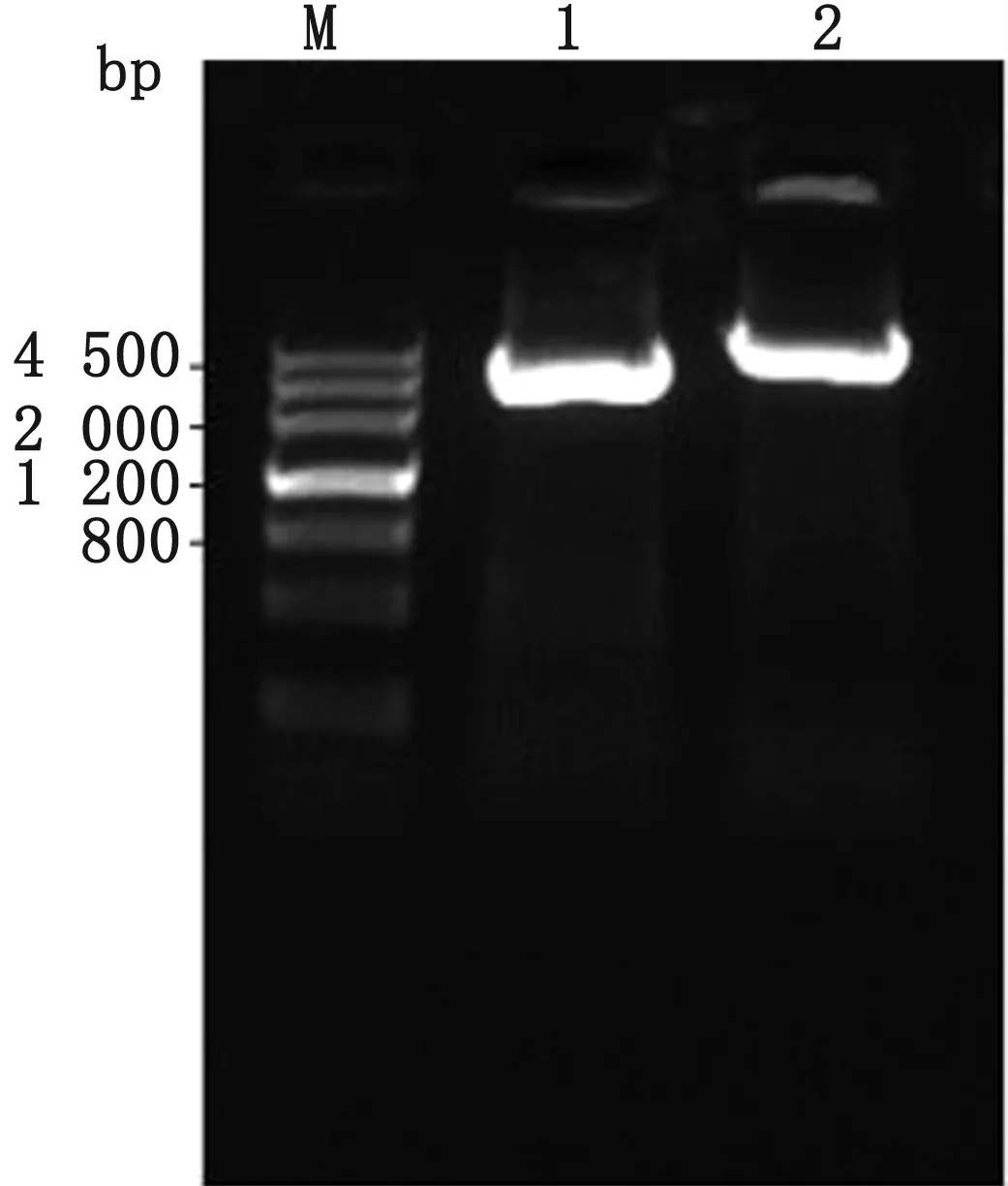
2.3waaL基因同源修復供體DNA的擴增以提取的W3110基因組為模板,DwaaL-1F和DwaaL-1R為引物擴增DNA片段3,DwaaL-2F和DwaaL-2R為引物擴增DNA片段4,核酸凝膠電泳結果與預期條帶大小均一致(圖5)。回收上下同源臂,通過重疊延伸PCR法將上下同源臂融合,核酸凝膠電泳結果與預期條帶大小均一致(圖6)。
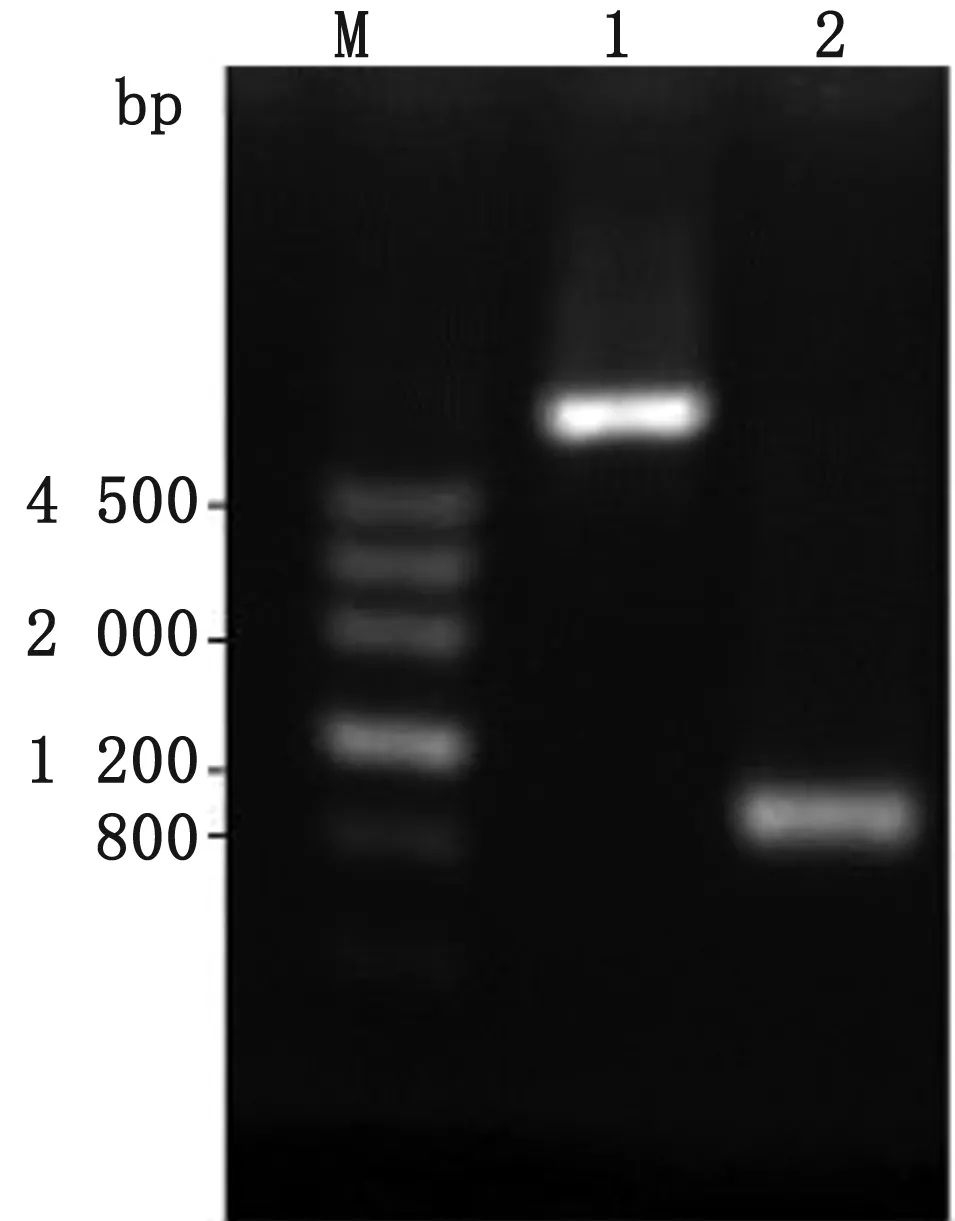
2.4waaL基因的敲除通過電轉化法將供體DNA轉入含pCas9-CR4和pKDsgRNA-kan-DwaaL質粒的E.coliW3110,轉化產物涂布于含氯霉素、卡那霉素以及強力霉素的LB瓊脂平板。待平板上長出單克隆,用引物DwaaL-1F和DwaaL-2R對單克隆進行鑒定(圖7)。waaL基因沒有被敲除修復的菌,PCR顯示約2 000 bp的條帶,反之出現754 bp的條帶。測序結果與設計的同源臂序列一致,表明敲除后的waaL基因在人工設計的供體序列下發生了同源修復。
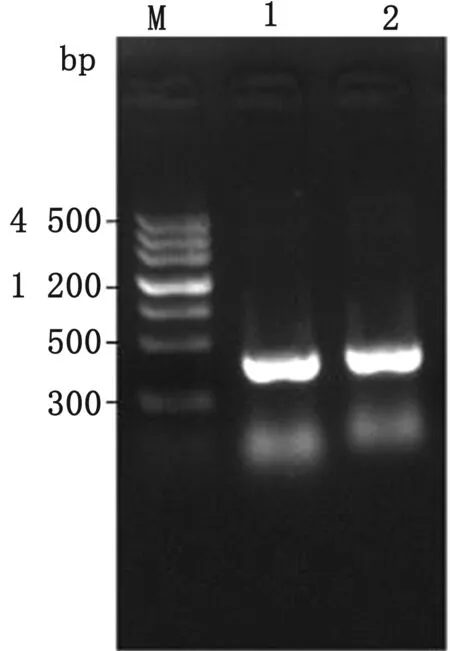
M.DNA Marker;1.DNA fragment 3;2.DNA fragment 4
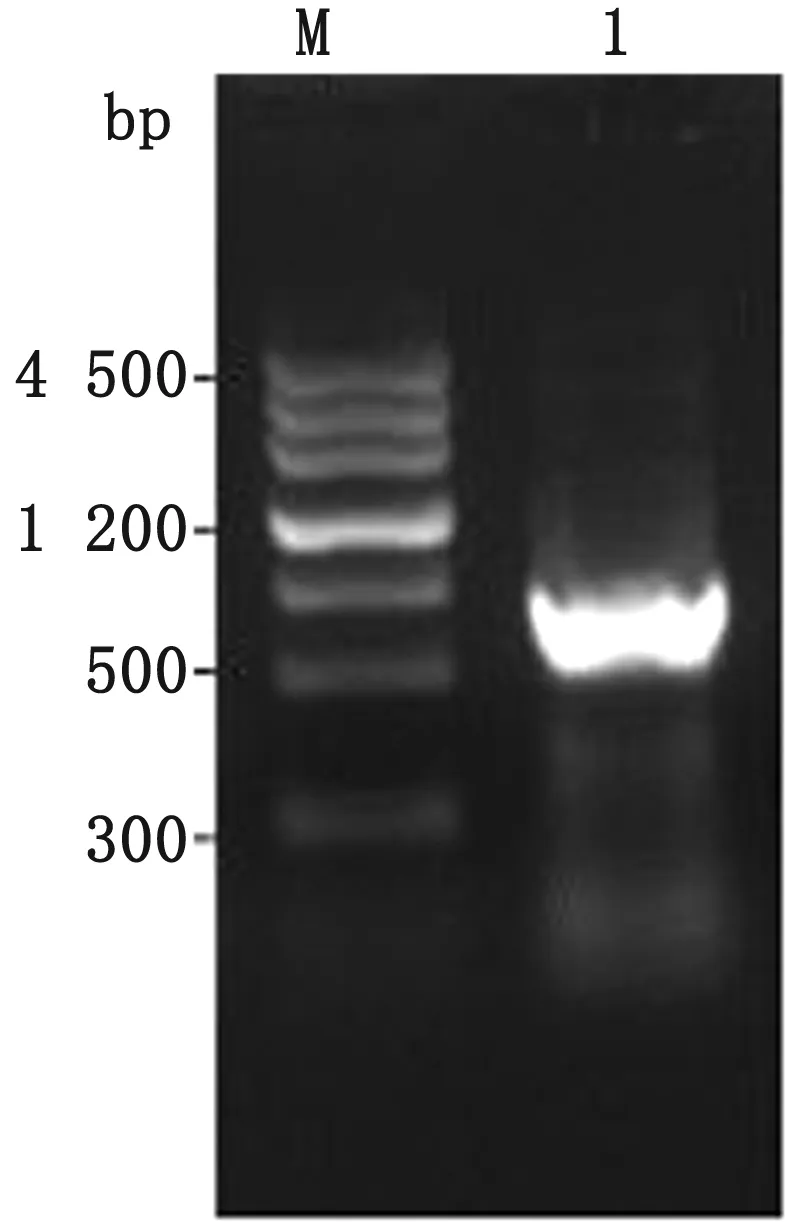
M.DNA Marker;1.overlap DNA fragment
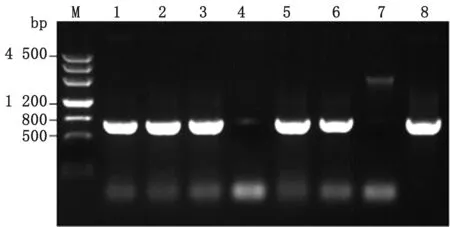
M.DNA Marker;1~6.PCR identification of waaL gene in W3110;7.Negative control;8.Positive control
2.5wecA基因的敲除為驗證該系統能夠確切地應用于大腸桿菌基因的敲除,對W3110的wecA基因進行敲除。構建pKDsgRNA-kan-DwecA質粒的DNA片段擴增結果如圖8所示,該質粒測序結果如圖9所示,同源修復供體DNA的擴增如圖10所示。轉化子鑒定如圖11所示,測序結果與設計的同源臂序列一致,表明敲除后的wecA基因在人工設計的供體序列下發生了同源修復。以上結果均表明,本研究構建的CRISPR/Cas9系統在人工同源修復下,可對大腸桿菌基因進行高效敲除。

M.DNA Marker;1.DNA fragment 1;2.DNA fragment 2
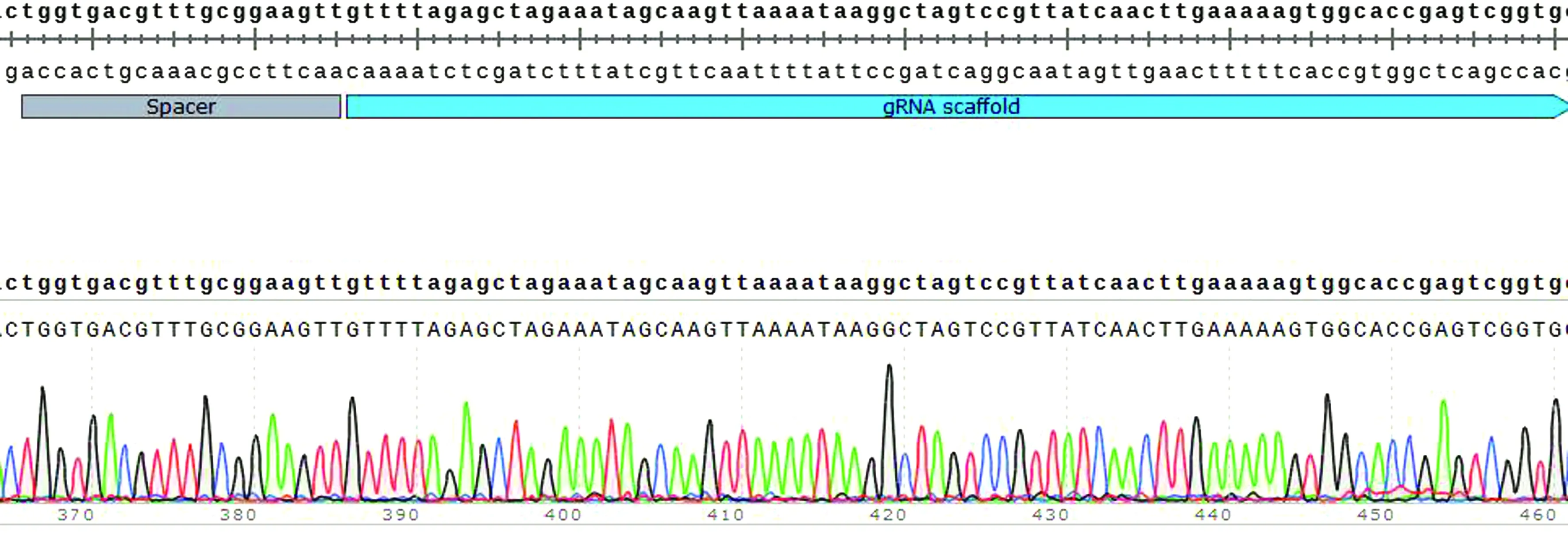
圖9 pKDsgRNA-kan-DwecA質粒測序圖
3 討論
雖然CRISPR/Cas系統最初是在細菌中發現的,但是大多數基于CRISPR/Cas系統的基因編輯則廣泛應用于真核生物中[1,11]。與真核生物不同,細菌的非同源末端連接(non-homologous end-joining,NHEJ)修復能力比較弱,且在許多情況下,若無外源重組酶的協助,其同源定向修復(homology-directed repair,HDR)也不一定有效,因此CRISPR/Cas9系統誘導的基因組DNA雙鏈斷裂對細菌而言往往是致死性的。基于細菌的這一特點,研究者將CRISPR/Cas9系統與噬菌體重組酶介導的λ-Red重組系統相結合,使得供體DNA序列不需要克隆到載體上,可以直接轉化DNA片段的PCR產物,從而提升CRISPR/Cas9誘導的同源修復效率,實現對大腸桿菌基因組更高效的編輯[12]。
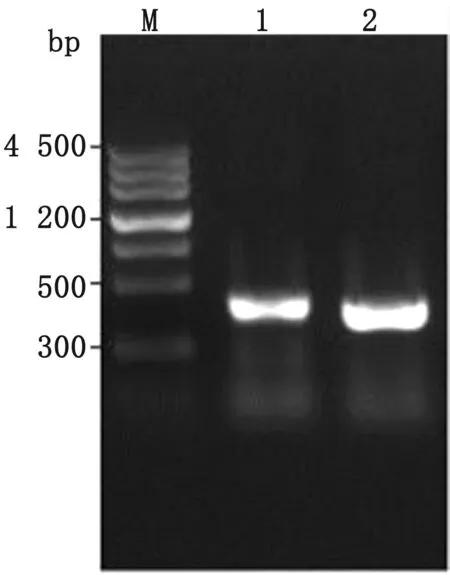
M.DNA Marker;1.wecA gene homology repair DNA fragment 1;2.wecA gene homology repair DNA fragment 2;3.wecA gene homology repair DNA fragment fusion
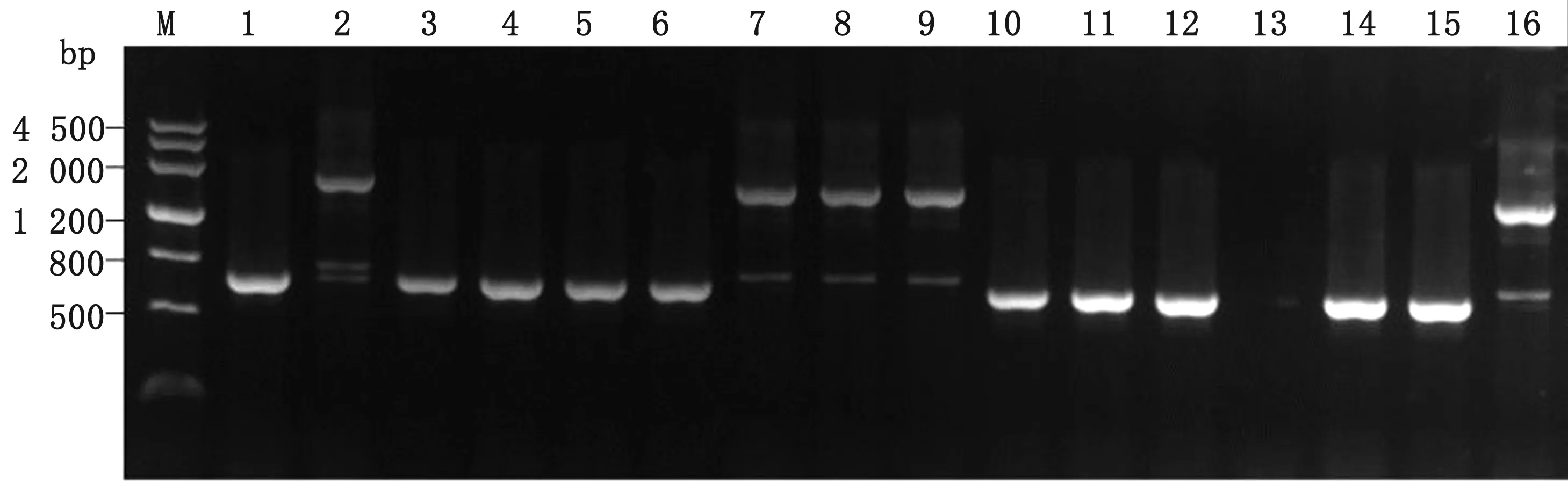
M.DNA Marker;1~14.PCR identification of wecA gene in W3110;15.Positive control;16.Negative control
與以往應用于原核生物中的CRISPR/Cas9系統相比,本研究所用的CRISPR/Cas9無痕缺失系統無需使用任何選擇性標記即可進行單步基因組改變,該系統含有靶向宿主細胞基因組的非溫敏型pCas9-CR4和溫敏型pKDsgRNA-kan兩個質粒[11]。當運用該系統成功缺失一個基因后,若需繼續缺失下一個基因,則可快速高效地消除溫敏型pKDsgRNA-kan質粒;此時,由于宿主菌中仍含有非溫敏型pCas9-CR4質粒,因此可直接用于下一個基因的缺失,無需再次轉化pCas9-CR4質粒,這大大提高了試驗效率。pCas9-CR4和pKDsgRNA-kan質粒都含有Tet調控表達系統,當無誘導藥物(如強力霉素)存在時,TetR阻遏蛋白會與TetO操縱子結合,從而阻斷Cas9蛋白和sgRNA的表達;當有誘導藥物存在時,TetR阻遏蛋白的構象會發生改變,并從TetO操縱子上脫離下來,使得Cas9蛋白和sgRNA可以同時順利表達,繼而發揮CRISPR/Cas9系統的剪切基因組作用。為了更加嚴謹地調控表達Cas9蛋白,在Cas9蛋白相應序列的C末端添加了SsrA標簽,SsrA標簽可被ClpP蛋白酶識別;當Cas9蛋白“漏”表達時,由于SsrA標簽的存在,ClpP蛋白酶可快速高效地降解Cas9蛋白,這使Cas9蛋白的調控表達更加嚴謹。該質粒還含有由阿拉伯糖誘導型啟動子araCPBAD調控表達的Red 同源重組系統,以提高大腸桿菌同源重組效率。該系統與在真核生物中使用的CRISPR/Cas9系統情況不同,在大腸桿菌中,CRISPR/Cas9系統的主要作用不是用來“編輯”,而是用來篩選(負篩);用來去除那些沒有發生基于修復片段(供體DNA)同源重組的菌株,留下那些經同源重組修復后的突變株,其強大的負篩系統確保了較高的突變效率。JIANG等[13]也將CRISPR/Cas9系統與λ-Red 重組結合,與本試驗應用的CRISPR/Cas9系統相比,本研究的2個質粒包含所需的所有組件,不需要額外的修飾,并且沒有宿主特異性。除此之外,本研究所應用的方法在做單突變時,需要5 d,包括gRNA靶向所需的所有克隆步驟,這與其他基因敲除方法所需時間差不多。但是,在做多個突變時,由于宿主菌已經包含pCas9-CR4質粒,后續的試驗可在短短3 d之內完成,這大大提高了試驗效率。
綜上,本研究應用 CRISPR/Cas9 系統,在大腸桿菌W3110菌株中建立起利用該系統進行基因敲除的試驗平臺,并獲得了高效率的突變株。該方法高效簡單,經濟快捷,為構建大腸桿菌基因工程菌奠定了基礎。

