具有梯級釋藥性能的核殼型雙重載藥微球
尹微虹,巨曉潔,2,謝銳,2,汪偉,2,劉壯,2,褚良銀,2
(1 四川大學化學工程學院,四川成都610065;2 四川大學高分子材料工程國家重點實驗室,四川成都610065)
聚合物微球作為藥物載體具有能控制藥物釋放速度、延長藥物作用時間、減少藥物不良反應、降低用藥劑量和實現靶向遞送等優點[1],但結構組成單一的聚合物載藥微球的釋藥模式比較單一,通常是受外界物理[2]或化學[3]刺激讓微球溶脹、坍塌、收縮或溶解實現負載藥物的快速釋放,或依靠微球基材本身的溶蝕過程實現緩慢釋藥,這在一定程度上限制了載藥微球在臨床上的應用。大多數疾病的臨床癥狀復雜多樣,單一藥物以及單一釋藥模式不能達到最好的治療效果。例如,在組織工程中的關節置換手術中,臨床植入失敗的主要原因是細菌感染和植入體松動[4],對此不僅需要術后在植入體部位快速釋放較大劑量的抗菌藥物,使局部血藥濃度短時間內達到治療水平,有效預防細菌感染[5];而且,需要后續能持續釋放促成骨藥物,保證植入體部位的藥物濃度一直處于有效范圍,促進植入體與宿主骨的整合[6]。針對類似這樣的臨床治療需求,多重藥物的梯級釋放模式更為有效,可以根據不同的臨床癥狀和治療周期優化藥物的種類和劑量[7-8]。目前,雙藥聯合治療的主要挑戰是如何獨立控制每種藥物的釋放行為,而具有核殼結構的聚合物微球可以將兩種藥物分別包封于同一載體的內核和殼層兩個不同區域,通過內核和殼層材料的性質單獨改變其所載藥物的釋放行為[9]。因此,研發可實現雙重藥物梯級釋放的核殼型聚合物微球作為藥物載體,具有重要的研究意義和臨床應用前景。
聚乳酸-羥基乙酸共聚物(PLGA)是一種具有良好生物降解性和生物相容性的聚合物高分子,常作為藥物緩釋材料被廣泛應用于制藥、醫用工程材料等領域[10-11]。聚乙烯吡咯烷酮(PVP)具有優良的水溶性、成膜性、生物降解性、化學穩定性和生物相容性[12],作為藥物載體材料可以實現所載藥物的快速釋放[13]。因此,分別以PLGA 和PVP 作為核殼型微球的內核和殼層材料,可以實現內核與殼層中藥物的速釋-緩釋梯級釋放。
目前已經有許多基于乳液模板的技術用于制備核殼型微球,但這些方法普遍存在載藥效率低、蛋白質藥物易變性、工藝繁瑣、耗時長等缺點[14-16]。靜電噴霧技術是以靜電力為驅動力,通過調節電壓、進樣速度和電噴溶液濃度等參數,使帶電射流體加工成微/納米結構顆粒的工藝[17],已經被廣泛應用于親/疏水性藥物微載體的制備[18-19]。靜電噴霧技術設備簡單、操作方便,利于大規模生產;制備的載藥微球不僅單分散性良好,藥物包封率高[20-21],而且可直接噴涂于金屬類植入物材料表面[4]應用于組織工程領域。靜電噴霧技術通常可分為單軸靜電噴霧法[16]和同軸靜電噴霧法[22-23],利用這兩種方法均能制備出載有藥物的核殼型微球,但載藥微球在形貌和釋藥性能方面是否一致還有待探究。
因此,本研究采用單軸靜電噴霧和同軸靜電噴霧兩種方法分別制備出以PLGA 為內核基質、PVP為外殼基質的核殼型雙重載藥微球。其中,單軸靜電噴霧法是將PLGA載藥顆粒分散于溶解有另一種藥物的PVP 溶液中,利用單軸靜電噴霧裝置制備得到核殼型雙重載藥微球;而同軸靜電噴霧法則是分別以含藥的PLGA溶液和含藥的PVP溶液作為內核和殼層的電噴前體,經同軸靜電噴霧裝置制備得到核殼型雙重載藥微球。研究中,選擇了能夠對關節置換術后假體周圍感染的早期主要致病菌——金黃色葡萄球菌起到很好殺菌作用的鹽酸萬古霉素(VA)[24-27]和可以誘導骨髓間充質干細胞向成骨細胞分化并促進成骨細胞增殖和分化的地塞米松(DA)[26-27]作為模型藥物,分別負載于微球的殼層和內核。利用靜電噴霧法制備微球時,電噴前體濃度是影響微球形貌的主要因素[17],因此本文主要考察了PVP 濃度對核殼型微球形貌結構的影響、微球制備前后各組分物理性質的變化以及微球中兩種藥物的梯級釋藥行為,并對單軸靜電噴霧和同軸靜電噴霧法制備出的核殼型雙重載藥微球作了對比研究。
1 實驗部分
1.1 試劑與儀器
聚乳酸-羥基乙酸共聚物(PLGA,分子量4000~15000),贏創公司;聚乙烯吡咯烷酮(PVP,K30,分子量40000)、地塞米松(DA,純度≥98%)、聚乙烯醇(PVA,分子量31000~50000),Sigma-Aldrich 公司。鹽酸萬古霉素(VA,純度≥99%),美侖生物科技有限公司。實驗所用其他試劑均為分析純,西隴科學股份有限公司。實驗用水來自Milli-Q純水系統,電阻率為18.2MΩ·cm。
靜電噴霧設備,SS-2534H 型,北京永康樂業科技發展有限公司;注射泵,LSP01-2A 型,保定蘭格恒流泵有限公司;磁力攪拌器,85-1 型,上海梅穎浦儀儀器儀表制造有限公司;動態光散射納米粒度儀(DLS),ZEN3690 型,Malvem 儀器有限公司;冷凍干燥機,FD-1C-50 型,北京博醫康實驗儀器有限公司;黏度計,DV2T型,美國Brookfield公司;場發射掃描電子顯微鏡(FESEM),JSM7500F型,日本JEOL公司;透射電鏡(TEM),Tecnai G2 F20 S-TWIN 型,美國FEI 公司;數碼相機,E-PL5 型,日本OLYMPUS 公司;X 射線衍射儀(XRD),EMPYREAN型,荷蘭帕納科公司;差式掃描量熱分析儀(DSC),DSC214型,德國耐馳儀器制造有限公司;電子分析天平,上海良平儀器儀表有限公司;高效液相色譜儀(HPLC),UltiMate 3000 型,Thermo Scientific 公 司;純 水 系統,Millipore Elix-10,Millipore公司。
1.2 核殼型雙重載藥微球的制備
(1)利用溶劑揮發法制備PLGA納米顆粒。稱取50mg PLGA 和50mg DA 溶于5mL 丙酮,將該溶液用注射器緩慢逐滴滴入到攪拌狀態下的PVA 水溶液(50mL,0.2g/L)中得到混懸液(冰浴);滴加完畢后,將制得的混懸液在室溫(25℃)下攪拌12h,有機溶劑充分揮發得到PLGA 納米顆粒懸浮液。將懸浮液用去離子水透析3天(定期更換透析介質),以除去多余的PVA 以及未被包封的DA。最后,將納米顆粒在-50℃下凍干48h 得到樣品并放置于干燥柜中備用。此外,用相似的方法制備了未載藥的空白PLGA納米顆粒。
(2)利用單軸靜電噴霧法制備核殼型雙重載藥微球。取制備好的PLGA納米顆粒(5mg/mL)均勻分散于溶有VA(2.5mg/mL)和一定質量PVP 的乙醇-水(9∶1,體積比)混合溶液中作為電噴前體。如圖1(a)所示,將電噴前體裝入注射器中并固定于微量進樣泵上,針頭為電噴專用針頭且利用鱷魚嘴夾將高壓電導線固定在噴嘴上,鋁箔固定于負壓裝置上用于接收電噴制備的微球產物。制備過程中,固定噴射電壓為9kV,微量進樣泵的供液速度保持在0.4mL/h,接收器與針頭之間的距離保持在15cm,溫度為25℃±3℃,相對濕度保持在40%±5%,在此條件下噴嘴處形成泰勒錐,制備得到的微球產物記為SDMs。實驗中還用相似方法制備了未載藥的核殼型空白微球(SBMs)。
(3)利用同軸靜電噴霧法制備核殼型雙重載藥微球。將DA(10mg/mL)和PLGA(10mg/mL)溶于丙酮中作為內核溶液,將VA(2.5mg/mL)和一定量PVP溶于乙醇-水(9∶1,體積比)混合溶液作為殼層溶液。如圖1(b)所示,分別將內核溶液和殼層溶液裝入相應的注射器中。制備時,固定噴射電壓為10kV,內核電噴前體的供液速度為0.2mL/h,殼層電噴前體的供液速度為0.4mL/h,接收器與針頭之間的距離保持在15cm,溫度為25℃±3℃,相對濕度保持在40%±5%,在此條件下噴嘴處形成泰勒錐,制備得到的微球產物記為CDMs。實驗中還用相似方法制備了未載藥的核殼型空白微球(CBMs)。
1.3 核殼型雙重載藥微球的表征
利用FESEM 對PLGA 納米顆粒的形貌進行表征,利用DLS測定了PLGA顆粒的平均粒徑和粒徑分布情況。
利用黏度計測定了單軸和同軸靜電噴霧的電噴前體的黏度。將鋁箔上單軸和同軸靜電噴霧產物進行噴金處理后,利用SEM 觀察形貌,并使用Image J 軟件對SEM 圖像中的微球直徑進行測量,隨機選取200個以上微球計算平均直徑。制備核殼型載藥微球時,直接將其噴涂在銅網上,利用TEM表征雙重載藥微球的核殼型結構。
利用XRD 和DSC 測定核殼型載藥微球中各組分的物理形態。其中,XRD 測試條件為:Cu Kα射線,步長0.026°,范圍5°~60°;DSC 測試條件為:從20℃加熱升溫至350,升溫速率為10℃/min,氮氣環境,流量為40mL/min。
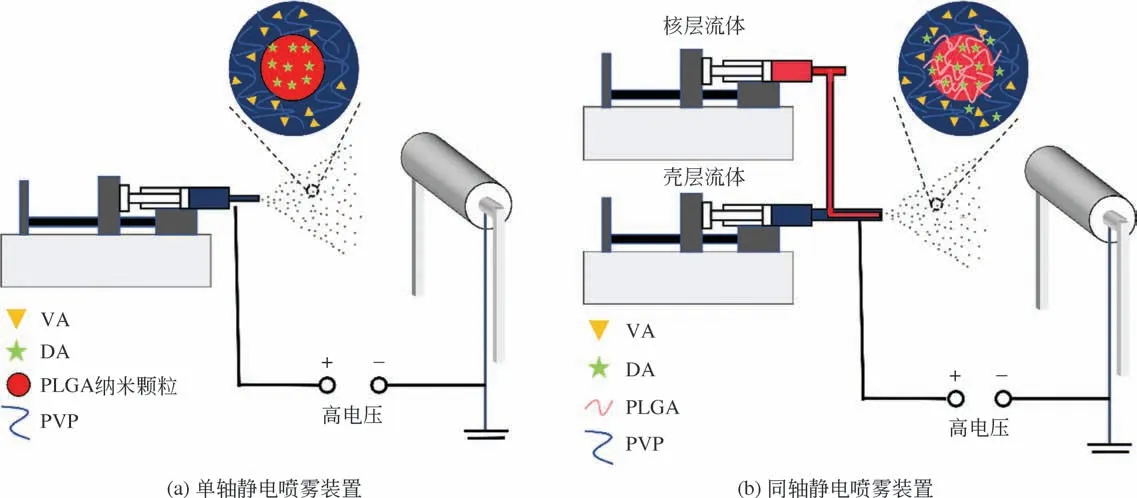
圖1 核殼型雙重載藥微球的制備裝置
1.4 核殼型雙重載藥微球的釋藥行為
利 用HPLC 測 定 兩 種(SDMs4 和CDMs4)核殼型載藥微球中VA 和DA 的載藥量和體外釋藥實驗中的藥物濃度。HPLC 參數:C18 色譜柱;甲醇-水-0.05mol/L pH=3.2 的磷酸二氫鉀溶液(67∶28∶4,體積比)為流動相;檢測波長236nm;柱溫30℃;流速1.0mL/min;進樣量20μL。實驗中測得VA和DA的保留時間分別為2.5min和6.7min。
測定兩種核殼型載藥微球的載藥量。將一定質量的微球利用丙酮-水混合溶液進行充分溶解,待溶解完全后再加入適量去離子水稀釋,利用HPLC測定該稀釋溶液中VA 和DA 相應的峰面積,根據相應標準曲線計算出藥物濃度,再經換算得到載藥微球兩種藥物分別負載的藥量,最后利用式(1)計算載藥量。
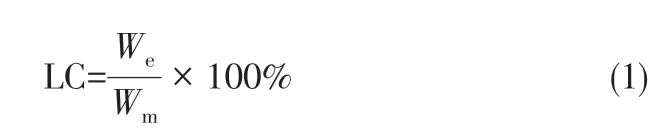
式中,LC 為核殼型微球的載藥量,%;We為微球所負載的藥量,mg;Wm為核殼型微球的總質量,mg。
釋藥行為:將一定量的核殼型雙重載藥微球浸泡于裝有20mL PBS緩沖液(pH=7.4)的離心管中,于37℃條件下恒溫振蕩(100r/min)進行釋藥,在預定的時間點(5min、15min、30min、1h、6h、12h、24h、36h、48h、3天、4天、7天、12天、17天、22 天和28 天)將離心管于20000r/min 轉速下離心后,吸取離心管中上清液1mL,同時補充1mL新鮮的PBS緩沖液,用0.1μm的微孔濾膜過濾所取上清液,用HPLC測定濾液中VA和DA的濃度,并按式(2)計算出兩種藥物在各時間點的累積釋放百分率,從而研究其釋藥特性。
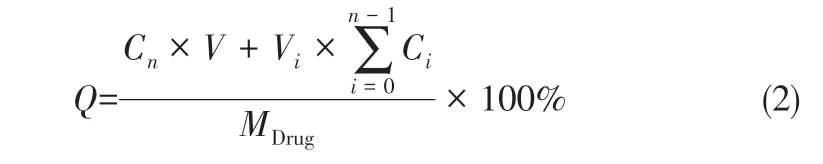
式中,Q為藥物累積釋放率,%;V為釋放放介質PBS緩沖液體積,mL;MDrug為電噴所得微球中藥物的質量,mg;n為取樣并置換釋放介質的次數,n≥1;Cn為第n個取樣時間點所取樣品的濃度,mg/mL;Vi為第i個取樣時間點的取樣體積(V0=0),mL;Ci為第i個取樣時間點的取樣濃度(C0=0),mg/mL。
2 結果與討論
2.1 PLGA載藥納米顆粒的形貌和粒徑分布
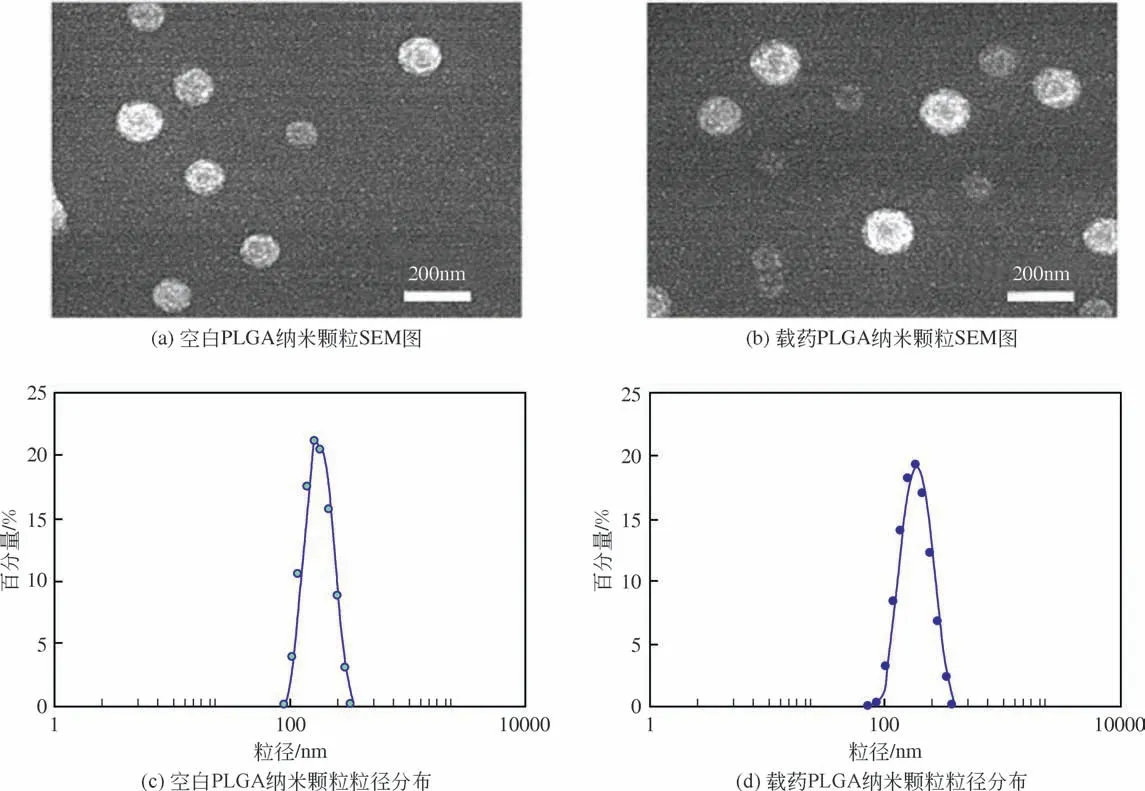
圖2 PLGA納米顆粒的SEM圖和粒徑分布
單軸靜電噴霧制備核殼型載藥微球時,需要先制備出載有DA 的PLGA 納米顆粒。圖2 是溶劑揮發法制備所得空白PLGA 納米顆粒和負載DA 的PLGA納米顆粒的SEM圖,從圖中可以看出空白納米顆粒和載藥納米顆粒的呈現出良好的球形,粒徑均一。圖2(c)和圖2(d)是用DLS 測得的兩種納米顆粒的粒徑分布圖,結果顯示,空白PLGA納米顆粒的平均粒徑為169nm,多分散系數為0.053;載藥PLGA 納米顆粒的平均粒徑為180nm,多分散系數為0.039,載藥PLGA納米顆粒和空白PLGA納米顆粒的粒徑相差不大。DLS 結果同樣說明所制備PLGA 納米顆粒粒徑較為均一,這保證了負載藥量和藥物釋放行為的可重復性。
2.2 PVP 溶液濃度對核殼型載藥微球形貌結構的影響
實驗中配制了不同PVP 濃度的電噴前體,分 別 為10g/L、20g/L、40g/L、80g/L、160g/L 和240g/L,其對應的黏度和所得電噴產物編號見表1和表2。由于單軸靜電噴霧的電噴前體中含有PLGA 納米顆粒,所以在相同PVP 濃度下,單軸電噴前體的黏度均略大于同軸電噴前體的黏度。
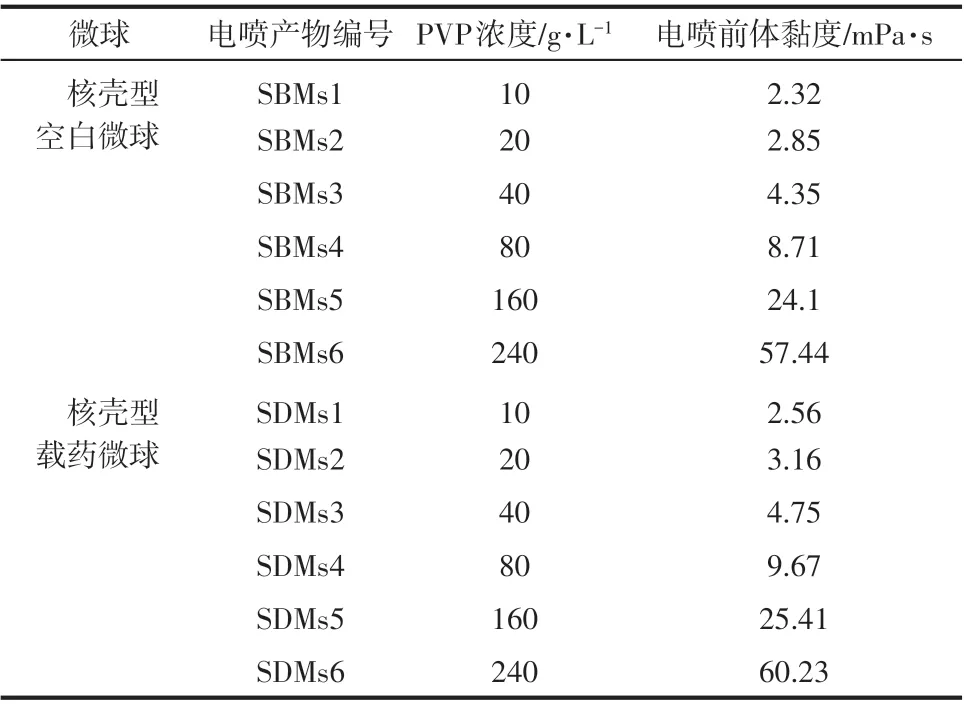
表1 單軸電噴前體參數
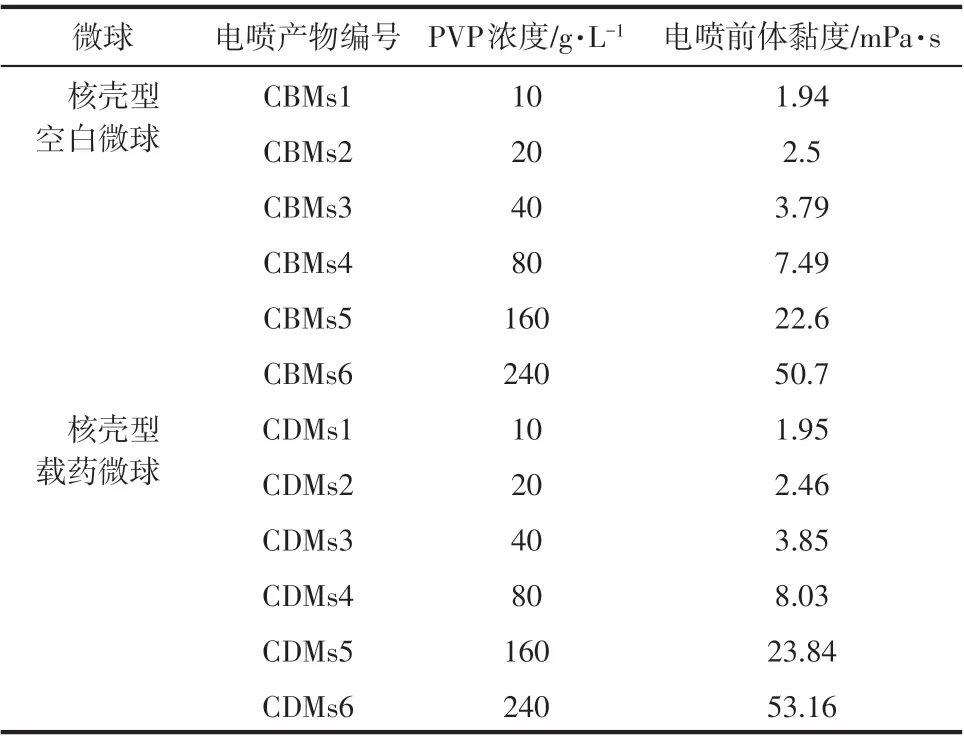
表2 同軸電噴前體參數
靜電噴霧過程中,影響其穩定性的因素主要包括電噴前體中聚合物濃度、噴射電壓、噴射距離、噴射速率、環境溫度和濕度等。本文中,噴射電壓和噴射距離均固定;靜電噴霧設備為密閉環境,保證了環境濕度和溫度的穩定;同時,使用控恒流注射泵控制進樣速率,可在高壓靜電場中穩定可靠運行,保證了噴射速率的穩定。在此基礎上,當PVP濃度低于80g/L 時,盡管可以在噴頭處觀察到泰勒錐,但錐體并不穩定,會出現脈沖式噴射或偶有液滴飛落,這是因為溶液黏度過低,電場力與溶液表面張力不均衡,導致噴射不穩定;當PVP 濃度在80~240g/L 時,如圖3 所示,單軸電噴和同軸電噴的噴嘴處均可形成穩定的泰勒錐,小液滴呈傘狀噴出,并保持連續且穩定的噴射,表明電場力和溶液表面張力平衡,制備過程穩定好。

圖3 PVP濃度為80g/L時的靜電噴霧
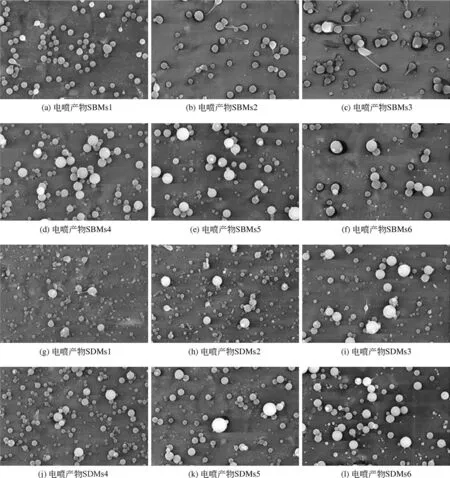
圖4 單軸靜電噴霧所得空白[(a)~(f)]和載藥[(g)~(l)]產物的SEM圖(標尺10μm)
圖4 和圖5 分別為不同PVP 濃度的電噴前體經單軸和同軸靜電噴霧制備所得微球的SEM 圖。可以發現,PVP 濃度在10~240g/L 的溶液均可電噴成型,但成型效果具有較大的差別。單軸靜電噴霧過程中,當溶液濃度為10~40g/L 時,空白電噴產物和載藥電噴產物中均可觀察到部分顆粒呈蝌蚪狀,即有明顯的拖尾,這是由于電噴霧形成的泰勒錐不穩定;當溶液PVP 濃度為240g/L 時,因為黏度較大,電噴產物出現了串珠現象;而PVP 濃度為80g/L 和160g/L 所 得 的 電 噴 產 物SBMs4、SBMs5、SDMs4 和SDMs5 均呈球狀,無明顯的拖尾和串珠現象。類似的,同軸靜電噴霧過程中,溶液濃度為10~40g/L 時也出現了拖尾現象。值得注意的是,PVP濃度為10g/L和20g/L時的載藥電噴產物呈凹餅狀,與相同PVP 濃度下所得空白電噴產物形貌差異較大,說明藥物的存在也會影響電噴產物的形貌。當溶液PVP 濃度為160g/L 時,即可觀察到同軸靜電噴霧產物中出現串珠現象,而當濃度增大到240g/L時,串珠現象非常明顯,部分呈絲狀。因此可以看出,當溶液中PVP 濃度接近80g/L 時,單軸和同軸靜電噴霧均可得到大小較為均一的球狀電噴產物,即SBMs4、SDMs4、CBMs4、CDMs4,其平均 粒 徑 分 別 為 0.39μm、 0.58μm、 0.55μm、0.65μm。其中,載藥微球的粒徑均大于空白微球,而同軸電噴微球的粒徑均大于對應的單軸電噴微球,這是因為與單軸靜電噴霧過程相比,同軸靜電噴霧時,還有一定量的丙酮作為內核電噴前體,在溫度、濕度、PVP濃度和電噴距離等條件一定的情況下,丙酮的存在使噴出液滴中液體揮發速率減慢,致使溶液中溶質凝固和高分子鏈之間物理纏繞的速率相應減緩,故所得微球粒徑增大。
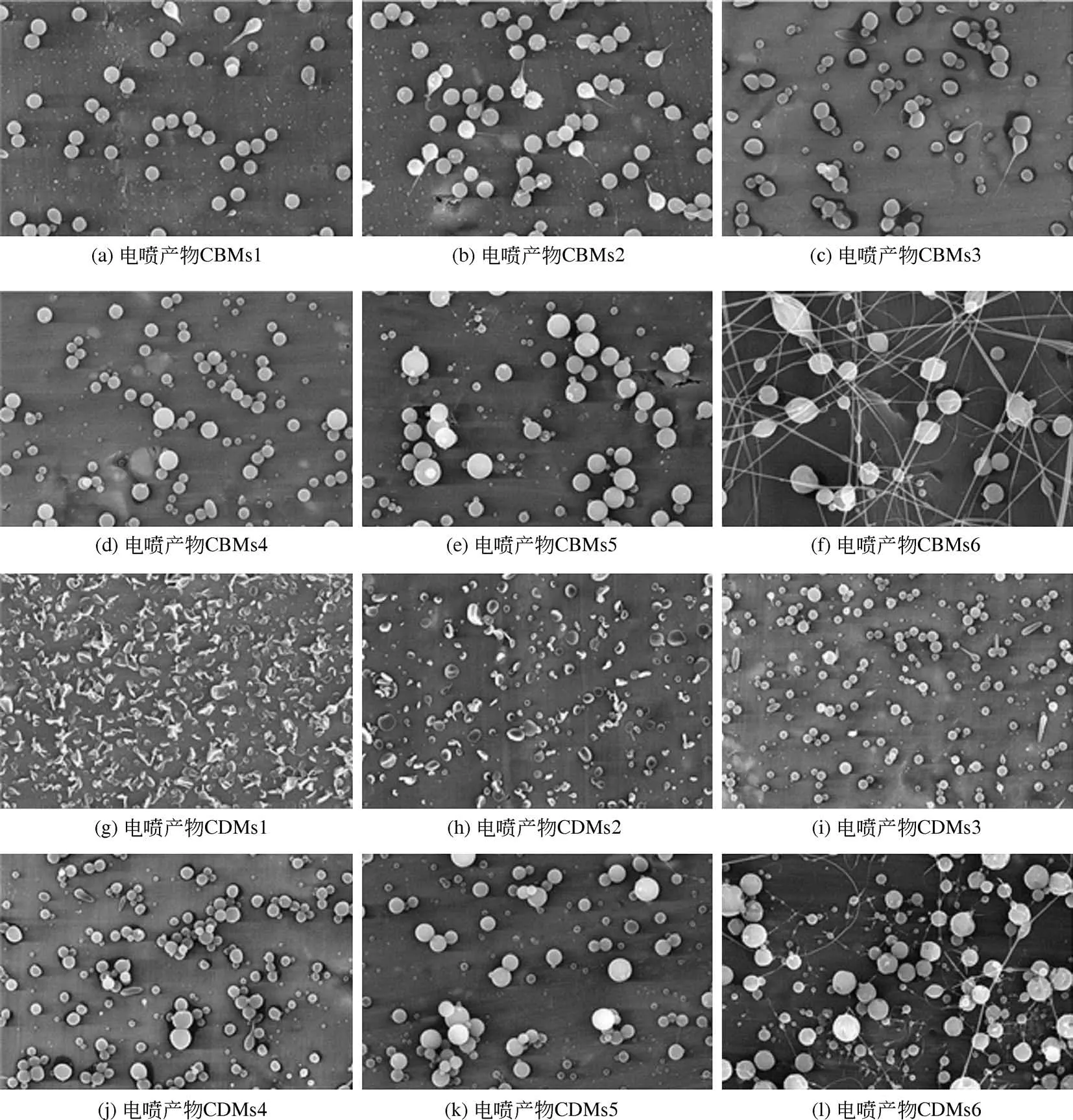
圖5 同軸靜電噴霧所得空白[(a)~(f)]和載藥[(g)~(l)]產物的SEM圖(標尺10μm)
為表征單軸和同軸靜電噴霧所得微球的核殼結構,選取SDMs4 和CDMs4 這兩種微球利用TEM 進行觀察,如圖6 所示,由于PLGA 的存在,微球內核呈深灰色,外殼呈淺灰色,內核-殼層的分界限清晰,可以看出明顯的核殼結構。其中,利用單軸靜電噴霧法制得核殼型微球的形成機理[16]是:由于PLGA 納米顆粒與PVP 溶液之間具有良好的相容性,同時乙醇/水混合溶劑在PVP 相和PLGA 相中的共存進一步增強了兩相之間的相容性。因此,PLGA 納米顆粒能夠良好地均勻分散于PVP 溶液中,形成穩定的混懸液。電噴霧過程中,泰勒錐和噴霧小液滴中的溶劑快速揮發使PLGA納米顆粒和PVP溶液之間的界面張力增大,并在相分離作用下PLGA 納米顆粒被包埋于黏稠PVP 液滴的中心,待溶劑完全揮發后則形成PLGA/PVP 核殼結構。因此,利用單軸靜電噴霧法可以制備得到結構一致、粒徑均勻的PLGA/PVP核殼型微球,且核殼型微球中包埋單一的PLGA納米顆粒。同軸靜電噴霧制備核殼型微球過程中,在同軸針頭的引導下,核層溶液始終保持在殼層溶液的中心,噴射時,隨著溶劑的揮發以及核層、殼層相分離作用的增大,PLGA和PVP 分別在核層和殼層區域固化,最后也形成了具有單一PLGA內核的核殼型微球。
2.3 核殼型載藥微球中各組分的物理性質
實驗中利用XRD 和DSC 確定了微球中各組分的物理性質,結果見圖7。如圖7(a)所示,原材料DA 的XRD 譜圖中出現了明顯的銳峰,說明DA 是一種具有特征衍射峰的晶體材料,而VA、PLGA和PVP 原材料的譜圖中均為彌散峰,表明這幾種聚合物的分子取向和排列是無序的,即無定形狀態。類似的,在核殼型載藥微球SDMs4 和CDMs4的光譜中也沒有出現明顯的峰,這意味著微球中的DA 不再以晶體形式存在,而是轉化為非晶態。難溶于水的藥物DA由晶態轉變為無定形態后,可以增加其溶解度和溶出度,提高藥物的生物利用度[28]。如圖7(b)所示,DA 在260℃處出現熔融峰;PLGA 為無定形態,在50℃表現出玻璃轉化溫度,無明顯熔融峰;VA 和PVP 由于脫水表現出較寬的吸熱峰,峰值分別為96℃和112℃。單軸和同軸靜電噴霧制備出的產物SDMs4 和CDMs4 同樣出現了吸熱峰,峰值分別為106℃和101℃,介于VA 和PVP的吸熱溫度之間,表明電噴微球成功負載了藥物VA。SDMs4 中未見DA 的吸熱峰,表明DA 成功被包載于核殼型微球中,并以無定形態存在。但是,CDMs4 的DSC 熱圖中,在250℃處出現了一個較小的吸熱峰,表明同軸靜電噴霧制備核殼型載藥微球時,少部分DA并未成功包載于微球中,而是吸附于微球表面。

圖6 PVP濃度為80g/L時兩種核殼型載藥微球的TEM圖
2.4 核殼型載藥微球的體外釋藥特征
通過測定和計算,SDMs4 中VA 和DA 的載藥量分別為2.13%和0.68%,CDMs4中VA和DA的載藥量分別為2.08%和5.13%。兩種載藥微球中DA的載藥量差別較大,這是由于SDMs4 中的載藥內核是利用溶劑揮發法制備的,該過程中藥物DA在相間的擴散導致載藥量較低[29];而CDMs4的載藥內核直接由同軸靜電噴霧所得,藥物的損失主要是少量藥物分子和載藥微球噴到接收器之外引起的[21],所以載藥量較高。
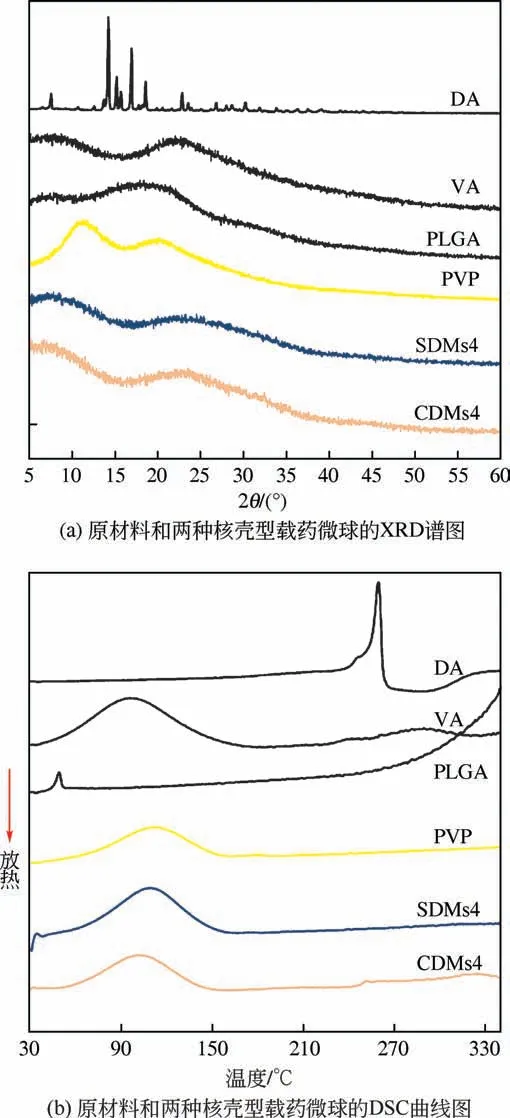
圖7 原材料和兩種核殼型載藥微球的物理性質
兩種核殼型載藥微球SDMs4 和CDMs4 的釋藥結果如圖8所示。由圖8(a)可見,兩種微球中的VA均在0.5h內基本完全釋放到PBS介質中。這歸因于PVP 的親水性強以及VA 的水溶性好,使得VA 與PVP分子同時溶解于釋放介質中。圖8(b)是兩種微球中DA 的釋藥情況,可以看出,與SDMs4 相比,同軸靜電噴霧制備的核殼型微球CDMs4中DA突釋明顯,在1h 內已釋放42%的藥量,結合前面DSC的結果分析,這主要是由于一部分DA吸附在核殼型微球的表面,會快速釋放到介質中,同時負載于殼層中的DA也會隨著PVP的溶解而快速釋放。而SDMs4 中的DA 在1h 內僅釋放了24%左右。隨著PLGA 的降解,SDMs4 和CDMs4 內核中負載的DA被緩慢釋放,在28天時,兩種載藥微球中DA的累積釋藥量分別為73%和90%。可以看出,同軸靜電噴霧制備的核殼型載藥微球中,內核藥物釋放更完全。對比VA 和DA 的釋藥情況,可以看出單軸靜電噴霧和同軸靜電噴霧制備的核殼型雙重載藥微球均能實現VA和DA兩種藥物的速釋-緩釋梯級釋放。兩種方法相比較,同軸靜電噴霧法由于藥物損失少、步驟簡便、制備過程中不需要使用表面活性劑且制備得到的載藥微球中藥物DA釋放更完全而更具有優勢。
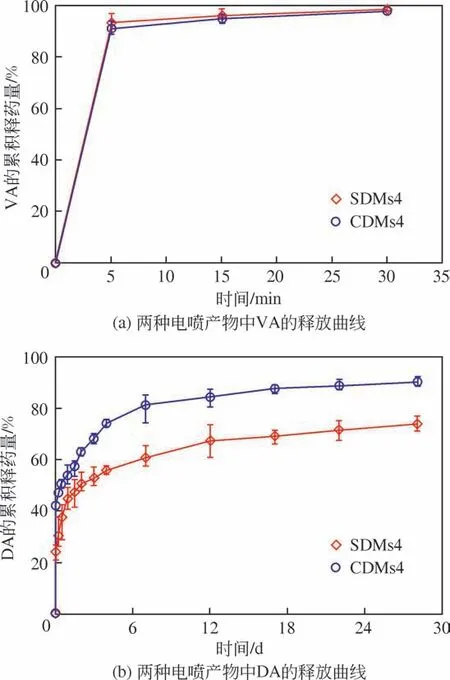
圖8 兩種核殼型載藥微球在PBS緩沖溶液中的釋藥曲線
3 結論
利用單軸靜電噴霧和同軸靜電噴霧均成功制備出同時載有兩種藥物的核殼型微球給藥系統,其中PLGA 為內核基質,PVP 為外殼基質。當電噴前體PVP濃度為80g/L時,均可得到大小均一、具有核-殼結構的微球。兩種方法制備出的核殼型雙重載藥微球中抗菌藥物VA負載于殼層,促成骨分化的藥物DA 主要負載于內核,且晶體材料中的DA 基本都變為無定形態,有利于提高DA 的生物利用度;體外釋藥結果表明,兩種微球均能實現VA 速釋-DA緩釋的梯級釋放行為。兩種靜電噴霧方法相比,同軸靜電噴霧法具有步驟簡便、所得微球中內核載藥量更高、藥物釋放更完全的優勢。本文的靜電噴霧法可將制備的具有梯級釋藥性能的核殼型雙重載藥微球直接噴涂于不銹鋼、鈦及鈦合金等臨床常用的植入體材料表面,進而實現更合理的臨床療效。與常見的植入物材料改性方法相比,本研究所設計的策略操作簡單、方法便捷,噴涂后由于藥物釋放,可以賦予植入物材料抗菌性能并促進成骨分化,在組織工程方面具有很好的臨床應用前景。

