如何區分碳酸鈉和碳酸氫鈉
河北省承德市第十六中學 閆 帥
一、提出問題
化學興趣小組在用碳酸鈉和碳酸氫鈉進行實驗時,發現它們的標簽都被腐蝕了,怎樣才能區分出這兩種物質呢?
同學們對這兩種物質進行了對比和總結:它們都是白色固體,水溶液都顯堿性,都能與稀鹽酸反應,它們的性質很相似。老師曾經講過,它們與酸反應的速度不同,碳酸氫鈉反應得快,碳酸鈉反應得慢。于是同學們設計了一個實驗:稱取碳酸鈉和碳酸氫鈉各1 g,分別放入兩支大試管中,再量取兩份體積均為10 mL 的相同稀鹽酸,把兩份稀鹽酸分別迅速倒入兩支試管中,反應都很劇烈。試了好幾遍,根據反應速度很難區分,而且需要控制變量,操作費時。
二、設計方案
興趣小組的同學們找到老師,將他們的疑問告訴了他,老師覺得他們提出的問題很有意義。為了解決這個問題,老師組織學生利用課余時間搜集相關資料,設計實驗方案。同學們分組討論后,設計出以下幾種實驗方案。
方案一:觀察法
根據碳酸鈉為白色固體粉末,碳酸氫鈉為白色細小的晶體,分別觀察碳酸鈉和碳酸氫鈉的外形。
方案二:溶解法
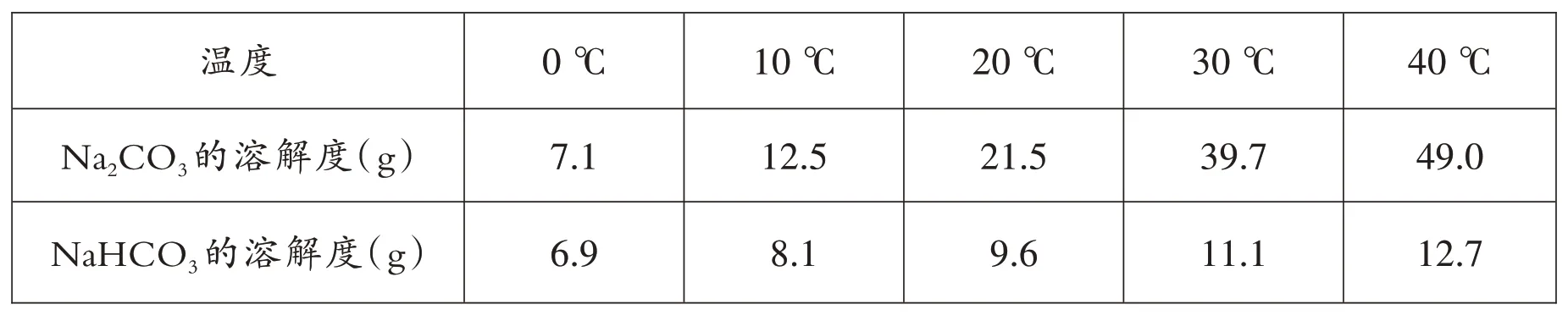
碳酸鈉和碳酸氫鈉的溶解度見下表。根據溫度高于20 ℃時,它們的溶解度差異較大,學生首先測出實驗室氣溫為23.2 ℃,水溫為20 ℃;然后分別稱取碳酸鈉和碳酸氫鈉各1.5 g,放入兩支試管中;最后分別倒入10 mL 水,振蕩,觀察溶解情況。
方案三:沉淀法
根據碳酸鈣不溶于水,碳酸氫鈣可溶于水,分別稱取碳酸鈉和碳酸氫鈉各2 g,并分別溶解在50 g 的水中,制成等濃度的兩種溶液;然后分別取等量的兩種溶液倒入兩支試管中,并向兩溶液中各加入適量氯化鈣溶液,觀察現象。
方案四:pH 法
根據碳酸鈉的堿性比碳酸氫鈉強,用玻璃棒分別蘸取方案三中的兩種溶液,滴在pH 試紙上,然后與標準比色卡對比,讀出pH 值。
方案五:加熱法
?
根據碳酸鈉受熱不分解,碳酸氫鈉受熱分解成碳酸鈉、水和二氧化碳,設計實驗:分別取碳酸鈉和碳酸氫鈉各2 g 放入兩支試管中,并稱量兩支試管的質量;然后分別加熱兩支試管,將產生的氣體通入澄清石灰水中,觀察現象;反應結束后,再次稱量兩支試管的質量。
三、進行實驗
同學們分別按照實驗方案進行實驗,他們觀察到的現象如下所述。
方案一:碳酸鈉和碳酸氫鈉固體都是白色粉末,看不出兩者的區別。老師建議使用顯微鏡(或放大鏡)觀察,同學們觀察后發現,碳酸鈉為白色固體粉末,碳酸氫鈉為白色細小的晶體(如圖1)。
方案二:全部溶解的是碳酸鈉,不能全部溶解的是碳酸氫鈉(如圖2)。
方案三:有白色沉淀的是碳酸鈉,無白色沉淀的是碳酸氫鈉(如圖3)。
方案四:測得pH 值分別為12 和8,堿性更強的是碳酸鈉,堿性較弱的是碳酸氫鈉。
方案五:試管口內壁有水珠生成,產生的氣體能使澄清石灰水變渾濁,石灰水內冒氣泡速度很快的是碳酸氫鈉。加熱前盛碳酸氫鈉的試管的質量是27.6 g,加熱后的質量是26.9 g,減少了0.7 g。另一個是碳酸鈉。
加熱碳酸鈉時試管內壁也出現水珠,但澄清石灰水沒有變渾濁,石灰水內冒氣泡的速度很慢。加熱前盛碳酸鈉的試管的質量是27.7 g,加熱后是27.6 g,減少了0.1 g。為什么加熱碳酸鈉會出現水珠?質量為什么會減少0.1 g?興趣小組的同學們求助老師,老師說是因為碳酸鈉中有結晶水存在。老師建議先在蒸發皿中對其進行加熱,除去結晶水后再實驗。學生按照老師的指導又做了該實驗,加熱碳酸鈉沒有任何現象,質量基本不變。
四、得出結論
區分碳酸鈉和碳酸氫鈉可以通過觀察外形,比較常溫下的溶解情況,比較能否與氯化鈣溶液(或氯化鋇溶液)反應,比較溶液的pH 值,比較受熱分解的現象等多種方法實現。其實,區分碳酸鈉和碳酸氫鈉的方法不止于此,只是這些方法非常適合初中階段學生。
五、交流分享
通過對碳酸鈉和碳酸氫鈉的區分方法進行探究,加深了同學們對這兩種物質的認識,使學生學會了利用性質的差別來區分物質,同時也鍛煉和提高了學生的實驗探究能力。

