短期運動預處理對大鼠腦缺血再灌注中炎癥小體活化通路的影響
馬海浩,陳柯,趙亞男,周翔,王端浩
(成都體育學院,成都 610041)
腦卒中是全球第三大疾病死亡原因,嚴重威脅人類的生存與健康。數據顯示,2017年我國農村人群腦血管病死亡占居民疾病死亡的比例為23.18%,城市人群為20.52%[1]。運動作為一種新興的方法可以預防腦卒中的發生。據報道,缺乏身體活動的男性腦卒中的患病率為28.5%,女性為31.5%,并且患病率隨著年齡的增長而增加[2]。Meta分析顯示,適當的體力活動可以降低25%~30%由腦卒中引起的死亡風險[3]。
在腦缺血再灌注后,細胞外三磷酸腺苷(extracellular adenosine triphosphate,eATP)濃度改變激活嘌呤能受體7(P2X purinoceptor 7,P2RX7),使細胞內陽離子大量外流;陽離子的外流又使細胞質形成炎性復合體,炎性復合體切割下端的天冬氨酸半胱氨酸特異性蛋白酶1(cysteinyl aspartate specific proteinase 1,Caspase-1),Caspase-1切割細胞質中的消皮素D(gasdermin D,GSDMD)蛋白,Caspase-1又能切割、加工炎性因子IL-1β和IL-18,使炎性因子通過脹大的細胞膜孔進入細胞外液。另外,天冬氨酸半胱氨酸特異性蛋白酶11(cysteinyl aspartate specific proteinase 11,Caspase-11)也能切割GSDMD蛋白,促進細胞膜孔的脹大。本研究探討運動預處理在大鼠腦缺血再灌注中對相關蛋白的影響及可能機制,為臨床腦缺血再灌注損傷的運動治療提供理論基礎。
1 材料和方法
1.1 大鼠模型制備及實驗分組90只6周齡健康雄性SD大鼠(SPF級)(實驗鼠80只,備用鼠10只),體質量160~180 g,購自成都達碩實驗動物有限公司,飼養于成都體育學院SPF級動物房。將實驗動物隨機分為運動組和非運動組(40只/組)。非運動組又進一步分為假手術組(SS組)和模型組(CM組)(20只/組):SS組大鼠自由活動4周,接受假手術模型制作,線栓插入頸總動脈1 cm處,不進行缺血再灌注處理;CM組大鼠自由活動4周,進行大腦中動脈閉塞(middle cerebral artery occlusion,MCAO)模型制作,2 h后進行缺血再灌注處理。運動組又進一步分為單純運動組(P組)和運動預處理模型組(EM組)(20只/組):P組大鼠在動物跑臺連續運動4周后,不進行模型制作,直接猝死,斷頭取腦;EM組大鼠在動物跑臺連續運動4周后,進行MCAO模型制作,2 h后進行缺血再灌注處理。
運動預處理模型:所有大鼠在實驗前進行了1周的自適應跑步機訓練,跑臺速度為8~10 m/min,20 min/d,0°斜坡行走。運動組大鼠接受大鼠跑臺連續訓練4周,6 d/周,訓練方案為30 m/min,30 min/d,0°斜坡,電流刺激強度設定為1.5 mA;非運動組中的大鼠在籠中自由活動,不使用跑臺訓練[4]。
動物實驗模型根據Reiss等[5]改良的MCAO線栓法制備。大鼠在造模前12 h禁食不禁水,稱重,按0.3 mL/100 g劑量腹腔注射10%水合氯醛進行麻醉。將大鼠背位固定在大鼠恒溫手術臺上,溫度(37.0±0.5)℃。沿頸部正中皮膚切開約2 cm手術刀口,分離出右側頸總動脈(common carotid artery,CCA)、頸內動脈(internal carotid artery,ICA)和頸外動脈(external carotid artery,ECA)。在右側CCA近心端掛線但不結扎,用手術線結扎ECA遠心端和CCA下方距分叉1.5 cm處,然后在CCA距離分叉處約0.5 cm處用眼科剪剪“v”型小口,將栓塞線(距離線頭2 cm處用黑色記號筆標記)經小口插入CCA,用組織攝輕推栓線進入CCA并固定,線栓插入長度為18~22 mm,微感阻力后停止進栓,用細線結扎CCA遠心端。腹腔注射青霉素鈉0.5 mL,手術切口處滴0.1 mL青霉素鈉。2 h后,抽出栓塞線,完成再灌注后縫合傷口,將大鼠放回籠中。SS組只進行麻醉、開口和分離組織等操作,不進行栓塞造模。
1.2 大鼠神經行為學評分在缺血再灌注24 h后處死大鼠,處死前對大鼠進行神經行為學評分。采用Longa評分標準,分數越高,說明其神經行為損傷越嚴重。首次評分1、2、3分的大鼠視為造模成功。0分、4分或術中死亡的大鼠予以剔除,再從備用組中隨機補充。評分由3位實驗員獨立完成。(表1)
1.3 紅四唑(triphenyltetrazolium chloride,TTC)染色深度麻醉動物后,迅速斷頭取腦,將腦放進大小合適的腦切片模具中,切成1~3 mm厚的切片。將腦片立即置于2%的TTC染色液中,避光孵育、固定、排列、照相、計算腦梗死面積的大小。腦梗死面積計算公式:腦梗死面積百分比=腦片總梗死面積/對側腦片總面積×100%。

表1 Longa評分標準
1.4 蘇木精-伊紅 ( hematoxylin-eosin,HE )染色固定組織經全自動脫水機脫水、包埋、切片后進行蘇木精染色;橫切組織,切片厚5 μm;經脫蠟、水化、染色、脫水、透明、封片等步驟后在鏡下拍照。
1.5 ELISA檢測血清IL-1β和IL-18水平取血后,以1 510×g離心15 min,分離血清。然后用ELISA檢測試劑盒(R&D公司)分別檢測各組大鼠血清中細胞因子IL-1β和IL-18的水平。
1.6 Western blotting檢測蛋白將大鼠腦樣本放入EP管中,加入RIPA裂解液剪碎,于冰上裂解10 min;收集裂解液,4 ℃、24 170×g離心10 min,取上清液,進行上樣、電泳、轉膜、封閉、一抗孵育[一抗:Caspase-1(武漢三鷹公司),1∶1 000;GSDMDC1(Santa Cruz公司),1∶500;P2RX7(武漢博士德公司),1∶100;Caspase-11(Santa Cruz公司),1∶300;β-actin,1∶5 000。將聚偏二氟乙烯(polyvinylidene fluoride, PVDF)膜放入一抗中,4 ℃孵育過夜];用TBST將PVDF膜洗3次,進行二抗孵育[將PVDF膜放入二抗(1∶5 000)中,在搖床上輕搖,室溫孵育2~3 h];用TBST將PVDF膜洗3次,最后顯影、定影,進行圖像分析,得出結果。

2 結果
2.1 各組大鼠體質量的變化所有大鼠在進行MCAO前體質量控制在250~280 g,達到實驗要求。4組之間比較,差異均無統計學意義(P>0.05)。
2.2 各組大鼠Longa評分的比較MCAO 24 h后,SS組和P組大鼠均未出現神經功能損傷表現;CM組和EM組大鼠出現明顯的神經功能損傷表現,與SS組和P組比較,差異均具有統計學意義(P<0.01);EM組與CM組比較,大鼠神經功能損傷表現減輕 (P<0.05)。(表2)
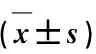
表2 各組大鼠神經行為學評分的比較
2.3 各組大鼠腦TTC染色及腦梗死面積的比較MCAO 24 h后,SS組和P組大鼠均未出現腦梗死灶;CM組和EM組大鼠腦組織均出現不同程度的梗死灶,與SS組和P組比較,差異均具有統計學意義(P<0.01);EM組與CM組比較,腦梗死面積縮小 (P<0.05)。(表3、圖1)
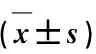
表3 各組大鼠腦梗死面積的比較

圖1 各組大鼠腦梗死面積
2.4 各組大鼠大腦皮層缺血半暗帶HE染色結果光鏡下(×100、×400)觀察,SS組和P組大鼠皮質層結構和軟腦膜完整、清晰,各細胞層排列較為整齊,神經元形態正常,未見明顯變性或壞死。CM組腦組織大面積梗死,神經元呈片狀壞死并伴隨水腫,細胞崩解,梗死區邊緣神經元空泡變性或點狀壞死。EM組腦組織出現梗死,部分神經元細胞壞死并伴隨水腫,梗死區邊緣神經元結構較為正常,神經纖維排列致密,染色較為均勻。(圖2)
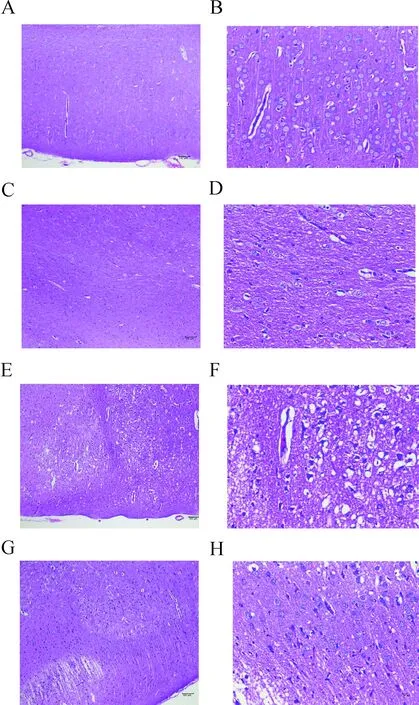
注:A.SS組(HE,×100);B.SS組(HE,×400);C.P組(HE,×100);D.P組(HE,×400);E.CM組(HE,×100);F.CM組(HE,×400);G.EM組(HE,×100);H.EM組(HE,×400)。圖2 各組大鼠大腦皮層HE染色結果
2.5 各組大鼠血清IL-1β、IL-18水平的比較CM組、EM組與SS組比較,血清IL-1β、IL-18水平明顯升高(P<0.01);與CM組比較,EM組血清IL-1β、IL-18水平明顯降低(P<0.01)。(圖3)
2.6 各組大鼠大腦皮層缺血半暗帶P2RX7、Caspase-1、Caspase-11、GSDMD蛋白水平的比較MCAO 24 h后,與SS組和P組比較,CM組P2RX7蛋白表達增加(P<0.01);與CM組比較,EM組P2RX7蛋白表達明顯降低(P<0.01)。(圖4)

注:與SS組比較,*P<0.01;與CM組比較,#P<0.01。圖3 各組大鼠血清IL-1β、IL-18水平的比較
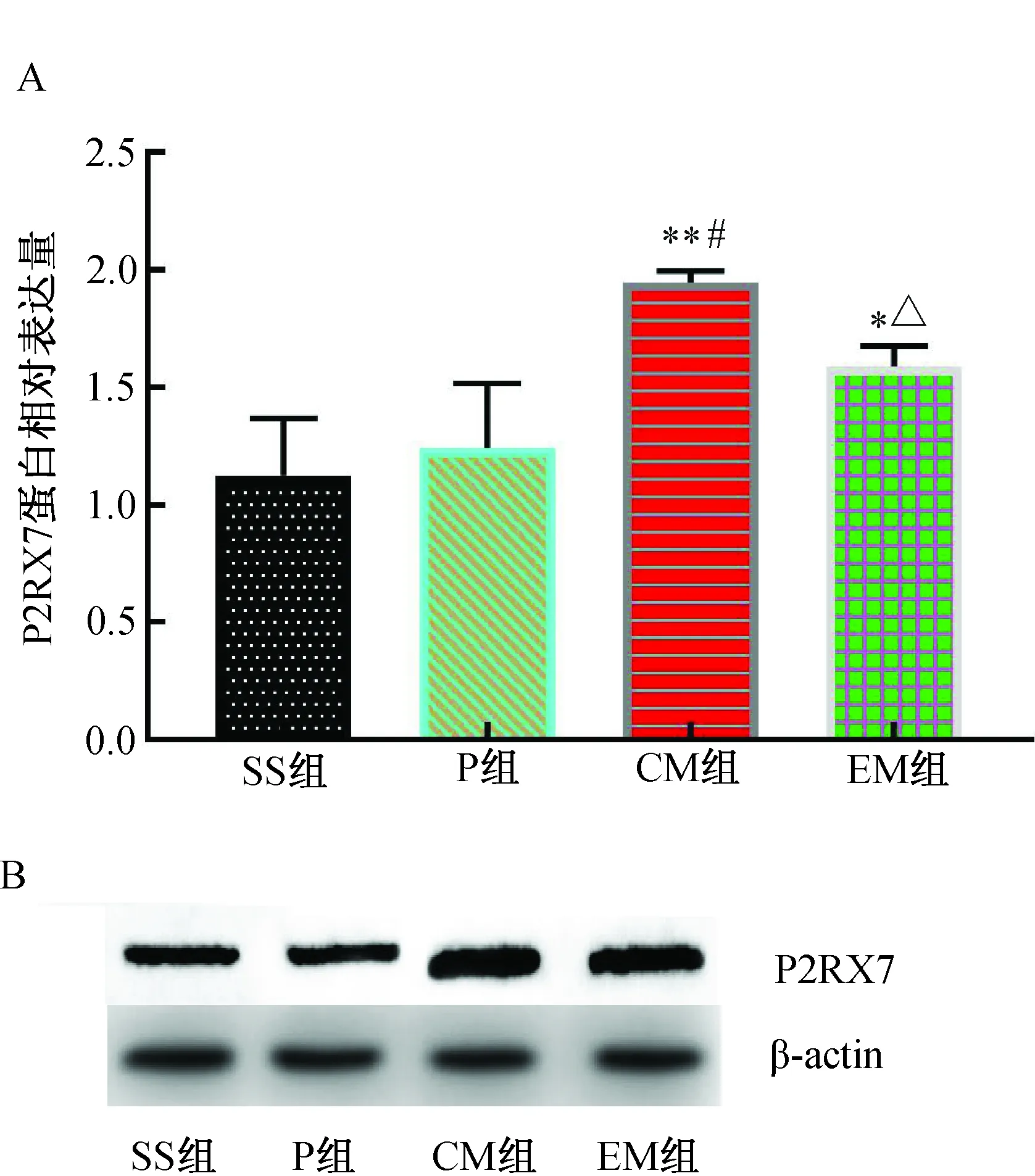
注:A. P2RX7蛋白相對表達水平;B.P2RX7 Western blotting蛋白電泳條帶。與SS組比較,*P<0.05,**P<0.01;與P組比較,#P<0.01;與CM組比較,△P<0.01。圖4 各組大鼠大腦皮層缺血半暗帶P2RX7蛋白表達水平的比較
MCAO 24 h后,與SS組比較,P組Caspase-11蛋白表達相近,差異無統計學意義(P>0.05);與SS組和P組比較,CM組Caspase-11蛋白表達明顯增加(P<0.01);與CM組比較,EM組Caspase-11蛋白表達明顯降低(P<0.05)。(圖5)
MCAO 24 h后,與SS組比較,P組Caspase-1蛋白表達相近,差異無統計學意義(P>0.05);與SS組和P組比較,CM組Caspase-1蛋白表達明顯增加(P<0.01);與CM組比較,EM組Caspase-1蛋白表達明顯降低(P<0.01)。(圖6)
MCAO 24 h后,與SS組比較,P組GSDMD蛋白表達相近,差異無統計學意義(P>0.05);與SS組和P組比較,CM組GSDMD蛋白表達明顯增加(P<0.01);與CM組比較,EM組GSDMD蛋白表達明顯降低(P<0.01)。(圖7)
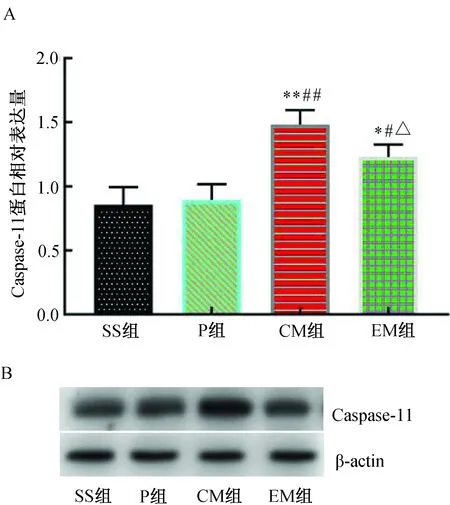
注:A. Caspase-11蛋白相對表達水平;B.Caspase-11 Western blotting蛋白電泳條帶;與SS組比較,*P<0.05,**P<0.01;與P組比較,#P<0.05,##P<0.01;與CM組比較,△P<0.05。圖5 各組大鼠大腦皮層缺血半暗帶Caspase-11蛋白表達水平的比較
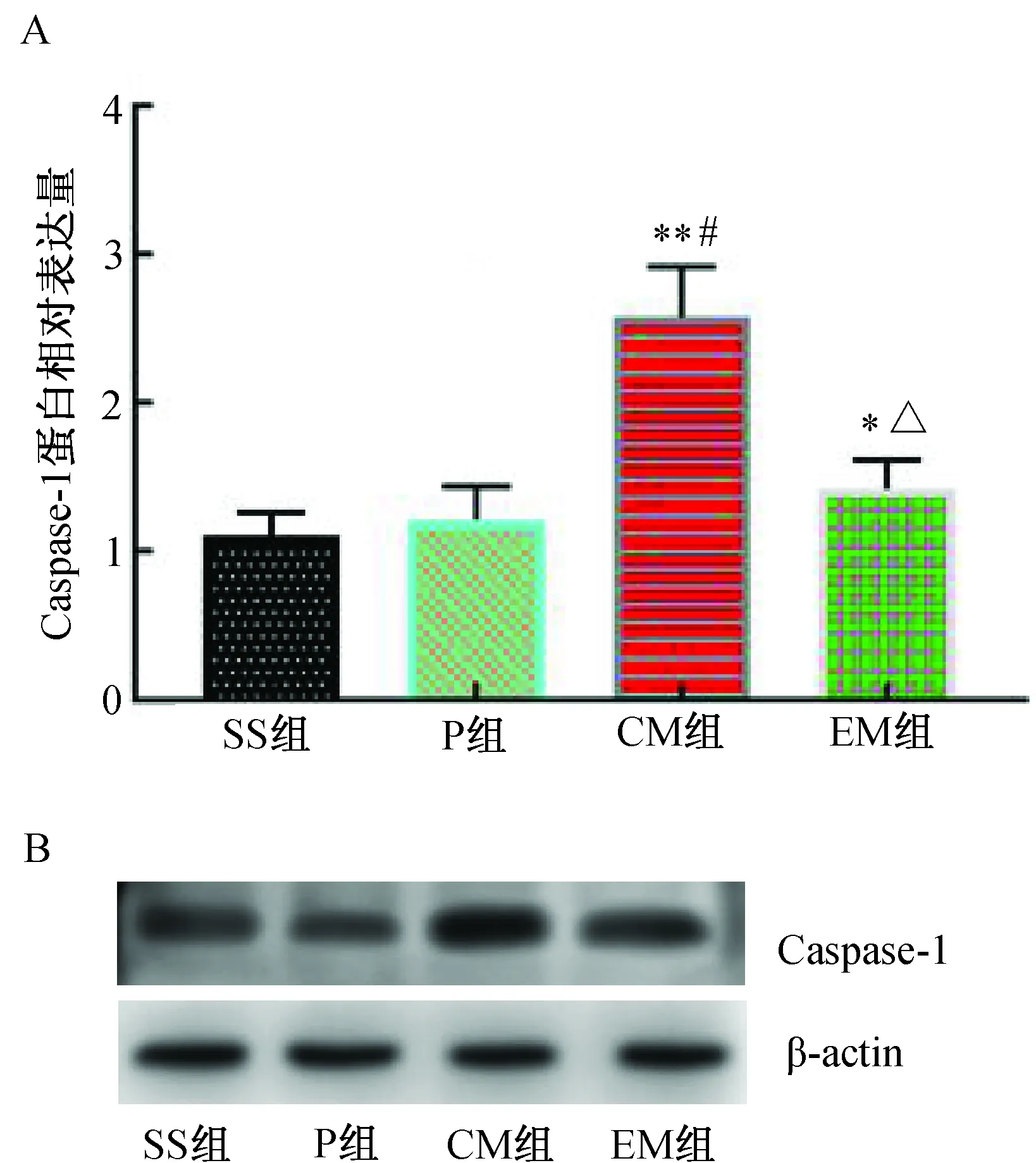
注:A. Caspase-1蛋白相對表達水平;B.Caspase-1 Western blotting蛋白電泳條帶。與SS組比較,* P<0.05,**P<0.01;與P組比較,#P<0.01;與CM組比較,△P<0.01。圖6 各組大鼠大腦皮層缺血半暗帶Caspase-1蛋白表達水平的比較
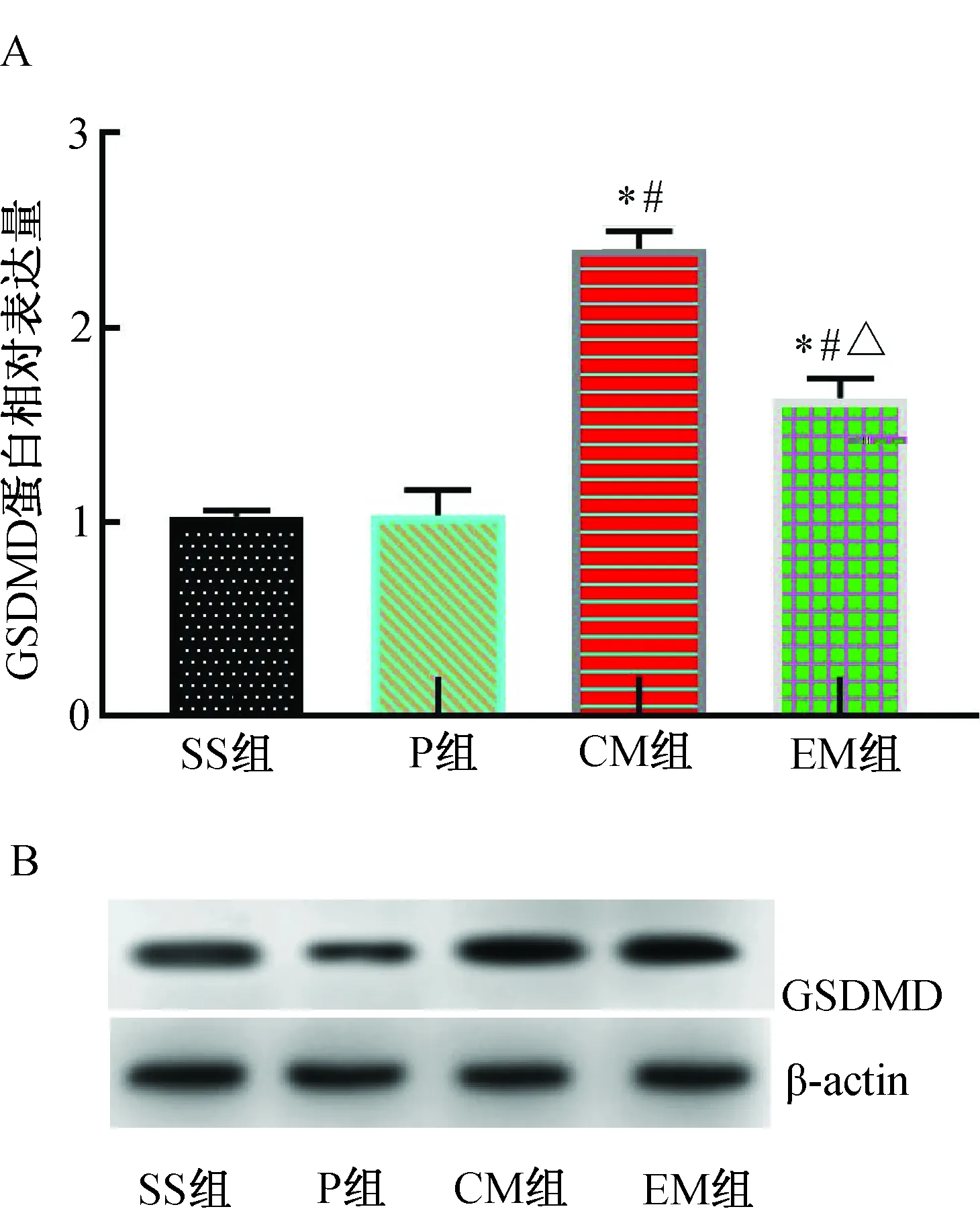
注:A.GSDMD蛋白相對表達水平;B.GSDMD Western blotting蛋白電泳條帶。與SS組比較,*P<0.01;與P組比較,#P<0.01;與CM組比較,△P<0.01。圖7 各組大鼠大腦皮層缺血半暗帶GSDMD蛋白表達水平的比較
3 討論
HE染色結果顯示,運動預處理對腦缺血再灌注損傷在病理學方面有預防作用,進行運動預處理的大鼠在腦缺血術后,組織細胞對缺氧、缺血的耐受性增加;腦梗死面積減小可能是因為再灌注后,半暗帶的細胞得到了一部分血液與氧的供應,細胞能繼續存活。TTC染色結果顯示,運動預處理后的大鼠腦梗死面積較小,且神經功能損傷表現減輕,這提示腦梗死面積與神經學評分有關聯。
Ding等[6]研究發現,運動預處理后不進行腦缺血再灌注,大鼠TNF-αmRNA和細胞間黏附因子1的表達水平隨運動時間的增加而增加,這提示運動可能增加炎性因子的表達。本研究中,在缺血再灌注處理后,相關炎性因子的表達明顯減少,這可能與炎性因子不同有關,也可能與假手術有關,假手術產生創傷也可能增加炎性因子的表達。另外,Comassi等[7]研究發現,正常安靜狀態下運動員血清IL-1β和IL-18水平顯著高于體力活動不足者;一次運動后,體力活動不足者血清IL-1β水平升高,但運動員血清IL-1β水平下降,IL-18水平明顯下降,說明運動應激可增加IL-1β和IL-18促炎因子或相關蛋白的表達,長期的運動后,機體可能對單次運動應激反應產生了適應,血清IL-1β、IL-18水平下降可能與機體對應激耐受的提高有關。本研究發現,P組大鼠血清IL-1β、IL-18水平與SS組比較,并無統計學差異,這可能與運動時間或運動周期有關;而EM組與CM組比較,血清IL-1β、IL-18水平明顯降低,這提示經過運動預處理后機體可能對應激刺激做出了適應。本研究中,MCAO后大鼠血清炎性因子IL-1β和IL-18水平升高,提示IL-1β和IL-18可能是與正常細胞的細胞膜受體IL-1R和IL-18受體結合,促使細胞通路激活。IL-1β的分泌可能存在其他機制,在中性粒細胞和人單核細胞中,IL-1β可以在沒有焦磷酸作用的情況下釋放[8]。另外,IL-18與IL-18受體結合并發出信號,在NK細胞中誘導IFN-γ分泌,從而使Th1發生炎癥反應,在退行性神經疾病中,IFN-β/IL-1β軸的活化可能對疾病產生影響[9]。Kaiser等[10]研究發現,P2RX7-/-小鼠在MCAO后腦水腫更加明顯,并伴隨著更嚴重的神經功能損傷。但Ye等[11]研究發現,小鼠腦缺血再灌注后,P2RX7、Caspase-1在缺血腦組織中的表達顯著增加,給予P2RX7抑制劑注射后,小鼠缺血性腦組織中的P2RX7蛋白表達水平降低且腦梗死面積減少,腦卒中后的功能得到改善。本研究中,CM組大鼠腦組織P2RX7、Caspase-1、Caspase-11、GSDMD蛋白顯著升高,提示缺血性腦卒中會激活炎癥小體活化通路。Young等[12]研究發現,eATP濃度升高,細胞膜上的離子通道打開,ATP大量進入細胞內,細胞內K+大量外流,細胞穩態被破壞,細胞興奮性毒性增加,這不利于細胞的存活。有研究發現,Caspase-11非經典炎癥小體激活的2個標志是IL-1β和IL-18的分泌及磷酸化[13]。目前認為,Caspase-11可能通過炎癥小體或直接調控Caspase-1蛋白增加Caspase-1蛋白的表達[14]。本研究中,CM組血清IL-1β和IL-18水平明顯增加,EM組血清IL-1β和IL-18水平明顯下降,趨勢與Caspase-11蛋白表達一致,這提示P2RX7、Caspase-11可能是Caspase-1的上游蛋白,運動預處理可能增加了腦組織在缺血、缺氧情況下的組織耐受,降低Caspase-11蛋白的表達,減少炎性小體的形成和GSDMD的表達。Zhao等[15]研究發現,腦缺血再灌注后3 h注射Caspase-1抑制劑可對大鼠MCAO后海馬區域提供神經保護作用,小鼠MCAO造模后30 min內神經元Caspase-1被迅速激活。GSDMD作為Caspase-1的底物,在腦缺血再灌注后表達升高,GSDMD的過表達可以提高IL-1β和IL-18的水平[16]。Yi[17]研究發現,從GSDMD-/-小鼠分離的巨噬細胞,在受到LPS和細菌感染時不會發生細胞焦亡,炎性因子IL-1β分泌減少,并且對LPS誘導的感染產生抗性。本研究發現,MCAO后GSDMD蛋白的表達變化可能是上游蛋白表達升高所致,Caspase-1、Caspase-11等蛋白表達的增加都會導致GSDMD蛋白表達的增加。
綜上所述,本研究發現,4周運動預處理可改善大鼠腦缺血再灌注后的梗死面積、細胞壞死和神經功能損傷,對腦組織和神經元具有保護作用,同時可減少大鼠腦缺血再灌注損傷后P2RX7、Caspase-1、Caspase-11、GSDMD蛋白的表達,減少大鼠腦缺血再灌注后血清IL-1β、IL-18的含量,降低炎癥水平。本研究結果為防治缺血性腦卒中提供了理論線索和實驗依據。

