基于CRISPR/Cas9的擬南芥CKX3基因編輯載體構建及轉化研究
王澤琛 肖 榮 歐陽樂軍* 李莉梅 梁楚炎 潘璟茵 劉智超
(1. 喀什大學生命與地理科學學院,葉爾羌綠洲生態與生物資源研究高校重點實驗室,喀什 844000;2. 廣東石油化工學院生物與食品工程學院,茂名 525000)
植物生命活動的正常代謝由激素調控,其影響著植物的生命周期中的全過程。植物激素包括有生長素(auxin)、細胞分裂素(cytokinin,CK)、赤霉 素(gibberellin,GA)、脫 落 酸(abscisic acid,ABA)、油菜素甾醇類(brassinosteroids,BRs)、乙烯(ethylene,Eth)、茉莉酮酸酯類(jasmonates,JAs)、多胺(polyamines,PAs)以及水楊酸類(salicylic acid,SAs)等九大類[1],這些激素在植物體內構成一個復雜的調控網絡,調控著植物生命周期中的各階段。
細胞分裂素氧化酶(cytokinin oxidase,CKX)在20 世紀70 年代首次發現于煙草的髓組織培養物粗勻漿中,之后隨著研究的深入在菜豆、蠶豆、小麥和玉米中相繼被報道[2]。CKX 是一種黃素酶,對DNA 的次級代謝產物—細胞分裂素(CK)有著很強的專一性。CKX 是目前已知的專一降解天然異戊烯類CK 及其核苷的酶,該反應為不可逆降解,被認為是調節植物內源CK 含量的關鍵因素之一[3]。在CKX 發現之后的十多年中,絕大多數學者認為CKX 為含銅的胺氧化酶,在催化反應中其活性受到氨基乙腈和氰化物強烈抑制并且需要分子氧參與。研究表明CKX可以降解作為電子受體的2,6-二氯靛酚。隨后,代謝產物H2O2在玉米重組CKX的研究中檢測不到[4]。證明從大麥和小麥中純化的CKX 的催化反應無需氧且不產生H2O2,因此建議將該酶更名為脫氫酶[5]。目前,在多種植物中CKX基因已經被克隆鑒定。經研究發現,在不同的物種中CKX基因均為多基因家族[6]。隨著植物CKX基因的獲取、轉基因技術的發展以及模式植物的建立,極大加快研究CKX基因的功能的步伐。在轉CKX的擬南芥植株中,CKX 的代謝明顯增強,同時CK 的含量減少,轉基因植株的表型為根部異常發達,而地上莖矮小[7]經過科學家們多年的研究證明,CK 對地上部分莖為促進作用,而對地下部分的根系統為負調控作用[8]。在擬南芥中轉入Ds CKX1基因后,該植株表現出CK 不足的性狀[9]。也有研究表明在調控植物相關花器官的發育過程中CKX 也起到十分重要的作用,在玉米中花特異性啟動子下游轉入ZmCKX1基因,在啟動子的控制下,轉基因植株花芽檢測到CK 含量顯著地減少,并表現出雄性不育的癥狀[10]。作為降解CK的酶CKX廣泛存在于植物各個部位,因此研究CKX的功能和代謝具有重要的現實意義。
CRISPR/Cas是細菌和古菌在長期進化過程中形成的一種免疫系統,該系統可以抵抗外源性的遺傳物質的入侵,為它們提供獲得性免疫。CRISPR/Cas 系統可以精準識別出外源性遺傳物質,并將外源基因切斷并沉默其表達[11]。正是因為這種精準的靶向功能,所以成為一種快速高效的基因組編輯工具。在自然界中,CRISPR/Cas9 系統是CRISPR/Cas 系統眾多類型中的一種,而其在實際應用中更適合于基因編輯,因此對其研究最深入,應用相對比較成熟。利用CRISPR/Cas9 系統,在模式植物擬南芥中,選取部分其CKX基因構建一種帶有紅色熒光蛋白基因mCherry定向敲除基因的CRISPR/Cas9 載體。在轉化后進一步檢測擬南芥CKX基因編輯后對于其生長發育的影響。將可視化篩選與分子鑒定相結合,為后續研究純合轉基因后代RNA 豐度、激素水平提供材料。純合轉基因子代還可再進行敲除,達到CKX基因家族的單敲除、部分敲除,甚至完全敲除。本研究建立的高效編輯載體不僅局限于模式植物的應用,還可進行更多生物的基因編輯研究。從而為植物功能基因編輯、植物激素調控研究提供借鑒與參考。
1 材料和方法
1.1 主要試驗材料
本試驗所用的帶有熒光篩選標記基因mCher‐ry的質粒pHDE-mCherry由加州大學(圣地亞哥分校)Professor Zhao Yunde 贈送,DH5α大腸桿菌感受態細胞和GV3101 農桿菌感受態細胞分別購自廣州鼎國生物技術有限公司和上海維地生物技術有限公司,Col-0 野生型擬南芥生長于廣東石油化工學院植物培養室。
1.2 主要試驗試劑
質粒小提試劑盒、瓊脂糖凝膠DNA 回收試劑盒、Platinum SuperFi ⅡDNA 聚合酶購于賽默飛公司、Epicentre T5 exonuclease、Husion DNA polymerase(DNA 聚合酶)、BsaI 限制性內切酶和Taq DNA Ligase(DNA 連接酶)購自NEB 公司(美國),DNA Loading Buffer、氯霉素、卡那霉素、Tiangen DNA Marker 購自天根生化(北京)科技有限公司、引物合成及基因測序在上海生物工程有限公司完成,二硫蘇糖醇(DTT)購自碧云天生物技術公司。
1.3 靶位點的設計
在NCBI 上查閱下載擬南芥CKX3、CKX4、CKX7基因序列,以此目標序列。通過CRISPR/Castarget 在線設計網站(http://crispr.dbcls.jp)分別設計CKX基因的2個Target位點。
1.4 引物設計
實驗所用引物均在NCBI引物在線設計,并由上海生工生物工程股份有限公司進行合成(見表1)。
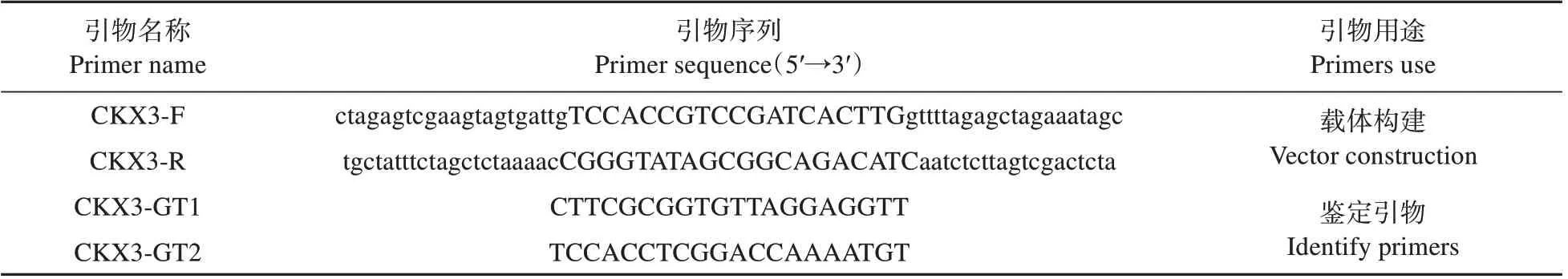
表1 引物序列Table 1 Primer sequence used in the expriment
1.5 pHEE401-mCherry-CKX表達載體的構建
1.5.1CKX3sgRNA片段的擴增
以pCBC 質粒(含gRNA)為模板,CKX3-F 和CKX3-R 為引物,進行PCR 擴增,反應程序:預變性94℃4 min,35 個循環(變性94℃30 s,退火56℃30 s,延伸72℃45 s),總延伸72℃2 min,4℃保存。然后使用1.4%的瓊脂糖凝膠進行PCR 產物檢驗,將符合預期結果的目的條帶切膠,用瓊脂糖凝膠DNA 回收試劑盒進行回收。CKX4和CKX7的sgRNA片段按照上述方法進行擴增獲取。
1.5.2 質粒pHEE401-mChenry的酶切及同源重組
用BasⅠ酶對pHEE401E 質粒進行酶切,酶切緩沖液(Cutsmart)2.0 μL,BsaⅠ(10U)0.8 μL,pHEE401E 質粒(850 ng·μL-1)3.0 μL,ddH2O 補足至20.0 μL,37℃反應6 h,以未酶切質粒為對照,將酶切好的質粒進行1.0%的瓊脂糖凝膠電泳進行驗證。
將CKX3純化回收到的目的片段與酶切產物進行同源重組,5.0 μL體系(重組酶2.5 μL,酶切質粒0.5 μL,目標sg RNA片段2 μL),50℃水浴1 h。
1.5.3 重組產物轉化大腸桿菌與菌液PCR鑒定
利用熱擊法將重組產物導入DH5α 感受態細胞,將轉化后的DH5α 感受態細胞在LB 固體培養基上(含Kan)培養12 h。每個同源載體從轉化后的培養基上挑取單克隆,接種至500 μL LB培養基中,37℃下200 r·mim-1搖床培養5 h 后進行PCR 鑒定。反應程序:預變性94℃4 min,35個循環(變性94℃30 s,退火56℃30 s,延伸72℃45 s),總延伸72℃2 min,4℃保存。
1.5.4 重組PHEE401-mCherry-CKX的質粒提取與重組質粒鑒定
將菌液PCR 結果符合預期的菌液在LB 液體培養基中(含50 mg·mL-1卡那霉素)擴繁培養,并于37℃搖菌12 h,用質粒小提試劑盒提取重組質粒,并進行質粒PCR 鑒定,反應條件同菌液PCR。挑選質量較好的的重組質粒送到生工生物工程股份有限公司(廣州)測序,并用Mega7 軟件進行序列比對。
1.6 擬南芥的轉化
1.6.1 重組質粒轉化農桿菌及浸染液的配制
將測序成功的質粒轉入農桿菌感受態細胞,制備工程菌浸染液。
1.6.2 擬南芥的浸染
選用未開放花苞的Col野生型擬南芥,如果已經開放花蕾的植株,需在浸染前1 d 前將所有已經開放的花蕾以及出現的果莢剪除。用配置好的工程菌浸染液浸染花苞,并輕輕攪動,在浸泡1~2 min 后取出,并用小木棍將其固定支撐植株,葉片以及莖上的殘留液體用吸水紙吸除,使用保鮮膜將浸泡好的擬南芥罩住,并留有一定孔洞透氣,暗培養3 d 后正常培養,待新一批花苞長出時再次浸染。在果莢成熟后及時收取,并做好標記。
1.7 轉化后代的可視化篩選與鑒定
將轉化后的種子命名為T0,然后利用倒置熒光顯微鏡在T0代種子中篩選帶有紅色熒光的種子并種植,得到的植株命名為T1。
觀察T1植株的表型是否與野生型植株有所異同,并剪取T1植株(尤其是性狀特殊)幼嫩葉片,提取植株的DNA,以此為模板,并利用對應CKX基因的GT1 和GT2 這對鑒定引物對目標序列進行PCR擴增,并用1.0%的瓊脂糖凝膠電泳后初步鑒定目的基因打靶的優劣。
選取電泳結果符合預期的植株,再次提取其基因組,并使用高保真Pfu 酶再次PCR,并使用1.0%瓊脂糖凝膠電泳,用DNA 凝膠回收試劑盒回收PCR 產物,并送往生工生物工程股份有限公司(廣州)測序。使用Mega7 軟件進行序列比對驗證目標基因編輯情況。
1.8 擬南芥突變體激素測定
取CKX3 純合突變體幼苗的全部根部進行激素提取和測定。操作步驟為:突變體幼苗全部根部樣品用液氮研磨,經異丙醇/鹽酸、二氯甲烷處理、氮氣除有機相、甲醇(1%甲酸)溶解后,進行HPLC-MS/MS檢測。
取野生型幼苗全部根部進行激素提取和測定。方法如同突變體提取。
2 結果與分析
2.1 pHEE401E-mCherry-CKX3 表達載體的構建結果
經PCR 擴增目的基因條帶CKX3sgRNA(見圖1A),大小為600 bp 左右,與預期擴增長度610 bp相符,切膠回收后可與酶切后的質粒同源重組。
重組質粒經熱激法導入DH5α感受態細胞后,菌液PCR 結果(見圖1B)顯示,擴增條帶大小與預期結果相符。選取圖1B 中符合預期結果的菌液進行擴大培養之后,分別提取CKX3sgRNA 的pHEE401E-mcherry-CKX3表達載體質粒,進行質粒PCR 檢驗結果(見圖1C),與預期結果相符。表明分別含有CKX3sgRNA、的pHEE401E-mCherry-CKX表達載體構建成功。
2.2 重組質粒pHEE401E-mCherry-CKX 轉化農桿菌結果
將重組好的pHEE401E-mCherry-CKX3質粒分別轉化GV3101農桿菌感受態細胞;為驗證轉化是否成功進行菌液PCR 鑒定(見圖2),由圖2 可知,條帶大小600 bp 左右,與預期結果相符,證明農桿菌轉化工程菌轉化成功。
2.3 轉化Col野生型擬南芥后的可視化篩選
在構建好含有擬南芥種皮重組啟動子的重組質粒中啟動熒光篩選標記,mCherry基因的紅色熒光標記轉化成功的T0種子,在580 nm 激發光中會發出紅色熒光;沒有轉化成功的種子不會發出熒光(見圖3)。基于這種可視化的篩選方法,能夠更加快速篩選出陽性轉化后代,極大地提高工作效率。
2.4 CKX3轉化陽性T1后代分子鑒定
將陽性T0后代種子種植,在萌發后提取幼嫩葉片的DNA進行分子鑒定(見圖4A),圖4A顯示在轉化中有部分呈現出兩條帶的結果:一條為1 000 bp左右,另一條則為750 bp 左右,在與野生型結果條帶(大約1 000 bp)對照可知為雜合子,即敲除CKX3等位基因中1個;另一情況為單一條帶為500 bp左右且清晰,可知為完整敲除CKX3基因的純合突變。
將鑒定結果中的純合子,進行移栽成長之后再次進行DNA 基因組提取鑒定(見圖4B)。圖4B呈現單一500 bp 左右的條帶,再次表明敲除成功。將PCR 產物進行切膠回收,將其送往上海生工廣州分公司進行測序(見圖5),表明在位于兩個Target 位點之間的CKX3基因大片段敲除,與預期設計完全致。
2.5 CKX3轉化陽性T0后代性狀分析
T0后代中經可視化篩選,將陽性純合擬南芥植株培養成熟,并與野生型對比(見圖6);結果表明陽性純合敲除CKX3基因的植株,相較野生型產生了自身解除頂端優勢的性狀,并可以明顯觀察到植株的主莖明顯變粗,側枝生長旺盛。由此可見,在當CKX3基因敲除之后,CK 代謝發生改變,持續積累于植株體內。結果導致自解除頂端優勢,植株橫向發展(桿莖變粗)。
2.6 CKX3轉化陽性T1后代激素測定
經激素檢測GA3、ABA、6-BA 在突變體中分別是0.503、3.633、4.280 ng·g-1,野生型含量分別為是0.190、2.766、3.223 ng·g-1經差異顯著性檢驗都達到顯著水平,且突變體中激素含量均比野生型擬南芥有所提高(見圖7)。
3 討論
在進行分子設計育種和功能基因組學基礎研究的重要材料是植物突變植株,同時也是研究植物體內激素含量、代謝機理的重要材料。常規的植物突變體來源于劇烈的外界環境因素影響如物理、化學等因素或者自身DNA的錯配導致突變,具有很大的盲目性和局限性,不能滿足大規模的分子設計育種和功能基因組學研究的需求。隨著生物技術的發展,在進行目標基因打靶的需求下,作為第三代基因編輯的技術CRISPR/Cas 就表現出其優越性,CRISPR-Cas技術因其操作便捷、有效得到廣泛使用[12]。到目前為止,廣泛使用的CRISPR/Cas 技術包括Ⅱ型的Cas9 以及Ⅴ型的Cas12a[13]具有成本低廉,操作簡易方便且基因編輯效率的高效性的優點,只需將目標靶位基因設計入sgRNA中,并與Cas9 組裝便可獲取打靶載體[14]。其次,CRISPR/Cas9 技術體系在完成對目的基因的遺傳編輯之后,在形成合子的時候伴隨染色體的自由組合,加上一定的外界人工干預可在編輯后代中不留下轉基因的痕跡、剔除外源基因、生物安全性高。特別在近年CRISPR/Cas9 技術的研究潮來臨,其所具有的優勢得到更一步挖掘和利用,應用范圍也將越來越廣泛,對任何物種的基因組編輯成為可能,促使更加深入了解各種基因的功能作用。
在基因編輯中,編輯目的靶位基因的成功表達檢測是一件較為繁瑣、成本較高的事情;在考慮目的靶位基因的表達高效性同時需要考慮基因表達的時間、空間特異性。利用來自于蘑菇珊瑚的紅色熒光蛋白mCherry,所編碼的蛋白具有很強的光穩定性[15]。在熒光顯微鏡的特定波長的激發下,應用外源轉化元件具有熒光的特點。本研究中將種皮特異性啟動子At2S3促使其表達,實現在轉化后代中可視化篩選出陽性轉化種子。CRISPR/Cas9表達系統的方法簡單便于操作,基因打靶精度和效率都較高[16],經過可視化篩選后基因編輯植株的檢測只需要進行簡單的PCR 驗證,即可確定是否獲得基因編輯陽性的植株后代。
本研究分別通過設計CKX3的sgRNA,使其識別基因靶向序列,提高打靶特異性,最終構建pHEE401E-mCherry-CKX3的高效編輯載體,進行CKX3基因打靶。CKX 為降解CK 的活性酶類,當CKX 含量和活性受到影響,將造成CK 在植物體內的累積,并出現自身頂端優勢解除的性狀,側面證明CK 可能為植物控制腋芽生長的信使。有研究證明當對植株打頂后,在之后6 h 可在腋芽檢測到大量的CK[17]。并可在純合植株的基礎上,進行RNA 研究,進一步去驗證CKX3基因對植物CK 代謝影響;另一方面也可將CKX4、CKX7載體浸染純合植株,獲得雙突、多突的純合植株,甚至將CKX家族全員敲除,更進一步研究CKX基因。進而通過CK 代謝控制為農業、林業等經濟型植物的種植生產活動增產增收。但在具體應用、降低脫靶概率、提高基因重組效率和基因編輯后的優良性穩定遺傳等仍是需要深入探究的問題。

