經(jīng)口氣管插管激發(fā)和霧化激發(fā)建立哮喘小鼠模型的比較
胡婕,鄒文靜,王韻婷,牛超,符州,代繼宏
1.兒童發(fā)育疾病研究教育部重點(diǎn)實(shí)驗(yàn)室、兒童發(fā)育重大疾病國(guó)家國(guó)際科技合作基地、兒科學(xué)重慶市重點(diǎn)實(shí)驗(yàn)室,重慶 400014;2.重慶醫(yī)科大學(xué)附屬兒童醫(yī)院呼吸中心,重慶400014
支氣管哮喘(簡(jiǎn)稱哮喘)是世界范圍內(nèi)嚴(yán)重威脅公眾健康的慢性病,其發(fā)病率在發(fā)達(dá)國(guó)家高達(dá)15%~20%,在中國(guó)也有2%~4%[1],特別是近年兒童哮喘發(fā)病率較十年前上升了43.4%[2],提示現(xiàn)有哮喘防治措施嚴(yán)重不足,需要引起社會(huì)的廣泛關(guān)注。當(dāng)前小鼠哮喘模型是全世界進(jìn)行哮喘研究最廣泛的動(dòng)物模型[3],但其構(gòu)建方法存在較大差異,特別在致敏原劑量、致敏后激發(fā)方式上有較大不同[4,5],對(duì)小鼠哮喘模型建立的最優(yōu)方案暫無(wú)廣泛共識(shí)。
目前哮喘模型的激發(fā)方式主要有滴鼻吸入激發(fā)和霧化吸入激發(fā)兩種[6],但這兩種激發(fā)方式都不能完全對(duì)小鼠吸入氣管的過(guò)敏原定量,如在滴鼻激發(fā)時(shí),因鼻腔和口腔的連接,不能夠確定藥物是否進(jìn)入氣道以及進(jìn)入氣道的劑量,造成同批次哮喘模型的不穩(wěn)定。若增加過(guò)敏原的滴鼻劑量和次數(shù)會(huì)提高小鼠的死亡率。在霧化激發(fā)時(shí),國(guó)內(nèi)多自制霧化盒對(duì)小鼠進(jìn)行霧化[7];霧化時(shí),因盒內(nèi)OVA濃度易波動(dòng),小鼠藥物吸入劑量不能明確,易造成哮喘建模不穩(wěn)定,造成模型數(shù)據(jù)差異偏大。故尋找一種激發(fā)方式既能精準(zhǔn)定量定位,又能夠提高模型穩(wěn)定性是十分必要的,因此本研究嘗試在不同的致敏劑量的基礎(chǔ)上采用經(jīng)口氣管插管(intratracheal instillation,ITI)[8]和霧化(atomizing inhalation,INH)的激發(fā)方式建立小鼠哮喘模型,從氣道炎癥、氣道高反應(yīng)性(airway hyperresponsiveness,AHR)以及血清總IgE等方面比較[9,10],探討建立一種穩(wěn)定、理想的小鼠哮喘模型。
1 材料與方法
1.1 材料
雞卵清蛋白(ovalbumin,OVA,Sigma-Aldrich,U.S.A);氫氧化鋁凝膠(Aluminum Hydroxide Gel,Alum,Sigma-Aldrich,U.S.A);乙酰甲膽堿(methacholine,Ach,Sigma-Aldrich,U.S.A);糖原PAS染色試劑(雷根生物技術(shù),中國(guó));Masson染色試劑盒(雷根生物技術(shù),中國(guó));ELISA檢測(cè)試劑盒(欣博盛生物科技,中國(guó));小鼠無(wú)創(chuàng)肺功能儀(EMKA,F(xiàn)rance)。
1.2 實(shí)驗(yàn)動(dòng)物及模型建立
1.2.1 實(shí)驗(yàn)動(dòng)物及分組6~8周齡SPF級(jí)雌性BALB/c小鼠,體重18~22 g,購(gòu)于重慶醫(yī)科大學(xué)實(shí)驗(yàn)動(dòng)物中心,飼養(yǎng)于重慶醫(yī)科大學(xué)附屬兒童醫(yī)院實(shí)驗(yàn)動(dòng)物中心SPF級(jí)動(dòng)物房,室溫22~26℃,濕度55%~60%,光照12 h/d。將小鼠隨機(jī)分為5組:對(duì)照組、20-INH組、100-INH組、20-ITI組、100-ITI組,每組6只。
1.2.2 致敏 建模哮喘組小鼠均于0、7、14 d經(jīng)腹腔、大腿根部皮下各注射100μl致敏液(內(nèi)含20μg OVA或100μg OVA,100μl Alum)致敏,對(duì)照組用相同的方法注射同體積的生理鹽水。
1.2.3 激發(fā) 霧化激發(fā)組(20-INH組、100-INH組)于第21~30 d置入霧化箱內(nèi),予1%OVA溶液超聲霧化吸入,每天30 min(圖1A)。經(jīng)氣管給藥激發(fā)組(20-ITI組、100-ITI組)于第21 d,水合氯醛(3 ml/kg)腹腔注射進(jìn)行麻醉后,固定于解剖臺(tái)上,用眼科鑷將小鼠的舌頭從口中輕輕牽出,用自制的插管裝置[11]在發(fā)光耳勺的引導(dǎo)下插入插管裝置,待小鼠呼吸平穩(wěn)后緩慢滴入50μl激發(fā)液(含50μg OVA),48 h后重復(fù)1次,共5次(圖1B)。對(duì)照組以等量生理鹽水代替OVA致敏液及激發(fā)液,其余處理同哮喘組。
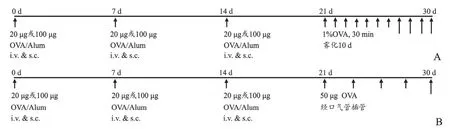
圖1 哮喘模型造模方法A:霧化激發(fā)建立小鼠哮喘模型方法B:經(jīng)口氣管插管建立小鼠哮喘模型方法Fig.1 Establishment of asthma modelA:Establishment of mouse asthma model by atomizing inhalation;B:Establishment of mouse asthma model by intratracheal instillation
1.3 指標(biāo)檢測(cè)
1.3.1 氣道高反應(yīng)性測(cè)定 每組取6只小鼠于末次激發(fā)后24 h內(nèi)用EMKA體積描記儀檢測(cè)小鼠氣道高反應(yīng)性,先測(cè)定基礎(chǔ)肺功能值2 min,再給予不同濃度的Ach(0、3.125、6.25、12.5、25、50 mg/ml)霧化3 min,休息2 min后記錄5 min,完成后收集增強(qiáng)的呼氣間歇(enhanced pause,Penh)數(shù)據(jù)[10],取其平均值分析小鼠氣道高反應(yīng)性。
1.3.2 支氣管肺泡灌洗液(BALF)的灌取及細(xì)胞計(jì)數(shù) 小鼠于末次激發(fā)24 h內(nèi)用10%水合氯醛麻醉,取眼球血后斷頸處死,仰臥固定,充分暴露氣管和胸腔,用止血鉗鉗夾左肺肺門處,留置針插入氣管并固定,用預(yù)冷無(wú)菌PBS溶液進(jìn)行右肺支氣管肺泡灌洗,共3次,每次0.5 ml,回收率在80%以上。2500 r/min,4℃離心5min,收集上清液。細(xì)胞沉渣加入1 ml PBS稀釋,充分混勻后取20μl進(jìn)行細(xì)胞計(jì)數(shù),剩余懸液,4℃,2500 r/min離心5 min,棄上清液,取細(xì)胞沉淀涂片,晾干后行瑞氏染色細(xì)胞分類計(jì)數(shù)。
1.3.3 病理染色 小鼠支氣管肺泡灌洗液灌洗后松開左側(cè)肺門處止血鉗,取出左肺放入4%的中性甲醛內(nèi)固定48 h,經(jīng)脫水、石蠟包埋后切成4μm薄片,黏附于載玻片上,放入60℃烘箱烘烤48 h后分別進(jìn)行HE染色、PAS染色和Masson染色,光鏡下觀察肺部病理情況。
1.3.4 血清中總IgE含量檢測(cè) 將小鼠眼球血,常溫,2500 r/min離心10 min,取上清,再常溫,2500 r/min離心5 min,取上清,參照ELISA檢測(cè)試劑盒說(shuō)明檢測(cè)血清中IgE含量。
1.4 統(tǒng)計(jì)學(xué)處理
采用Graph Pad Prism 6.0軟件進(jìn)行統(tǒng)計(jì)分析,數(shù)值以平均值±標(biāo)準(zhǔn)差(±s)表示,各組小鼠BALF細(xì)胞計(jì)數(shù)、肺部炎癥情況及血清IgE水平用One-way ANOVA或Turkey檢驗(yàn);組間小鼠氣道高反應(yīng)性比較用Two-way ANOVA。P<0.05為差異有統(tǒng)計(jì)學(xué)意義。
2 結(jié)果
2.1 小鼠氣道高反應(yīng)性檢測(cè)結(jié)果
隨著Ach濃度的增高,各組小鼠AHR也逐漸增加。在Ach濃度為0、3.125、6.25 mg/ml時(shí),20-INH、100-INH、100-ITI三組的AHR與對(duì)照組無(wú)統(tǒng)計(jì)學(xué)差異(P>0.05)。在Ach濃度為12.5、25、50 mg/ml時(shí),20-INH、100-INH、100-ITI三組的AHR較對(duì)照組明顯升高(12.5 mg/ml:F=2.265,P=0.002;25 mg/ml:F=30.34,P<0.0001;50 mg/ml:F=15.57,P<0.0001);20-INH組、100-INH組和100-ITI組間無(wú)統(tǒng)計(jì)學(xué)差異(P>0.05)。20-ITI組AHR與對(duì)照組相比在Ach各濃度均無(wú)統(tǒng)計(jì)學(xué)差異(P>0.05)(圖2)。
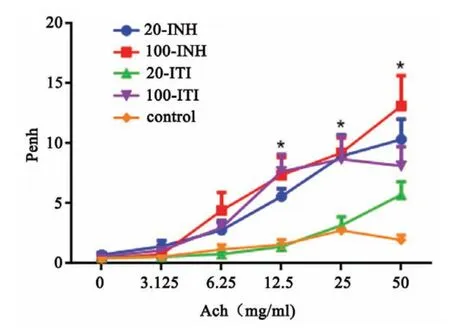
圖2 各組小鼠氣道高反應(yīng)性*P<0.05,n=6Fig.2 Airway hyperresponsiveness of mice for each group*P<0.05,n=6
2.2 BALF細(xì)胞總計(jì)數(shù)及分類計(jì)數(shù)結(jié)果
20-INH組[(11.56±2.03)×105]、100-INH組[(7.45±2.49)×105]、100-ITI組[(9.47±1.79)×105]與對(duì)照組細(xì)胞總數(shù)[(2.403±0.94)×105]相比明顯增多(F=27.81,P<0.0001)。其中20-INH組細(xì)胞總數(shù)均值最高,100-ITI組次之,兩者相比有統(tǒng)計(jì)學(xué)意義(F=5.625,P=0.015),100-INH組與100-ITI組無(wú)統(tǒng)計(jì)學(xué)差異(F=1.971,P=0.4734)。20-ITI組[(3.403±1.44)×105]細(xì)胞總數(shù)最低,與對(duì)照組無(wú)明顯差異(T=2.331,P=0.3745)(圖3A)。
各哮喘組與對(duì)照組相比嗜酸性粒細(xì)胞總數(shù)明顯升高(F=23.22,P<0.0001),其中100-ITI組升高最明顯,20-ITI升高最不明顯。20-INH組與100-INH組結(jié)果類似,無(wú)明顯統(tǒng)計(jì)學(xué)差異(F=1.5,P=0.6672);100-ITI組嗜酸性粒細(xì)胞明顯高于20-ITI組,兩者有統(tǒng)計(jì)學(xué)差異(T=5,P=0.0005)(圖3B)。
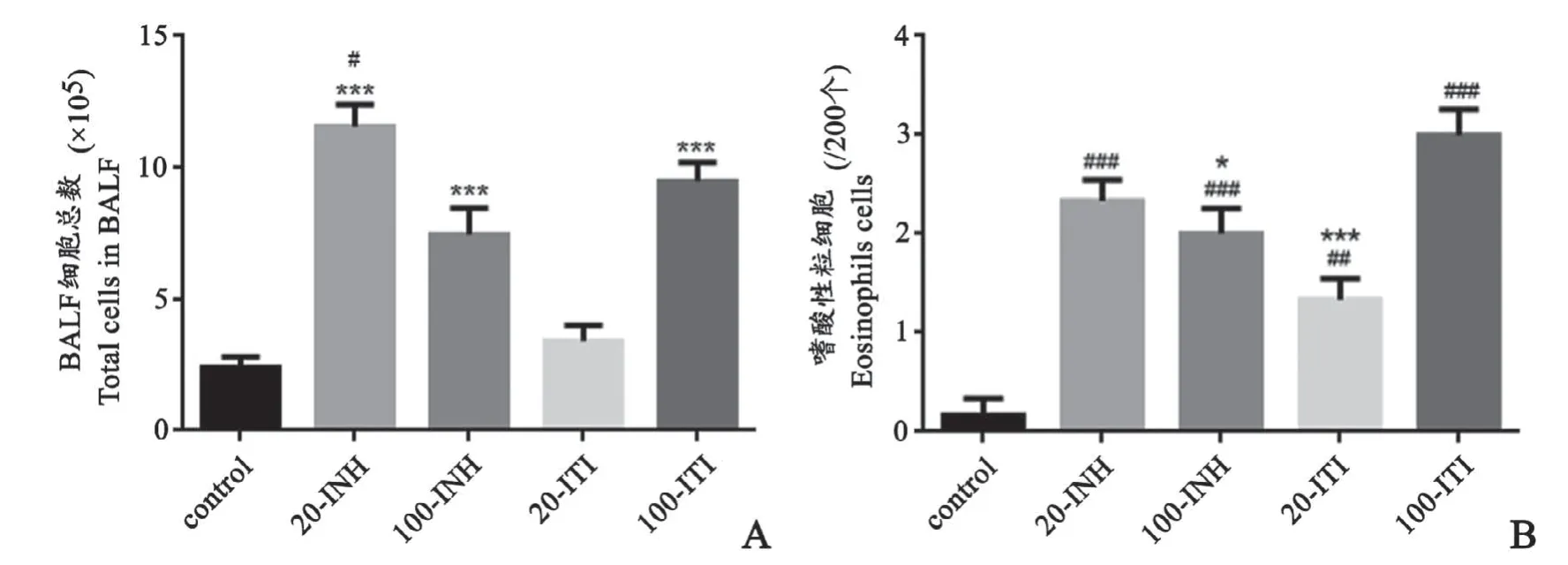
圖3 各組BALF細(xì)胞分類計(jì)數(shù)A:與對(duì)照組相比,***P<0.001,與100-INH組相比,#P<0.05 B:與對(duì)照組相比,##P<0.01,與100-ITI組相比,*P<0.05,***P<0.001 n=6Fig.3 Numbers of total cells and eosinophils cells in BALF of the miceA:compared with control group,***P<0.001,#P<0.05;B:compared with control group,##P<0.01,compared with 100-ITI group,*P<0.05,***P<0.001,n=6
2.3 肺組織病理切片HE染色結(jié)果
各哮喘組小鼠氣道和血管周圍均有大量炎癥細(xì)胞浸潤(rùn),但20-ITI組較其他3組模型組氣道及血管周圍炎癥細(xì)胞浸潤(rùn)程度較低。病理炎癥評(píng)分結(jié)果顯示:哮喘模型組炎癥評(píng)分均明顯高于對(duì)照組(F=98.62,P<0.0001),20-INH、100-INH、100-ITI 3組間病理炎癥評(píng)分無(wú)明顯差異(F=3.1,P=0.07),20-IHN、100-IHN和100-ITI組均明顯高于20-ITI組(F=42.12,P<0.0001),提示20μg OVA致敏劑量下,經(jīng)口氣管插管激發(fā)建模效果稍差(圖4)。

圖4 各組小鼠肺組織HE染色A:對(duì)照組B:20-INH組C:100-INH組D:20-ITI組E:100-ITI組F:病理炎癥評(píng)分,與對(duì)照組相比,***P<0.01,n=6Fig.4 HE staining of lung tissue in each group of miceA:control group;B:20-INH group;C:100-INH group;D:20-ITI group;E:100-ITI group;F:pathological inflammation score,compared with control group,***P<0.01,n=6
2.4 肺組織病理切片PAS糖原染色結(jié)果
糖原PAS染色反應(yīng)物質(zhì)為紅色或紫紅色,代表氣道粘液的分泌。20-INH組、100-INH組、100-ITI組較對(duì)照組氣道粘液分泌明顯增多(F=54.8,P<0.0001),其中100-ITI組氣道粘液分泌最為明顯,明顯高于其它各組(F=34.88,P<0.0001);20-INH組與100-INH組氣道分泌粘液無(wú)明顯差異(F=1.117,P=0.906);20-ITI組粘液分泌量低于其他3個(gè)哮喘組(F=34.88,P<0.0001),提示20μg OVA致敏劑量下,經(jīng)口氣管插管激發(fā)建模氣道粘液分泌效果較差。此外,各組組內(nèi)穩(wěn)定性比較中,100-ITI組(SD=34.39)低于20-INH組(SD=36.59)和100-INH組(SD=34.62),該組數(shù)據(jù)離散程度最低(圖5)。
2.5 肺組織病理切片Masson染色結(jié)果
各哮喘組小鼠器官周圍無(wú)明顯膠原蛋白沉積,無(wú)明顯的纖維增生,無(wú)氣道重塑的改變,其中100-ITI組纖維增生較對(duì)照組有增多,但無(wú)統(tǒng)計(jì)學(xué)意義(F=0.25,P=0.90)(圖6)。
2.6 血清中總IgE含量檢測(cè)結(jié)果
通過(guò)ELISA檢測(cè)各組小鼠眼球血血清可知,各哮喘組血清中總IgE含量明顯高于對(duì)照組,差異有統(tǒng)計(jì)學(xué)意義(F=40.36,P<0.0001),100-ITI組血清總IgE含量最高(F=9.85,P=0.0019),20-INH組與100-INH組相比無(wú)統(tǒng)計(jì)學(xué)差異(F=2.746,P=0.2918);20-ITI較其它哮喘組IgE水平最低(F=20.27,P<0.0001),提示經(jīng)口氣管插管激發(fā)下,20μg致敏劑量升高哮喘模型血漿IgE效果欠佳。此外,20-ITI(SD=0.17)、100-ITI(SD=0.37)組內(nèi)差異小于20-INH(SD=0.71)、100-INH(SD=0.43),提示經(jīng)口氣管插管激發(fā)引發(fā)哮喘模型的IgE水平升高更穩(wěn)定(圖7)。
3 討論
過(guò)敏性哮喘是一種異質(zhì)性疾病,影響了全世界數(shù)百萬(wàn)人,并且每年的發(fā)病率穩(wěn)步上升[12]。哮喘的發(fā)病機(jī)制十分復(fù)雜,小鼠哮喘模型在很大程度上促進(jìn)了對(duì)哮喘病理生理機(jī)制的理解[13]。目前在建立小鼠哮喘模型的方法中,多采用BALB/c和C57BL/6近交系小鼠,雞卵清蛋白和屋塵螨為過(guò)敏原,腹腔注射或滴鼻等方法進(jìn)行致敏,霧化或滴鼻方法進(jìn)行激發(fā)[14]。然而在現(xiàn)有建立小鼠哮喘模型的激發(fā)方式方法中,經(jīng)鼻腔激發(fā)易使激發(fā)液經(jīng)過(guò)口腔進(jìn)入消化道,從而造成不同個(gè)體間呼吸道攝入激發(fā)量的差異和激發(fā)液的浪費(fèi);國(guó)外雖有已出現(xiàn)專門用于小鼠的霧化裝置,但價(jià)格昂貴[7],故國(guó)內(nèi)多采用自制的霧化裝置,但因霧化裝置未標(biāo)準(zhǔn)化常導(dǎo)致小鼠哮喘模型的不穩(wěn)定,也不能明確定位病變部位,所以需采用新的激發(fā)方式精準(zhǔn)定位定量,提高模型的穩(wěn)定性。
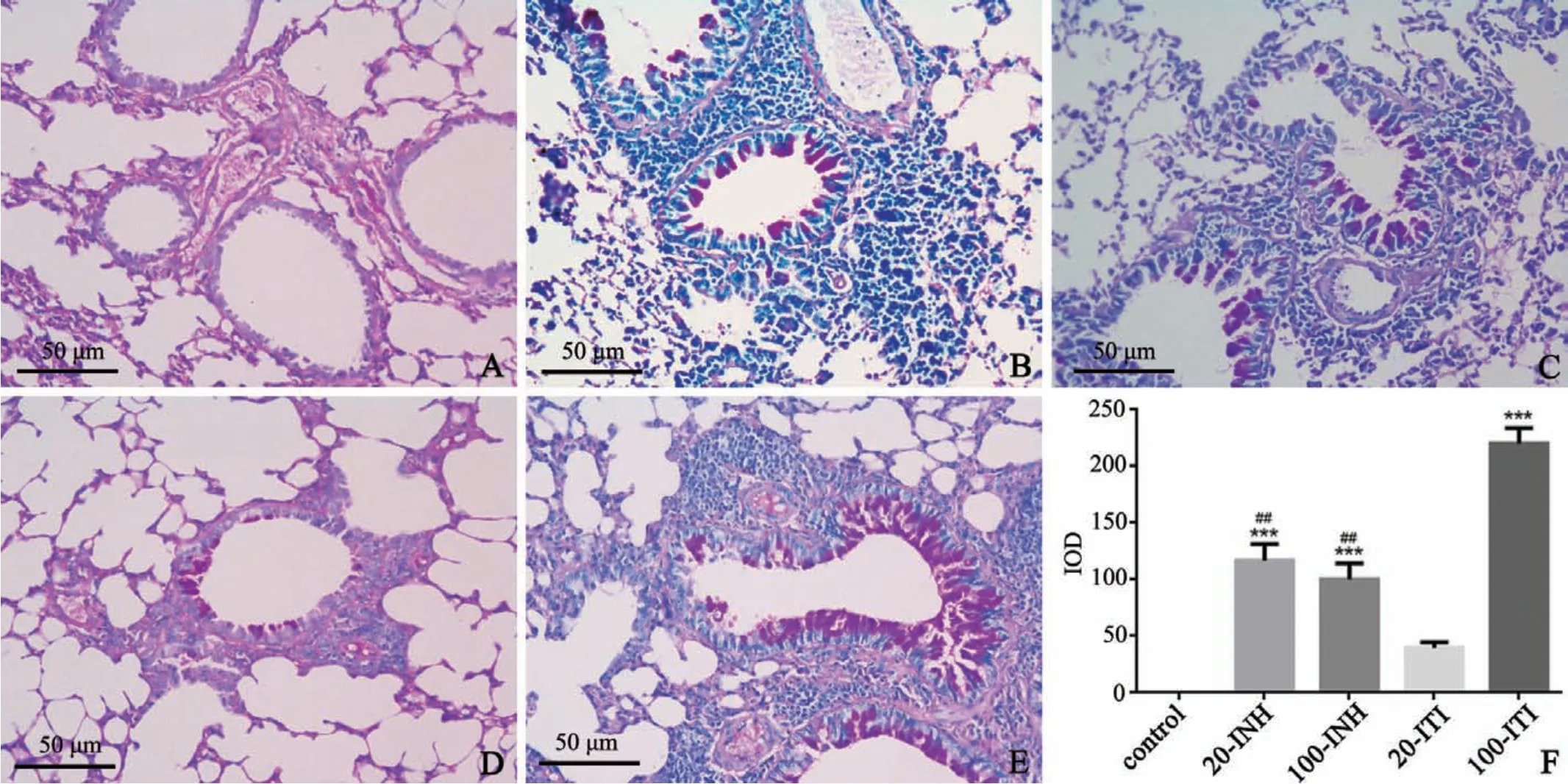
圖5 各組小鼠肺組織PAS染色A:對(duì)照組B:20-INH組C:100-INH組D:20-ITI組E:100-ITI組F:IOD,與對(duì)照組相比,***P<0.001;與100-ITI組相比,##P<0.01,n=6Fig.5 PAS staining of lung tissue in each group of miceA:control group;B:20-INH group;C:100-INH group;D:20-ITI group;E:100-ITI group;F:IOD,compared with control group,***P<0.01,compared with 100-ITIgroup,##P<0.01,n=6

圖6 各組小鼠肺組織Masson染色A:對(duì)照組B:20-INH組C:100-INH組D:20-ITI組E:100-ITI組F:IOD,n=6Fig.6 Masson staining of lung tissue in each group of miceA:control group;B:20-INH group;C:100-INH group;D:20-ITIgroup;E:100-ITIgroup;F:IOD,n=6

圖7 ELISA檢測(cè)血清總IgE含量與對(duì)照組相比,***P<0.001,*P<0.05;與100-ITI組比較,##P<0.01,#P<0.05,n=6Fig.7 Total IgEin serum detected by ELISAcompared with control group,***P<0.001,*P<0.05;compared with 100-ITIgroup,##P<0.01,#P<0.05,n=6
本研究前期發(fā)現(xiàn),經(jīng)口氣管插管方法明確將藥物作用在氣管上,擴(kuò)散至下氣道[15],對(duì)哮喘病理基礎(chǔ)氣道炎癥的研究準(zhǔn)確定位。類似的給藥方法已成功應(yīng)用于肺纖維化模型的構(gòu)建[16],故該技術(shù)成熟可行。因此,我們采取經(jīng)口氣管插管激發(fā)的方式用BALB/c雌性小鼠建立哮喘小鼠模型,與霧化激發(fā)建模進(jìn)行比較,同時(shí)哮喘模型0VA致敏劑量多在10~100μg不等,其中10~20μg最常見[3],所以我們選擇最常見劑量20μg和最大劑量100μg兩種劑量進(jìn)行建模。綜上,本研究在不同致敏劑量上采用了兩種激發(fā)方式構(gòu)建小鼠哮喘模型,將經(jīng)口氣管插管激發(fā)建立的哮喘模型與霧化激發(fā)的哮喘模型在氣道高反應(yīng)性、氣道炎癥和血清總IgE水平等方面進(jìn)行比較,以期選擇出一種價(jià)格適宜,同時(shí)能減少同批次間模型差異性,提高小鼠哮喘模型穩(wěn)定性的建模方法。
本研究結(jié)果顯示,在小鼠氣道高反應(yīng)性中,經(jīng)口氣管插管激發(fā)與霧化激發(fā)所建模型均能明顯提高小鼠氣道高反應(yīng)性,兩種方法間沒(méi)有明顯的差異,表明經(jīng)口氣管插管激發(fā)的方式能夠達(dá)到霧化激發(fā)建模效果;BALF細(xì)胞總計(jì)數(shù)中,各哮喘組中除20-ITI組外BALF細(xì)胞總數(shù)升高明顯,經(jīng)口氣管插管激發(fā)小鼠哮喘模型細(xì)胞總數(shù)與霧化激發(fā)哮喘模型沒(méi)有明顯差異,同時(shí)經(jīng)口氣管插管激發(fā)組的數(shù)據(jù)標(biāo)準(zhǔn)差小于霧化激發(fā)組,表明經(jīng)口氣管插管激發(fā)哮喘模型組內(nèi)數(shù)據(jù)離散程度低于霧化激發(fā)哮喘模型組,穩(wěn)定性較好;在BALF嗜酸性粒細(xì)胞分類計(jì)數(shù)中,各哮喘組其嗜酸性粒細(xì)胞計(jì)數(shù)均高于對(duì)照組,且在100μg OVA致敏劑量下,經(jīng)口氣管插管激發(fā)組中BALF嗜酸性粒細(xì)胞計(jì)數(shù)高于霧化激發(fā)方式;血清總IgE水平檢測(cè)表明,經(jīng)口氣管插管激發(fā)比霧化激發(fā)建立的小鼠哮喘模型更好的提升其血清總IgE含量,同時(shí)結(jié)合BALF中嗜酸性粒細(xì)胞總數(shù)提高,表明經(jīng)口氣管插管激發(fā)較霧化激發(fā)更易引起哮喘小鼠的過(guò)敏性質(zhì);肺組織病理切片HE染色結(jié)果表明,經(jīng)口氣管插管激發(fā)與霧化激發(fā)均可在小鼠哮喘模型引起氣管及血管周圍炎癥細(xì)胞浸潤(rùn),浸潤(rùn)程度無(wú)差異,而在糖原PAS染色中,可明顯發(fā)現(xiàn)經(jīng)口氣管插管激發(fā)建立的小鼠哮喘模型其氣管比霧化激發(fā)可以引起較多的粘液分泌,在Masson染色中,經(jīng)口氣管插管激發(fā)小鼠哮喘模型其氣道周圍纖維增生較霧化激發(fā)有增多趨勢(shì),但兩種激發(fā)方式與對(duì)照組無(wú)統(tǒng)計(jì)學(xué)差異;各哮喘模型組中各指標(biāo)數(shù)據(jù)中的標(biāo)準(zhǔn)差SD值結(jié)果顯示,經(jīng)口氣管插管激發(fā)所建哮喘模型SD值低于霧化激發(fā)所建哮喘模型,表明前者組內(nèi)數(shù)據(jù)離散程度小,所建小鼠哮喘模型更穩(wěn)定。
同時(shí),研究結(jié)果發(fā)現(xiàn),20μg霧化激發(fā)組與20μg經(jīng)口氣管插管激發(fā)組只是在激發(fā)階段給藥方式上有差異,其致敏階段給藥劑量和方式一致,但這兩組實(shí)驗(yàn)結(jié)果在氣道高反應(yīng)性、氣道炎癥、氣道粘液分泌和血清總IgE水平升高方面均有明顯差異,從而提示20 μg OVA致敏劑量經(jīng)口氣管插管激發(fā)不能完全引發(fā)氣道哮喘炎癥。在霧化激發(fā)組中,20μg和100μg OVA組在激發(fā)階段給藥方式和劑量完全一致,僅在致敏階段藥物劑量上有所差異,但它們均能成功建立哮喘模型,并在氣道高反應(yīng)性、氣道炎癥、氣道粘液分泌以及血清總IgE水平無(wú)明顯差異,提示致敏階段致敏劑量的差異對(duì)哮喘模型建立影響不大。在100μg OVA致敏劑量下,經(jīng)口氣管插管激發(fā)組與霧化激發(fā)組在致敏階段途徑和劑量完全一致,僅在激發(fā)階段給藥方式有差異,但前者的嗜酸性粒細(xì)胞絕對(duì)值、血清總IgE水平、氣道粘液水平均明顯升高,提示激發(fā)階段使用經(jīng)口氣管插管激發(fā)直接作用于氣道更易引發(fā)機(jī)體變態(tài)反應(yīng)和氣道粘液高分泌。
綜上所述,經(jīng)口氣管插管激發(fā)方式可以在100 μg OVA致敏劑量時(shí)成功的建立小鼠哮喘模型,該小鼠哮喘模型具有明顯氣道高反應(yīng)性、氣道炎癥、氣道粘液高分泌和血清高IgE水平,同時(shí)與霧化激發(fā)小鼠哮喘模型相比,該模型差異性小,穩(wěn)定性更高。

