高效液相色譜法測定烯丙孕素微囊中烯丙孕素的含量
王 忠,鮑光明,王小鶯,劉寶生,陳文婷,黃小晴,彭劍玲,王立琦
(江西農業大學動物科學技術學院,南昌 330045)
烯丙孕素(Altrenogest)為C19-去甲睪酮的衍生物,是一種動物用合成孕激素,通過抑制促性腺激素(黃體生成激素和促卵泡成熟激素)的分泌阻斷母畜發情和排卵,調控發情周期。美國、歐盟等國家已批準其用于馬和豬的同期發情、調節豬的批次生產節律。該藥口服吸收快,主要分布于肝臟,經Ⅱ相代謝,主要排泄途徑為糞便,其次為尿液。由于該藥難溶于水,在環境中易光解[1],現有產品為油性溶液,需噴擠口服給藥,使用不便利。微囊化技術是利用天然或合成的高分子成膜材料把液體或固體藥物包嵌形成直徑 1~500 μm 微小膠囊的技術[2]。該技術是近四十年來應用于藥物制劑的新方法,在獸藥領域也得到了廣泛應用。將藥物制成微囊有以下作用:(1)掩蓋藥物的不良氣味,如恩諾沙星微囊、替米考星微囊等;(2)提高藥物穩定性,如魚肝油微囊;(3)防止藥物在胃內失活或減少對胃的刺激性。微囊技術提高藥物穩定性的原理為:囊心(即藥物)被包裹而與外界環境隔離,可使其免受外界的濕度、氧氣、紫外線等因素的影響,從而保證了藥物的穩定。服用后壁材降解,藥物又能被釋放出來[3]。采用復凝聚法制得烯丙孕素微囊,提高了其對光和熱的穩定性,藥物貯存的穩定性,以及給藥方式的多樣化選擇。微囊制劑中藥物含量的測定需要解決的主要問題是如何使藥物完全釋放,這對于微囊制劑的質量控制非常重要[4-5]。為了對自制烯丙孕素微囊制劑進行含量檢測及質量評價,以對其進行質量控制,有必要建立準確可靠的含量檢測方法。目前,關于烯丙孕素測定方法的研究多集中在生物樣品如血液、動物組織中,制劑方面僅見口服液中烯丙孕素含量檢測方法的建立。關于微囊中烯丙孕素的含量檢測尚無相關研究報道。本文擬建立一種高效液相色譜法用于測定通過復凝聚法制得的微囊中烯丙孕素的含量,并根據《獸用化學藥物質量控制分析方法驗證技術指導原則》對該方法的專屬性、線性、準確度及精密度進行驗證。
1 材料與方法
1.1 儀器 Waters 1525高效液相色譜儀,美國Waters公司;FB224自動內校電子分析天平,舜宇恒平科學儀器有限公司;SB25-12DTD超聲波清洗儀,寧波新芝生物科技股份有限公司;XW-80A旋渦混合儀,海門市其林貝爾儀器制造有限公司;超純水制備系統:F3PN33491型,美國Millipore公司。
1.2 藥品與試劑 烯丙孕素原料藥(含量99.9%),江蘇遠大信宜藥業有限公司;烯丙孕素微囊,自制;無水乙醇,分析純,西隴化工股份有限公司;甲醇、乙腈,色譜純,美國天地有限公司。
1.3 方法
1.3.1 溶液的配制
1.3.1.1 烯丙孕素乙醇溶液的配制 精密稱取10 mg烯丙孕素原料藥于10 mL棕色容量瓶中,用無水乙醇溶解并稀釋至刻度,搖勻,配制成1 mg/mL烯丙孕素原料藥母液。用無水乙醇稀釋母液獲得不同濃度工作液,現配現用。
1.3.1.2 烯丙孕素微囊溶液及空白微囊溶液的配制 精密稱取10 mg烯丙孕素微囊于10 mL棕色容量瓶中,用無水乙醇30 ℃溫度條件下超聲溶解15 min后,定容至刻度,搖勻,配制成1 mg/mL烯丙孕素微囊母液。用無水乙醇稀釋母液獲得不同濃度烯丙孕素微囊工作溶液。用同樣的方法配制空白微囊溶液母液及工作液。
1.3.2 色譜條件 色譜柱為Kromasil 100-5C18色譜柱(250 mm×4.6 mm,5 mm);流動相為水-乙腈(30∶70,V/V);流速1.0 mL/min;柱溫 30 ℃;檢測波長 236 nm;進樣量20 μL。
1.3.3 專屬性試驗 分別取不含烯丙孕素的空白微囊輔料溶液、烯丙孕素原料藥溶液(20 μg/mL)、以及已知濃度微囊提取液中添加烯丙孕素原料藥溶液(0.1 mg/mL),按1.3.2項色譜條件進樣分析,記錄色譜圖,以考察空白微囊輔料對烯丙孕素是否有干擾。
1.3.4 標準曲線的建立 用無水乙醇稀釋1 mg/mL的烯丙孕素原料藥母液,配制1、2、5、10、20、50、100 mg/mL的烯丙孕素系列標準溶液,用0.22 mm的針筒式過濾器過膜后,按1.3.2項的色譜條件進樣分析。以測得的烯丙孕素色譜峰面積為縱坐標,濃度為橫坐標,進行線性回歸,得到回歸方程、相關系數及標準曲線圖。
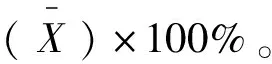
1.3.6 準確度試驗 精密移取10、20、30 mg/mL烯丙孕素原料藥溶液各0.5 mL,添加至0.5 mL 30 mg/mL的烯丙孕素微囊提取液中,制備成5.0、10、15 mg/mL三個濃度的供試液,每個濃度平行制備三份。旋渦混勻后,用0.22 mm的針筒式過濾器過膜,按1.3.2項的色譜條件進樣分析,記錄峰面積,計算3個不同添加濃度的加樣回收率、平均回收率、RSD。其中,加樣回收率=加樣后測定值/加入原料藥含量×100%,RSD按1.3.5項所列公式進行計算。
1.3.7 穩定性試驗 取20 μg/mL的烯丙孕素原料藥溶液,分別于0、2、4、8、12 h,按1.3.2項的色譜條件進樣分析,以峰面積計算烯丙孕素的(n=5)的RSD。
1.4 數據處理 所有數據采用Excel進行統計學分析。
2 結果與分析
2.1 專屬性試驗 烯丙孕素原料藥溶液、微囊提取液及空白輔料中烯丙孕素的典型色譜圖如圖1所示。由圖可見,烯丙孕素保留時間為5.591 min。在烯丙孕素保留時間2.5%范圍內,無干擾峰出現。說明該方法的專屬性良好。
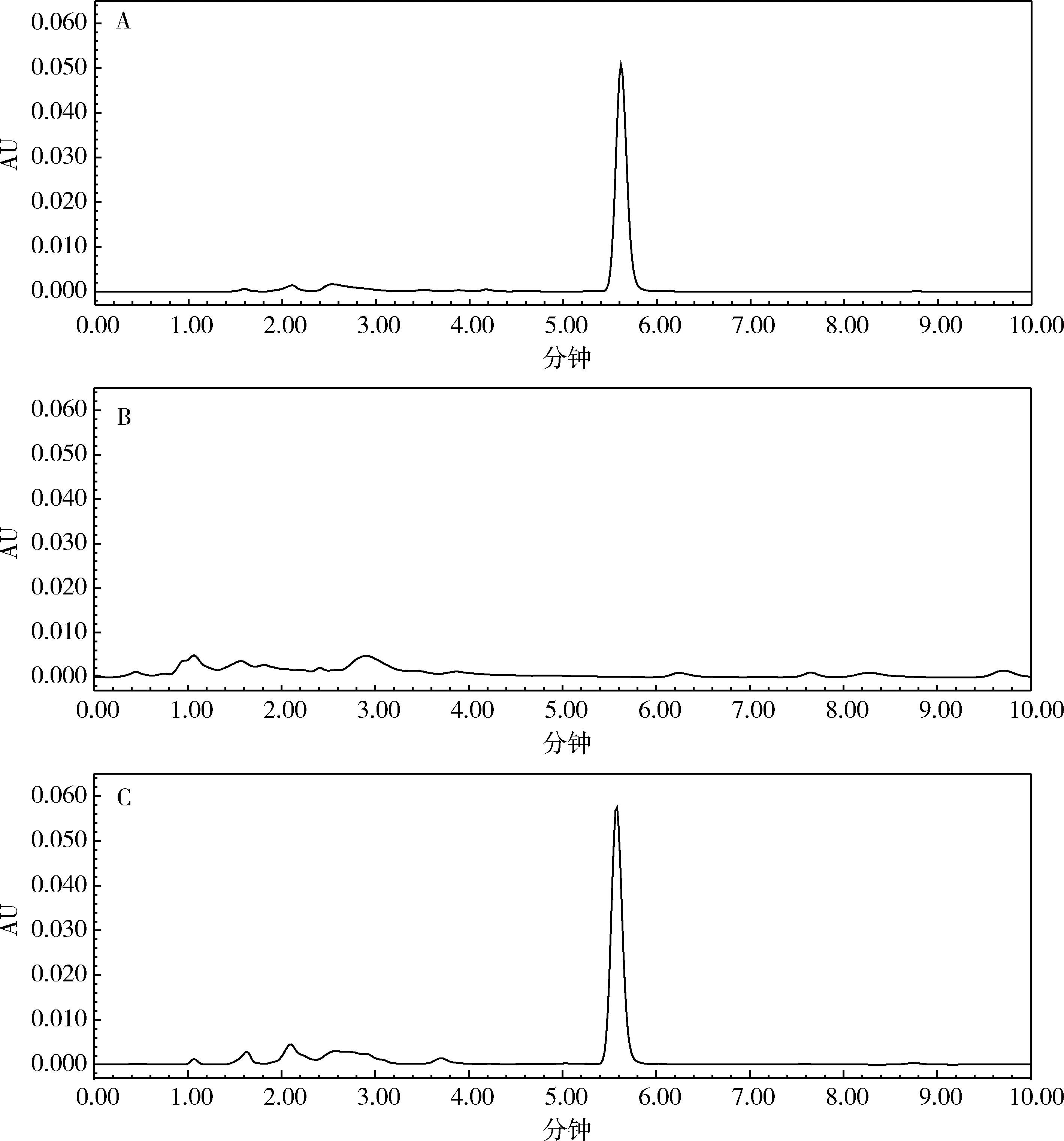
A為烯丙孕素原料藥溶液(50 mg/mL);B為空白輔料;C為已知微囊提取液中添加烯丙孕素原料藥溶液(添加濃度為5 mg/mL,實際濃度為17.67 mg/mL)
2.2 標準曲線的制備 烯丙孕素在5~30 mg/mL濃度范圍內,線性關系良好,標準曲線方程為A=21468C-10887,R2=0.9993,滿足檢測要求。烯丙孕素原料藥標準曲線如圖2所示。
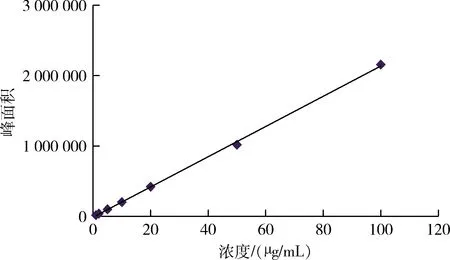
圖2 烯丙孕素原料藥標準曲線
2.3 精密度試驗 以烯丙孕素的峰面積計算,三個濃度的RSD分別為0.83%、1.16%和1.8%(表1),符合方法學RSD不大于2%的要求。
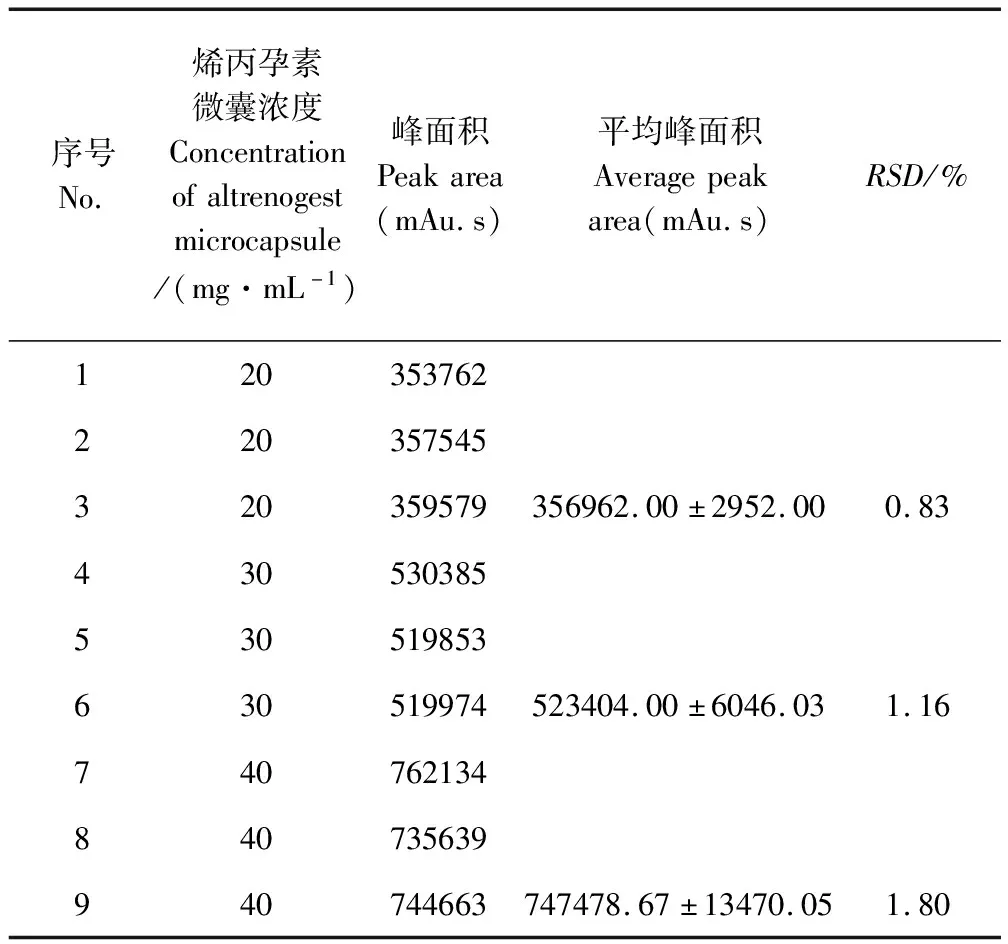
表1 三個濃度水平烯丙孕素微囊溶液的精密度
2.4 準確度試驗 在5、10、10 mg/mL添加濃度下,每個濃度做3個重復,對烯丙孕素的加樣回收率進行評價。結果如表2所示,5、10、10 mg/mL三個濃度下烯丙孕素的平均回收率分別為101.25%、99.82%和101.81%,RSD分別為1.09、0.60和0.69,符合方法學的要求。
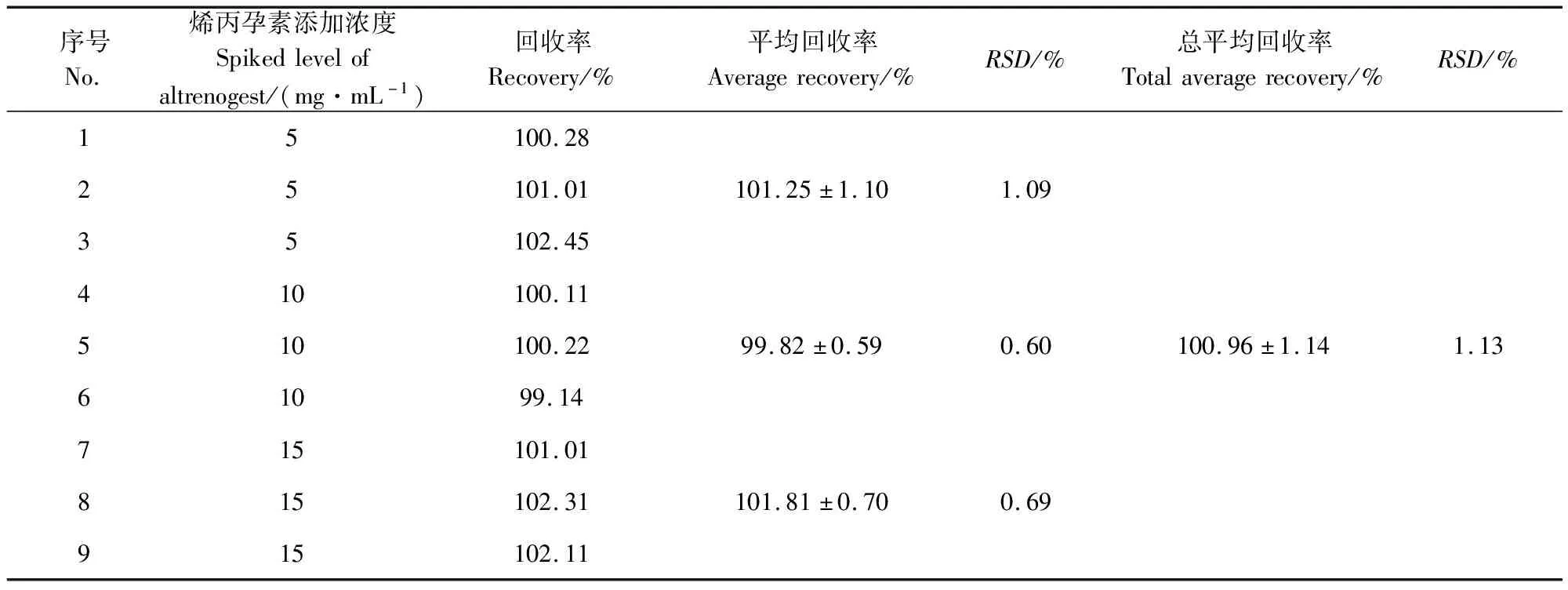
表2 三個添加濃度下烯丙孕素的回收率
2.5 穩定性試驗 通過對1、5、20 μg/mL的烯丙孕素原料藥溶液,分別于0、2、4、8、12 h進行測定,以峰面積計算烯丙孕素的(n=5)的RSD分別為1.30%、0.55%、0.48%,表明供試樣品隨著樣品濃度的升高穩定增加,但三個濃度在12 h內均穩定(表3)。
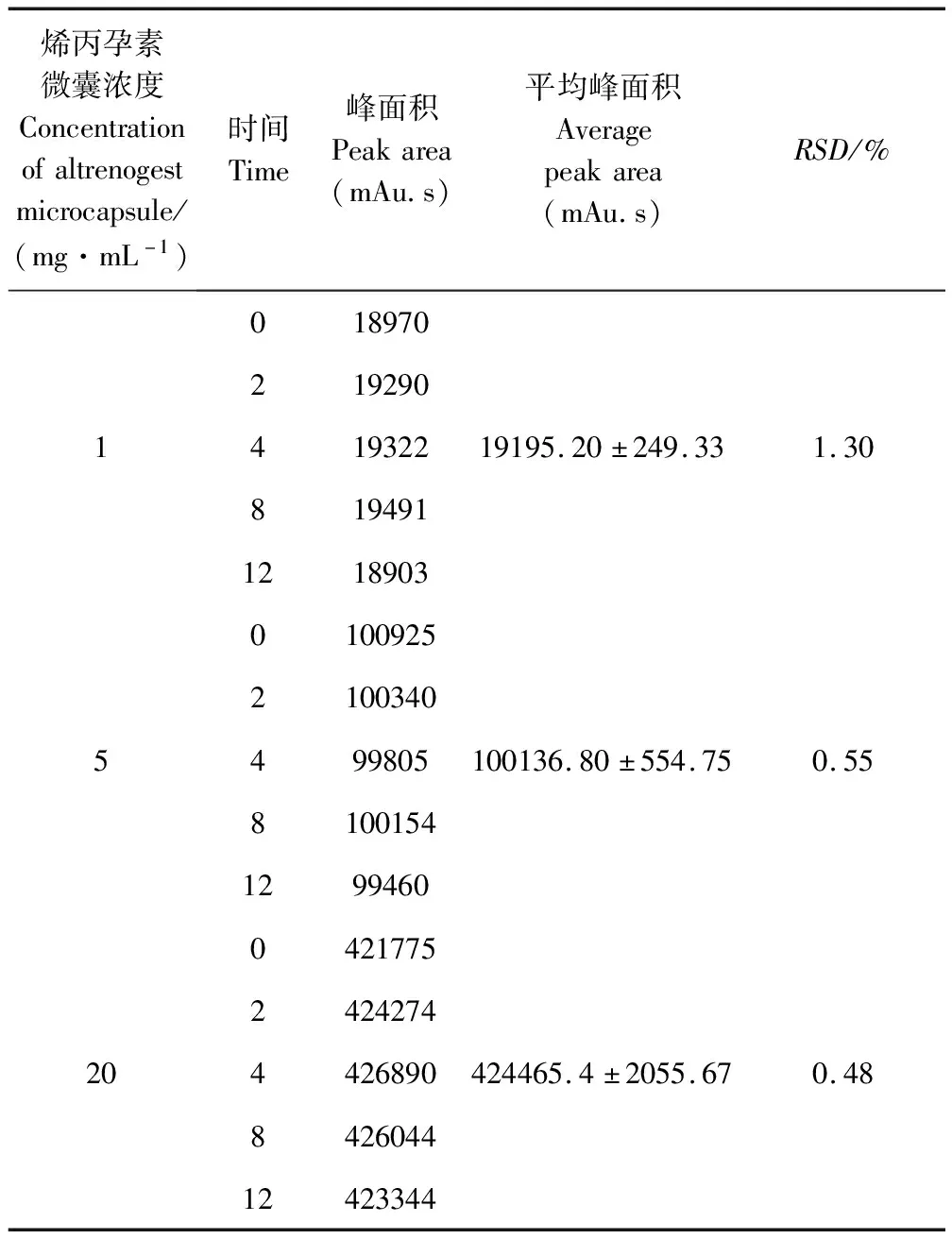
表3 三個濃度水平烯丙孕素原料藥溶液的穩定性
3 討論與結論
當前,在規模化養豬場,后備母豬發情率偏低、斷奶問題母豬久不發情等情況普遍存在。母豬同期發情主要是指利用外源激素誘導母畜群體在同一時期內集中排卵和發情的技術,該技術可有效提高后備母豬發情率、配懷率以及窩均產仔數,顯著提高豬場的生產管理水平。國外已將烯丙孕素作為養豬生產中必不可少的同期發情劑,且指出無替代產品[6]。目前烯丙孕素制劑主要為口服液[7],以及用于馬的5%注射劑(Readyserve?Injection)等。由于烯丙孕素存在對光、熱不穩定等缺點,因此,開發微囊制劑以提高烯丙孕素在用藥過程中的穩定性以及便利性十分有意義。建立微囊中烯丙孕素的含量檢測方法,則有利于對該制劑進行質量控制。
目前,關于烯丙孕素測定方法的研究多集中在生物樣品如血液、動物組織、尿液中,包括藥動學研究中采用高效液相色譜-串聯質譜(High performance liquid chromatography-tandem mass spectrometry, HPLC-MS/MS)法測定馬[8-10]和豬[11-12]血漿中烯丙孕素濃度,以及殘留消除研究中采用(Ultra high performance liquid chromatography-tandem mass spectrometry, UPLC-MS/MS)法測定組織樣品[13-16]、尿液[17-18]中烯丙孕素的濃度。制劑方面,姜淋潔等[7]用異丙醇-正己烷(5∶20)對烯丙孕素口服液進行前處理后,采用正相高效液相色譜法測定其含量。
3.1 微囊處理條件的優化 由于烯丙孕素作為芯材被包裹在明膠和阿拉伯膠形成的微囊中,因此,要檢測微囊中烯丙孕素的含量,首先要將微囊破壞,使其從微囊中釋放出來。微球中藥物含量測定一般采用酶解法、溶劑提取法、超聲處理、研磨提取法等[5]。酶解法可將載體材料的網狀結構破壞,從而使藥物完全釋放出來[19],但耗時較長,且酶的價格昂貴。研磨提取法則具有微囊用量較大,且需要從研缽中轉移,造成藥物的損失等缺點。蔡杰等[20]采用研磨-超聲法萃取微囊中的天然維生素E,需要稱取1 g左右微囊于研缽中,加適量水和正己烷進行研磨后,置超聲波清潔器中振蕩,定量轉移到125 mL的分液漏斗中,再用正己烷進行萃取。本文采用溶劑-超聲法對烯丙孕素進行萃取。由于烯丙孕素易溶于甲醇、乙睛、乙醇等有機溶劑,難溶于水[21],因此,對比了甲醇與無水乙醇作為溶劑進行萃取,發現二者萃取效果相當,最終選擇毒性更小的無水乙醇作為萃取溶劑。研究過程中發現,常溫下超聲,萃取效果較差,將超聲溫度提高到30 ℃時,則可以有效提高萃取率。同時,考察了超聲時間對微囊的破壞情況,發現10 min左右可以使微囊全部破裂,故本試驗選擇超聲15 min。此外,由于烯丙孕素對光和熱不穩定,萃取溫度不可設置過高,且應注意避光操作。
3.2 高效液相色譜條件的選擇 通過對烯丙孕素進行紫外-可見光全波長掃描,并參考文獻報道的色譜條件[21],最終選擇236 nm作為烯丙孕素的檢測波長。對比了高立會等[21]采用的乙腈∶0.01%磷酸水=(7∶3,V/V)和乙腈∶水(7∶3,V/V)作為流動相對色譜峰峰形的影響,發現二者均可獲得較好峰形,差異較小,因此,最終選擇無需配制的乙腈∶水(7∶3,V/V)作為流動相。
本文建立了一種測定烯丙孕素微囊含量的高效液相色譜法,該方法具有專屬性強、線性關系良好、準確度高和重復性好等特點,符合方法學驗證的要求。且樣品萃取方法簡單、所需試劑價格便宜,便于應用。該含量測定方法可用于烯丙孕素微囊中烯丙孕素的含量測定,以期為微囊的質量評價和質量標準的制定奠定基礎,并為其進一步研究和開發提供依據。

